镉胁迫下菜心的转录组分析
2018-09-27张尉欣唐玉林
张尉欣,刘 阳,刘 帅,唐玉林,2
1)深圳大学生命与海洋科学学院,广东省植物表观遗传学重点实验室,广东深圳 518060;2)深圳市海洋生物资源与生态环境重点实验室,广东深圳 518060
镉(cadmium,Cd)因其生物有效性高,与其他重金属(Cu、Pb和As)相比更容易被植物吸收,2001年被联合国环境规划署列为全球性危害化学物质之首.Cd胁迫下植株会出现矮化、发育推迟和产量减少等毒害效应[1].植物通过调控许多生物学过程而产生胁迫响应,如金属硫蛋白和植物螯合肽的螯合作用、Cd2+的区室化、硫的同化作用、抗氧化机制的激活、细胞壁组分对Cd的固定或胞外分泌物与Cd2+的结合等[2-3].这些过程的发生离不开相关基因的表达调控,植物响应Cd胁迫的机理研究已在拟南芥、水稻等植物中有报道[4-5],但调控网络有待深入认识.
菜心,又名菜薹(Brassicarapassp.chinensisvar.parachinensis),为十字花科芸苔属植物,是一种对镉不敏感且高积累的植物[6],也是中国广东地区主要种植的蔬菜,而南方地区土壤的镉污染较为严重,这势必造成菜心的镉污染风险.然而,关于菜心应对Cd胁迫及Cd的吸收、转运及积累机制目前尚不明确.本研究以菜心为研究对象,通过对菜心Cd2+处理前后的叶和根部进行转录组测序和差异表达基因分析,获得Cd胁迫后的差异表达基因,为研究菜心的镉胁迫响应机制,筛选、培育低Cd积累的菜心品种提供理论依据.
1 材料与方法
1.1 试供材料
以萌发后水培15 d的菜心品种“油青49”幼苗为材料,以50 μmol/L Cd(NO3)2的霍格兰营养液处理幼苗.以处理前(CK)的材料为对照组,处理48 h的材料为处理组,每3株菜心为1个生物学重复,设3个生物学重复,分别取叶部(L1、L2、L3)和根部(R1、R2、R3),液氮速冻后,置于-80 ℃冰箱保存.
1.2 cDNA文库构建
用Trizol提取样品总核糖核苷酸(ribonucleic acid,RNA),构建信使RNA(messenger RNA,mRNA)测序文库并送北京诺禾致源生物信息科技有限公司进行测序,获得转录组数据.
1.3 转录组生物信息学分析流程
对转录组原始数据进行生物信息学分析的流程如下:① 数据质量控制;② 与参考基因组比对映射;③ 计算基因表达量;④ 差异表达分析;⑤ 差异表达基因的富集分析.具体方法如下.
1.3.1 转录组数据与参考基因组的比对
原始数据利用Trim Galore(v 0.4.1)进行质控分析,清除接头和测序质量较低的reads等,得到clean reads后使用HISAT2[7](v 2.0.5)与参考基因组大白菜Brassicarapa(IVFCAASv1)[8]进行比对映射,比对结果使用gnm_region_dist(v2.8)计算读段(reads)并使用TBtools[9]量化基因表达量,以FPKM (fragments per kilobase of exon per million fragments mapped)表示.
1.3.2 差异表达基因的筛选
使用软件edgeR[10]进行基因的差异表达分析,分别将叶部和根部的处理组和对照组相比较,获得两个差异表达基因(differential expressed gene,DEG)的集合.采用Benjamini Hochberg校正方法对P值进行校正得到校正后的P值,以差异表达倍数(fold change, FC)和错误发现率(false discovery rate, FDR)作为差异表达基因的筛选条件,筛选阈值为|lb FC|≥1,FDR<0.05.
1.3.3 差异表达基因富集分析
将全部基因的蛋白序列输入到AgBase v 2.0(http://agbase.arizona.edu/index.html)进行GO注释,同时利用KOBAS 3.0(http://kobas.cbi.pku.edu.cn/index.php)进行KEGG注释,注释结果整理后用于后续富集分析.使用WEGO(http://wego.genomics.org.cn/)和TBtools分别进行差异表达基因的KEGG和GO富集分析.
1.3.4 实时荧光定量PCR
从转录组结果中选择9个差异表达基因进行实时荧光定量PCR(real-time quantitative PCR,qRT-PCR),使用的仪器以及试剂分别为:StepOnePlusTM(Thermon Fisher)、SYBR premix ex taq kit(Takara).qRT-PCR验证引物序列如表1所示(内参基因actin引物序列参考文献[11]),将转录组数据与qRT-PCR结果使用软件Excel进行相关性分析,计算相关性系数R,验证转录组数据的可靠性.

表1 qRT-PCR验证所用引物序列
2 结果与分析
2.1 转录组数据与参考基因组的序列比对
将对照组叶部(CK_L)和根部(CK_R), Cd2+处理48 h的叶部(48H_L)和根部(48H_R)进行转录组高通量测序.共获得原始数据63.12 Gbit,去除质量低的reads后,各个样品过滤后得到的数据量达到3.7 Gbit以上,Q20值(碱基质量值高于20的百分比)均大于96%(表2),说明测序数据质量较好,能进行后续分析.
利用与菜心同种但不同亚种的大白菜(Brassicarapasubsp.pekinensis)基因组(IVFCAASv1)[8]作为参考基因组进行测序片段的比对.转录组数据与该参考基因组的比对率为88.5%~93.2%,唯一比对率为80.53%~89.87%.测序片段能够较好地比对到参考基因组上,表明测序结果可进行后续的差异表达分析.

表2 转录组数据与大白菜参考基因组比对分析
2.2 差异表达基因的数量及分布
利用edgeR[10]进行对照组和Cd处理组的差异表达分析,分别获得叶部和根部的差异表达基因集合.共3 854个差异表达基因,其中,Cd处理后叶部表达上调的基因有951个,下调的基因有1 269个;Cd处理后根部表达上调的基因有1 086个,下调的基因有754个.
2.3 差异表达基因的GO分类和富集分析
所有差异表达基因(3 854个)中,共有2 925个基因有GO注释信息.图1使用WEGO对2 925个差异表达基因进行GO分类,可见在细胞组分、细胞和细胞部分所占比例较高,其次是膜和细胞器.在分子功能中,结合和催化活性所占比例较高,其次是翻译调节活性和转运活性.在生物学过程中,细胞过程和代谢过程所占比例较高,其次是生物调节.

图1 差异表达基因GO注释以及分类分析Fig.1 GO annotation and classification of DEGs
进一步对所有差异表达基因进行GO富集分析.选取校正后的P<0.05的富集结果并按富集系数进行排序,并对排序前20的GO条目进行分析,富集选中的基因数为M, 背景基因数为N, 结果见表3.差异表达基因主要富集在与次生代谢物合成(GO号为0018160、0019419和0006553)、氧化还原反应(GO号为0004324、0016661和0004506)、光合作用(GO号为0009538、0009654和0009773)、铁离子稳态(GO号为0006879和0055072)、木质素或木栓质的合成及代谢(GO号为0010345和0046274)等有关的GO条目中.
木质素和木栓质是细胞壁中的重要组分,会影响Cd2+的吸收和运输[12-13],而Cd2+与Fe2+则可能通过相同的转运蛋白进行吸收和运输,并与细胞内铁离子的稳态有关[14].进一步对富集在木质素水解、木栓质的生物合成、铁离子稳态中的相关基因进行分析(图2),在木质素水解过程中富集到的差异表达基因主要是漆酶(laccase,LAC),除了LAC5、LAC7以及LAC12基因以外,其他大部分富集到的LAC基因在Cd胁迫后表达下调;而与木栓质的生物合成过程相关的CYP86、KCS2、FAR4、ABC基因在根部表达上调,在叶部表达下调或无明显变化;与维持细胞中铁离子稳态相关的基因如FER3和FER1基因在叶部和根部均表达下调,而ABC1、BHLH038和Nramp4基因则表达上调.
2.4 差异表达基因KEGG富集分析
对根和叶部中差异表达均上调和均下调基因分别进行KEGG通路的富集分析(P<0.05), 见表4和表5.差异表达上调的基因主要富集在植物病原菌互作、MAPK信号传导通路和植物激素信号传导、木栓质、黄酮以及萜烷等物质的生物合成、谷胱甘肽以及硫等物质代谢等通路中.差异表达下调的基因主要富集在光合作用、核糖体、生物素代谢、脂肪酸的生物合成、芥子油苷的生物合成等通路中.这些代谢通路的变化反映了受Cd胁迫的影响,菜心中与基础代谢相关的通路普遍下调.另一方面,与抵抗胁迫相关的信号转导通路的激活、次生代谢物的合成与代谢改变,亦是菜心应对Cd胁迫的一种主动防御方式.

表3 差异表达基因GO富集分析
1)为富集选中的基因数/背景基因数

图2 GO富集分析中部分GO亚分类的相关基因的表达趋势Fig.2 Gene expression trends of partial GO terms in GO significant enrichment analysis

通 路富集程度校正后P值植物病原菌互作/ plant-pathogen interaction2.101 1.22×10-7MAPK信号通路-植物/ MAPK signaling pathway-plant2.749 8.60×10-7角质、木栓质和蜡质生物合成/ cutin, suberine and wax biosynthesis4.265 5.45×10-5谷胱甘肽代谢/ glutathione metabolism2.969 5.21×10-5苯丙烷类生物合成/ phenylpropanoid biosynthesis2.138 4.34×10-4硫代谢/sulfur metabolism3.681 4.34×10-4甘油脂代谢/ glycerolipid metabolism2.629 0.002 甘油磷脂代谢/ glycerophospholipid metabo-lism2.329 0.004 黄酮和黄酮醇的生物合成/ flavone and flavonol biosyn-thesis6.702 0.005 倍半萜类化合物和三萜类化合 物的生物合成/sesquiterpe-noid and triterpenoid biosynthesis4.160 0.018 玉米素生物合成/ zeatin biosynthesis3.351 0.027 植物激素信号转导/plant hormone signal transduction1.484 0.037 半胱氨酸和蛋氨酸代谢/cysteine and methionine metabolism1.942 0.038
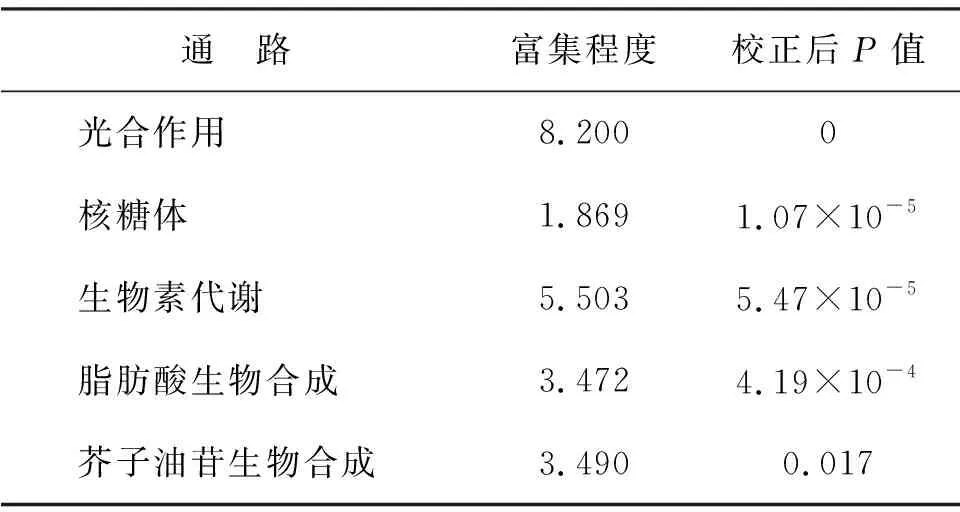
表5 差异表达下调基因KEGG富集分析
2.5 差异表达基因qRT-PCR结果分析的相关性
为验证转录组分析结果的可靠性,从差异表达基因中选取9个与离子转运相关的基因(YSL2、HMA2、ABCG40、CAX1、IRT1、Nramp1、MRP7、ZIP2和NRAMP4)进行qRT-PCR分析.结果显示,转录组数据与qRT-PCR结果基本一致,R=0.802 2(图3),说明转录组分析结果可靠.

图3 转录组数据与qPCR验证的相关性分析Fig.3 Correlation analysis of qPCR and transcriptome (RNA-seq) results
3 讨 论
经检索,至今尚缺菜心全基因组测序的研究报道,但进化研究均表明其属于芸薹(Brassicarapa)的一个亚种[12].目前,芸薹已经以大白菜Chiifu-401-42(B.rapassp.pekinensisline Chiifu-401-42)为材料完成了全基因组测序,并绘制了基因组草图[8].本研究以该基因组为参考基因组,将菜心的测序数据比对到该基因组上,比对效率较高,利用比对结果进行差异表达分析,对挖掘到的差异表达基因进行qRT-PCR验证,说明利用大白菜的基因组作为参考基因组进行菜心测序数据分析可行.
Cd胁迫下菜心的转录组分析结果表明,在Cd胁迫下差异表达基因主要富集到的GO条目包括:代谢过程、氧化还原反应、光合作用和铁离子稳态等,而KEGG主要富集的通路为光合作用、谷胱甘肽的代谢、硫代谢、核糖体和脂肪酸的生物合成等.这与水稻[16]、玉米[17]、杞柳[18]和白菜[19]等植物的Cd胁迫下转录组研究结果基本一致.
菜心中木栓质生物合成、木质素代谢和铁离子稳态的相关基因的表达也明显受到Cd胁迫影响.木栓质生物合成途径中的差异表达基因有KCS2、FAR4, 及两个ABC转运家族蛋白基因,它们分别与拟南芥中的AtKCS2、AtFAR4、AtABCG6和AtABCG2基因同源.拟南芥的AtKCS2[20]、AtFAR4[12]、AtABCG6以及AtABCG2[21]基因均与木栓质合成有关.推测Cd胁迫后,这些基因在根部的上调表达会使木栓质合成和含量增加,而木栓质是细胞壁中的具保护功能的疏水屏障[12],这一屏障的增厚可能会减少Cd2+进入菜心根细胞的量,减少对细胞的毒害.这些基因的差异表达意味着菜心根部在受到Cd胁迫后启动了这种保护机制.
在差异表达富集的木质素代谢途径的条目中,LAC11、LAC17和LAC4(IRX12)等基因已被证实参与细胞壁木质素多聚物合成[22-24].推测Cd胁迫后这些基因的下调可能会影响木质素的沉积,木质素的沉积减弱又会影响根部次生内皮层的发育,进而使根吸收的Cd2+向地上部分的转运更顺畅[13],这些基因表达变化是导致菜心植株在Cd胁迫后Cd含量普遍高于其他十字花科植物的可能原因之一.由此推测,Cd胁迫下菜心可能通过对细胞壁物质(木栓质和木质素等)的合成与代谢的协同调控,提高了其Cd耐受和积累能力,需进一步对基因功能和机理进行深入探讨.
已有研究表明,Cd会破坏植物的必需微量元素如铁、锌和铜等元素的动态平衡[25].图2表明,在Cd胁迫下,菜心中一些与铁离子稳态相关的基因的表达与拟南芥缺铁时的表达趋势一致:在缺铁时,AtNramp4基因表达上调[14],FER基因表达下调[26],bHLH038基因表达上调[27].也有研究表明,AtNramp3和AtNramp4蛋白除转运Fe2+外,还对Cd2+具有极高的转运能力[14].由此推测,Cd2+胁迫时菜心对Cd2+的吸收影响了细胞对铁离子的吸收及细胞内铁离子稳态,造成植物出现了类似缺铁的响应,而转运蛋白Nramp4基因等在叶部表达上调则有可能促进叶部Cd的转运,导致菜心叶部的高积累.
结 语
本研究以菜心为研究对象,通过对Cd处理前后的叶部、根部的mRNA进行高通量测序和分析,获得了该物种Cd胁迫后的差异表达基因,这些差异表达基因的功能和作用机制还需进一步探讨.本研究结果为筛选和培育Cd吸收少、积累低的菜心品种提供了理论基础.
