丙戊酸钠对AML1-ETO转染细胞中CEBPA基因表达及表观遗传修饰的影响*
2018-09-27庄文越李正祎陈子兴
庄文越, 李正祎, 刘 燕, 夏 薇△, 陈子兴
(1北华大学医学检验学院, 2吉林医药学院检验学院, 吉林 吉林 132013; 3苏州大学附属第一医院, 江苏省血液学研究所, 江苏 苏州 215000)
近年来,丙戊酸钠(sodium valproate,VPA)被发现具有抑制组蛋白脱乙酰酶(histone deacetylase,HDAC)活性的作用,属于HDAC抑制剂(HDAC inhibitor,HDACI)的短链脂肪酸类,可通过抑制HDAC的作用,使核小体组蛋白乙酰化,逆转HDAC参与的异常基因表达,从而引起广泛的抗肿瘤效应,包括诱导肿瘤细胞分化、阻滞细胞周期和促进肿瘤细胞凋亡、增强机体对化疗和放疗的敏感性及逆转转移性肿瘤的恶性表型等[1-2]。为研究AML1-ETO融合蛋白的致白血病机理,我们前期将AML1-ETO融合基因稳定转入白血病细胞株U937中,并以染色质免疫共沉淀技术(chromatin immunoprecipitation,ChIP)等技术已确认CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein α,CEBPA)基因是AML1-ETO融合蛋白结合的直接调控转录的下游基因之一。AML1-ETO融合蛋白通过修饰组蛋白的乙酰化和甲基化使CEBPA基因沉默,从而改变了U937-A/E细胞的增殖分化表型[3]。本研究以急性髓系白血病(acute myeloid leukemia,AML)U937-A/E细胞株为模型,研究VPA对AML1-ETO转染细胞中CEBPA基因表观遗传修饰的调控,探讨VPA诱导沉默的CEBPA基因再表达的可能机制,为表观遗传学调控治疗肿瘤提供理论基础。
材 料 和 方 法
1 主要试剂
蛋白酶抑制剂混合物、RNase、VPA、蛋白酶K和CCK-8试剂盒均购自Sigma;RPMI-1640培养基和胎牛血清购自Thermo Scientific;ChIP kit及抗乙酰化组蛋白H3(acetylated histone H3, AcH3)和AcH4 抗体均购自Millipore。
2 细胞培养和药物处理
将本室构建的稳定转染了重组质粒pcDNA3.1-AML1-ETO的亚克隆细胞株命名为U937-A/E1~4,设为实验组;将转染了空质粒pcDNA3.1(-)的U937细胞命名为U937-Mock,设为空载体组;U937-WT细胞由本实验室保存,为无质粒转染的野生型U937细胞,设为空白对照组。细胞以5×106/L的密度接种于含10%胎牛血清的RPMI-1640培养液中,于37 ℃、5% CO2和饱和湿度的培养箱中培养,每2 d换液传代。实验采用对数生长期的细胞,用不同浓度(0.1、0.5、1.0和2.0 mmol/L)的VPA分别处理细胞24 h、48 h和72 h,以不加药物组作为对照组,收集细胞并洗涤,进行相关检测。
3 主要方法
3.1CCK-8法检测细胞活力 取对数生长期细胞,接种单细胞悬液于96孔板,每孔100 μL(含8 000个细胞),每组设3个复孔,不同处理时间后,加入CCK-8溶液10 μL,继续培养2 h后在450 nm波长下,酶联免疫分析仪测定各孔吸光度(A),按照公式计算细胞生长抑制率。细胞抑制率(%)=(1-A实验组/A对照组)×100%。以抑制率为纵坐标,以药物浓度(mmol/L)为横坐标,绘制生长曲线。
3.2台盼蓝染色活细胞计数实验 将培养至对数生长期的细胞以每孔4×105个接种于6孔板,给予不同浓度VPA(0.1、0.5、1.0和2.0 mmol/L)作用不同时间(24 h、48 h和72 h),用浓度为0.1%的台盼蓝染色,3 min内用计数板分别计数活细胞和死细胞。镜下观察,死细胞被染成蓝色, 而活细胞拒染。
3.3流式细胞术检测细胞表面抗原 取对数生长期的U937-WT、U937-Mock和U937-A/E1~4细胞2×105个,每次每组设2孔,相同条件下重复3次,加PE-CD11b和FITC-CD14单抗,4 ℃培育30 min,PBS洗涤2次,用200 μL PBS混悬。用FACSCalibur流式细胞仪(Becton Dickinson)检测,CellQuest软件(Becton Dickinson)分析结果。
3.4RT-qPCR检测药物处理前后CEBPA mRNA的表达变化 首先应用Invitrogen的M-MLV反转录试剂盒进行cDNA合成。用SYBR Green染料法在ABI 7500型荧光实时定量PCR仪上进行qPCR扩增反应。CEBPA的上游引物序列为5’-CTTCAACGACGAGTTCCTGGCCGA-3’;下游引物序列为5’-AGCTGCTTGGCTTCATCCTCCT-3’。β-actin的上游引物序列为5’-TCCCTGGAGAAGAGCTACGA-3’,下游引物序列为5’-AGCACTGTGTTGGCGTACAG-3’。根据2-ΔΔCt法计算CEBPA的 mRNA相对表达量。
3.5ChIP-qPCR方法检测药物处理前后CEBPA基因组蛋白H3和H4的乙酰化状态 收集1×108细胞加入终浓度体积分数为1%的甲醛溶液,室温摇床孵育10 min,加入1/20体积的2.5 mol/L的甘氨酸,室温摇床孵育5 min后,4 ℃、400×g离心5 min,收集细胞用1×PBS洗2遍,细胞碎片用ChIP lysis buffer (Affymetrix)重悬,超声得到染色体平均大小为500 bp,利用抗AcH3和抗AcH4 抗体,按照Millipore的ChIP具体步骤操作。ChIP沉淀富集的样本,以CEBPA基因启动子区设计的引物进行PCR扩增,引物如下:上游引物5’-TGGACAAGAACAGCAACGAG-3’,下游引物5’-TTGTCACTGGTCAGCTCCAG-3’。ChIP沉淀富集的DNA用SYBR Green染料方法进行real-time PCR分析。有效数据的判断:(1)各样品的扩增曲线须达到平台期;(2)熔解曲线为单一的峰,并且熔解温度在75 ℃以上才能提示该扩增为特异性扩增。ChIP-qPCR的结果按%Input=2-ΔCt(normalized ChIP)公式处理数据,其中ΔCt(normalized ChIP)=Ct(ChIP)-[Ct(Input)-log2(Input Dilution Factor)],Input Dilution Factor= (fraction of the input chromatin saved)-1。
4 统计学处理
所有的实验重复3次,运用SPSS 22.0 软件对实验结果进行分析。定量资料结果以均数±标准差(mean±SD)表示,两独立样本之间均数比较采用t检验,多组样本之间均数比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1 VPA对U937及AML1-ETO转染细胞增殖的影响
CCK-8法结果表明,1.0 mmol/L及以上浓度的VPA在不同时点检测的细胞抑制率均有显著差异(P<0.05);在同一时点,不同浓度下的细胞抑制率之间有明显差异(P<0.05),随着浓度的增加,VPA的增殖抑制效应逐渐增强,呈现剂量和时间依赖性,见图1A。在活细胞计数实验中, 实验组细胞的增殖情况与对照组相比明显受到抑制, 差异有统计学意义(P<0.05),见图1B。后续的实验中以VPA 1.0 mmol/L为药物浓度组、48 h为作用时间进行分析。

Figure 1. The effect of VPA on the proliferation of U937 andAML1-ETOtransfected cells. A: the cell viability was measured by CCK-8 assay; B: the living cell numbers were counted by the method of Trypan blue exclusion. Mean±SD.n=3.△P<0.05vs0.1 mmol/L group;*P<0.05vs0 mmol/L group.
图1VPA对U937及AML1-ETO转染细胞增殖的影响
2 VPA诱导细胞髓系分化抗原的表达改变
CD11b和CD14是髓系标志,表达于较成熟的粒细胞和单核细胞。上述各组细胞经1.0 mmol/L VPA培养48 h后,亚克隆细胞株间的CD11b和CD14表达阳性率相互比较,显示AML1-ETO转染细胞株U937-A/E1~4的CD11b和CD14表达阳性率均显著低于U937-Mock和U937-WT细胞(P<0.05),这与药物处理前的分化抗原表达下降趋势是一致的。同时,药物处理后,与对照未加药组比较,CD11b和CD14的表达均明显升高(P<0.05),见图2。
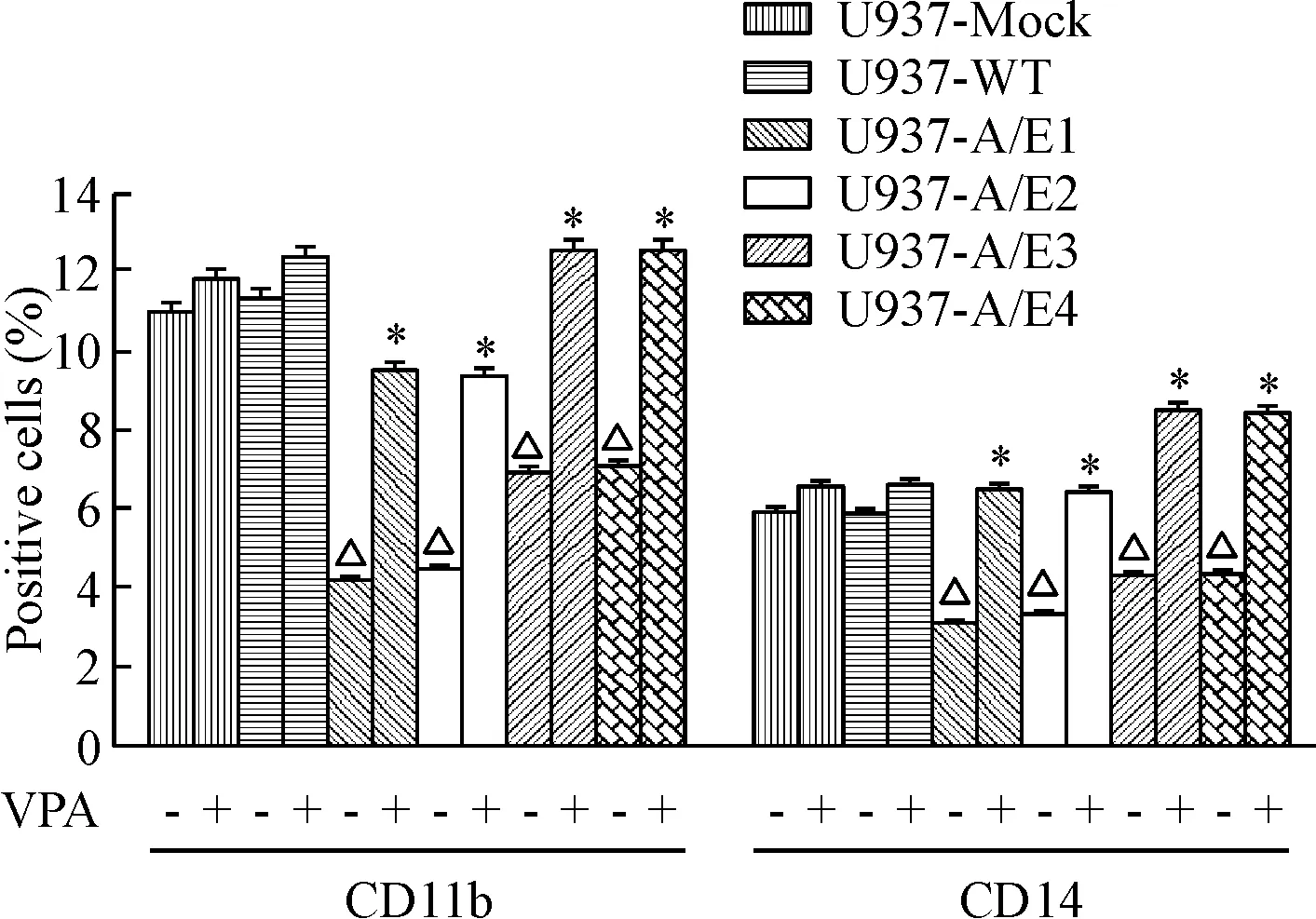
Figure 2. The effect of VPA on the expression of CD11b and CD14 in the U937 andAML1-ETOtransfected cells. Mean±SD.n=3.*P<0.05vsVPA-untreated group;△P<0.05vsU937-Mock or U937-WT.
图2VPA对U937及AML1-ETO转染细胞CD11b和CD14表达的影响
3 VPA对CEBPA mRNA表达水平的影响
采用RT-qPCR检测处理组和对照组细胞中CEBPA mRNA的表达水平。结果显示,经1.0 mmol/L VPA作用48 h后U937-A/E1~4各细胞株中,与对照组比较,VPA均明显上调CEBPA mRNA的表达水平(P<0.05),见图3。

Figure 3. The effect of VPA on mRNA expression of CEBPA. Mean±SD.n=3.*P<0.05vscontrol group.
图3VPA对CEBPAmRNA表达水平的影响
4 VPA作用前后CEBPA基因启动子表观遗传修饰的检测结果
用VPA处理细胞后,与药物处理前比较,CEBPA基因启动子区核染色质的组蛋白H3和H4乙酰化水平升高(P<0.05); 同时,VPA处理细胞后,各细胞株间比较发现,AML1-ETO转染细胞U937-A/E1~4的CEBPA启动子区所在染色质的H3及H4乙酰化水平均显著低于U937-Mock及U937-WT细胞(P<0.05),这些表观遗传学修饰的特征与药物处理前是一致的,见图4。
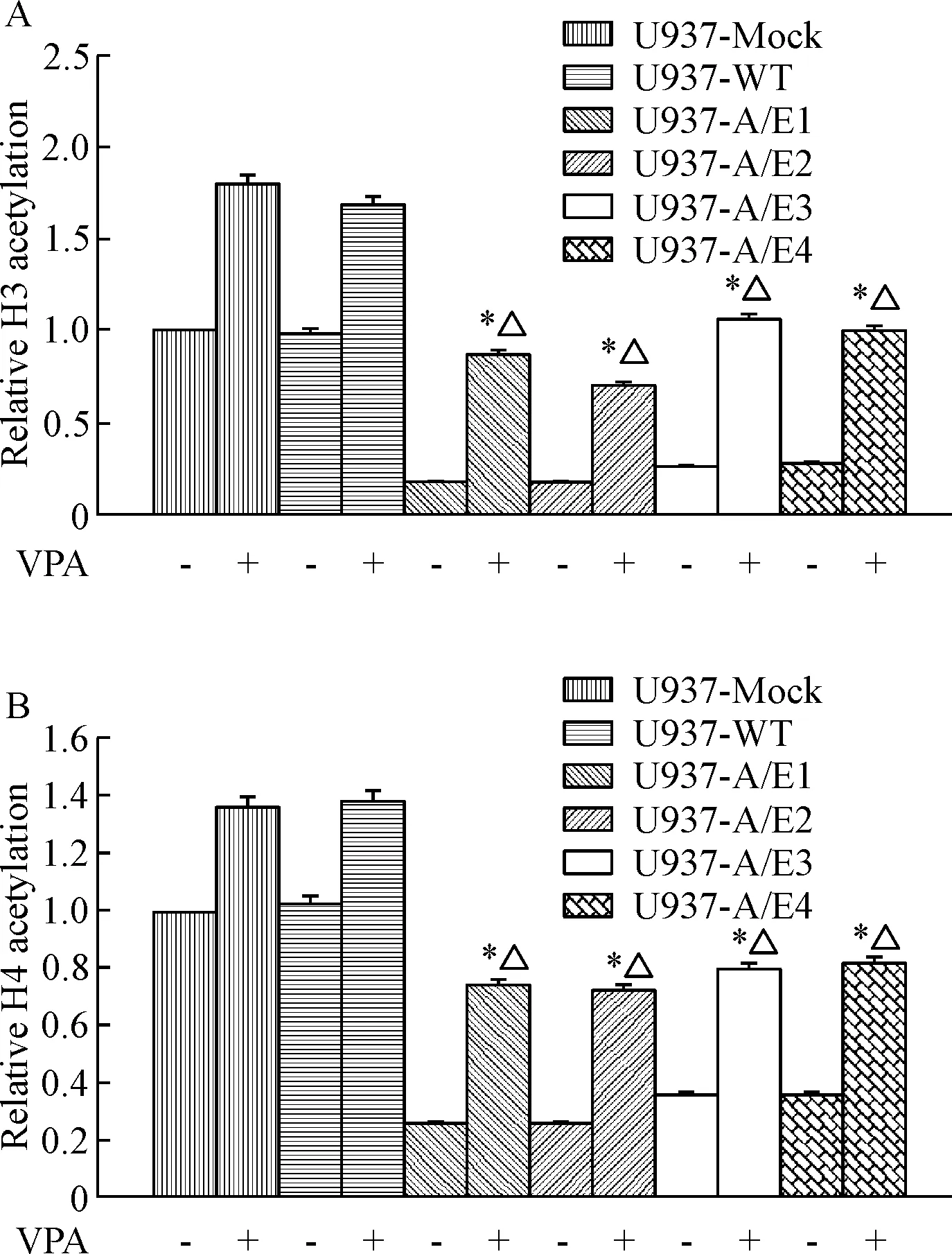
Figure 4. The effect of VPA on H3 and H4 acetylation ofCEBPAgene. A: H3 acetylation ofCEBPAgene; B: H4 acetylation ofCEBPAgene. Mean±SD.n=3.*P<0.05vsVPA-untreated group;△P<0.05vsU937-Mock or U937-WT.
图4VPA对CEBPA基因组蛋白H3和H4乙酰化水平的影响
讨 论
表观遗传修饰中组蛋白的乙酰化和去乙酰化修饰在真核细胞基因转录调控中发挥重要作用,而组蛋白乙酰化是一个可逆的动态过程,由组蛋白乙酰转移酶(histone acetyltransferases,HATs)和HDACs这一对酶的相互平衡进行调节。组蛋白的乙酰化和去乙酰化成为特定基因表达的切换开关[4],它们的功能紊乱是肿瘤发生发展的重要分子机制。肿瘤细胞中HDACs异常活化可导致一系列基因的转录受抑,所涉及的有与增殖调节、迁移、血管发生、细胞分化、侵袭和转移等相关基因[5]。VPA作为一种广泛应用于临床的广谱抗癫痫药物,是一种HDAC抑制剂,多项体外研究显示其可诱导多种肿瘤细胞分化与凋亡、导致细胞周期阻滞而抑制多种肿瘤细胞增殖[6-8]。本实验结果表明,用CCK-8法观察VPA对U937细胞增殖状态的影响, 在一定浓度范围内VPA随着浓度的增加和作用时间的延长,抑制作用逐渐增强,呈剂量和时间依赖性,说明VPA可以抑制U937及其转染细胞的增殖。VPA在1.0 mmol/L分别作用48 h后可以诱导白血病细胞U937及其转染了AML1-ETO的细胞发生分化。
在急性髓性白血病中,由于染色体易位t(8;21)和基因重排产生了新的融合基因AML1-ETO,其蛋白产物通过募集HDAC,使在造血细胞增殖、分化和凋亡过程中起重要作用的基因表达受到抑制,导致白血病的发生[9]。研究发现,VPA能特异性诱导AML1-ETO阳性细胞系(Kasumi-1和Kasumi-6)分化,继而诱导凋亡并上调AML1目的基因的表达,但在AML1-ETO阴性细胞系MV4-11和K562未观察到上述变化[10]。Insinga等[11]研究证明,VPA能提高AML1-ETO、PML-RARα阳性AML患者及小鼠骨髓原始细胞组蛋白乙酰化水平,通过肿瘤坏死因子相关凋亡诱导配体及Fas死亡受体途径诱导凋亡。C/EBPα蛋白是造血系统中调控髓系分化的重要转录因子,在造血分化早期阶段对造血干祖细胞分化命运的选择起决定作用。本研究前期实验发现,AML1-ETO转染各细胞株中,CEBPA mRNA普遍处于低表达状态,使分化阻滞,导致白血病的发生[3]。在此基础上,本研究深入探讨VPA作为组蛋白去乙酰化酶抑制剂对AML1-ETO阳性细胞中CEBPA基因表达及表观遗传修饰的影响,结果发现使用VPA可明显上调CEBPA mRNA的表达水平,VPA处理组U937及AML1-ETO转染细胞株CEBPA启动子区的组蛋白H3和H4的乙酰化水平升高。由此证明,VPA能够在一定程度上使M2b型白血病细胞因染色质组蛋白低乙酰化而转录失活的CEBPA基因恢复其转录活性,CEBPA mRNA得以重新表达,从而能够发挥抗凋亡、促分化和肿瘤抑制的作用。
综上所述,HDAC抑制剂VPA对U937及其AML1-ETO转染细胞均有生长抑制和促分化的作用,并且通过提高CEBPA基因的组蛋白乙酰化水平使原本受抑的CEBPA基因在M2b型白血病细胞中重新表达或表达增加,通过人为的干预拮抗,甚至逆转异常的表观遗传学改变,诱导因表观遗传学改变而失活的基因重新表达。这一机理提供了表观遗传学调控治疗肿瘤的理论基础,为白血病的基因靶向治疗开辟了新的途径。
