大鼠宫颈上皮细胞的原代培养*
2018-09-27马丽刘正君姚东风胡宗苗邓颖颖张恩户
马丽,刘正君,姚东风,胡宗苗,邓颖颖,张恩户
(1.陕西中医药大学 药理教研室,陕西 咸阳 712046;2.西安市阎良区人民医院 药剂科,陕西 西安 710089;3.陕西省旬阳县中医院 药剂科,陕西 安康 725700)
宫颈疾病严重影响着现代女性的身心健康,宫颈上皮细胞的分化阶段与宫颈糜烂、人乳头状瘤病毒(human papilloma virus, HPV)感染和癌变密切相关[1]。形态学研究表明宫颈转化区是宫颈疾病的好发部位[2]。转化区位于宫颈管柱状上皮和复层鳞状上皮之间。该区域的特征是鳞状上皮化生,而生长旺盛的鳞状上皮层最易受外界因素影响[3]。研究宫颈上皮的分裂分化对于研究宫颈疾病的发病机制非常重要。这就需要对宫颈上皮细胞进行分离培养,由于人的宫颈上皮不易取得,手术过程中分离得到的宫颈上皮一般分化程度较高,本文选择从大鼠身上取材,进行原代培养,现报道如下。
1 材料与方法
1.1 试剂与主要仪器
上皮细胞培养无血清培养基(Gibco 1517550),牛脑提取物(Bovine Pituitary Extract,gibco 13028-014),表皮生长因子(EGF Human Recombinant, Gibco 13028-014),D-PBS(Gibco,1607816),胰蛋白酶(0.25%, Amresco),双抗(BioTop);100级超净工作台(苏州净化设备有限公司),二氧化碳培养箱(Binder公司),XDS-1倒置生物显微镜(重庆光电仪器有限公司),低速离心机(江苏省金坛市正基仪器有限公司),全自动高压灭菌器(江阴滨江医疗设备厂),SG超纯水仪,HH-1电热恒温水浴锅(北京科伟永兴仪器有限公司),分析电子天平(赛多利斯科学仪器有限公司),101电热鼓风干燥箱(上海一恒科学仪器有限公司)。
1.2 实验动物
SD大鼠,雌性,体重(45±5)g,第四军医大学实验动物中心提供,合格证号:陕动字10- 13。
1.3 方法
大鼠宫颈上皮细胞(RCEC)的分离参照文献[4],略微改进。本实验在经陕西中医药大学伦理委员会批准后进行的,40~50 g的雌性大鼠脱臼处死,75%的乙醇溶液浸泡15 min,纵向剖开,剪取宫颈至子宫角处组织,D-PBS(含链霉素 100 μg/ ml,青霉素 100 u/ml)冲洗 5 次,剪碎组织,0.2%胶原酶溶液37℃消化(3次,每次5 min),细胞筛过滤,3 000 rpm离心5 min,37℃培养。大鼠宫颈鳞状上皮培养使用上皮细胞培养无血清培养基,添加牛脑提取物250 mg/L,表皮生长因子(epidermal growth factor, EGF)20 ng/ml,7.5%无菌NaHCO3溶液调pH至7.4。细胞接种第3天换液,之后隔一天换一次液。
2 结果
上述方法分离的大鼠宫颈上皮细胞培养8 d后,可以在显微镜下观察到宫颈上皮细胞从组织碎片中移出,大片贴在培养瓶壁上,成集落状生长,扎堆现象严重。宫颈上皮细胞呈梭形,细胞核位于中央,有的细胞正在分裂,可以看到两个甚至多个核,见图1。由于上皮细胞无血清培养基不添加血清,因此细胞生长较缓慢。使用上皮细胞无血清培养基添加EGF、牛脑提取物可以实现大鼠宫颈上皮细胞的原代培养。
上皮细胞无血清培养基添加牛脑提取物和EGF可以实现大鼠宫颈上皮细胞的初步培养。最佳条件为:40~50 g大鼠,分离宫颈上皮细胞,胶原酶消化5 min,细胞筛过滤,离心,添加牛脑提取物250 mg/L,EGF 20 ng/ml,7.5%无菌碳酸氢钠溶液调整培养基pH为7.4,37℃培养,二氧化碳(CO2)浓度为5%。
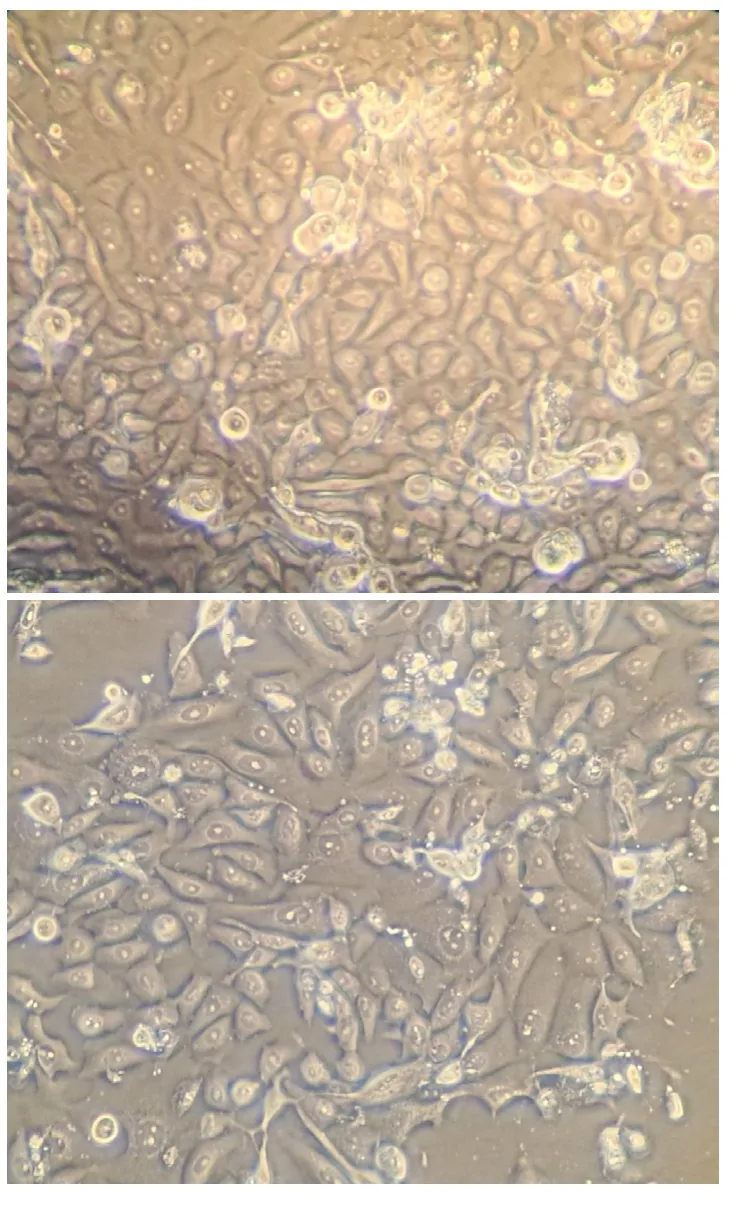
图1 大鼠宫颈上皮细胞(10×40)
3 讨论
大鼠宫颈上皮细胞培养一般需要借助成纤维细胞层的滋养,本课题首次选择上皮细胞无血清培养基培养大鼠宫颈上皮细胞,排除了成纤维细胞的干扰;相比人宫颈上皮的培养,克服了取材不易的弱点。
生长因子是一类具有刺激细胞生长活性的多肽类细胞因子;生长因子与特异的、高亲和的细胞膜受体结合,调节细胞生长。表皮生长因子(EGF)是一种由53个氨基酸组成的对热稳定的多肽,广泛存在于人体多种组织及体液中,与其受体结合可促进细胞的增殖与分化[5]。EGF与上皮组织的发生、发展、黏膜保护、溃疡愈合及溃疡的愈合质量密切相关,在上皮组织的修复中起着重要作用[6]。EGF与表皮生长因子受体(epidermal growth factor receptor, EGFR)结合,可促进细胞内DNA、RNA及蛋白质合成,促进细胞分裂。EGF作用的发挥主要依赖于细胞外调节蛋白激酶1/2(extracellular regulated protein kinases, ERK 1/2)通路的激活[7],此通路激活后,丝裂原活化蛋白激酶便从胞液进入胞核并诱导c-fos,cmyc和Cyclin D1等转录因子的表达[8]。EGF/EGFR在特定细胞中通过特定的信号传导通路,促进糖酵解及蛋白质、RNA和DNA的合成,从而促使细胞分裂和增生[9-10]。
THOMAS在对大鼠宫颈细胞进行培养时,证实了EGF对大鼠宫颈上皮细胞促生长作用,并且分离宫颈上皮细胞的大鼠体重在40~50 g[11]。有研究表明生长因子在上皮细胞培养中可以代替培养基中的血清高分子物质起到促进细胞生长的作 用[12]。
利用上皮细胞无血清培养基培养大鼠宫颈上皮细胞是本实验的一个创新。后续应该对大鼠宫颈上皮细胞的传代方法进行研究,并对大鼠宫颈上皮细胞进行纯化、鉴定。成纤维细胞滋养层的存在限制了宫颈上皮的体外研究,上皮细胞无血清培养基对大鼠宫颈上皮的成功培养可以为体外研究影响宫颈上皮生长和分化的因素提供一个细胞模型。该模型可用于研究激素、致癌物质和病毒等干扰因素对宫颈上皮的影响。这将为宫颈疾病的研究带来转机。
