A组轮状病毒极速实时荧光RT-PCR检测方法的建立及临床评价
2018-09-26陈峰唐晓宇仇保丰李林中严辉
陈峰 唐晓宇 仇保丰 李林中 严辉
腹泻病是5岁以下儿童死亡的第二大原因,轮状病毒(rotavirus,RV)是最常见的引起儿童腹泻的主要原因。RV感染引起水性腹泻伴呕吐和发烧、严重脱水、电解质紊乱,严重者甚至死亡。根据世界卫生组织(World Health Organization,WHO)提供的统计数据,中国在2008年193个国家参与的RV引起的死亡统计数据中排名第二十三,而在2013年194个国家中排名上升到第十五[1]。
RV是一种双链核糖核酸病毒,属于呼肠孤病毒科轮状病毒属,病毒基因由11个双链RNA节段组成,编码6个结构蛋白(VP1-4,VP6-7)和6个非结构蛋白(non-structural rotavirus protein 1-6,NSP1-6),根据VP6抗原性的不同可以分为A-H 8组,其中A组轮状病毒(rotavirus A,RVA)是导致婴幼儿腹泻的主要病原体[2-4]。目前,RV的检测方法主要有电子显微镜(electron microscope,EM)、胶体金法、酶联免疫法(enzyme linked immunosorbent assays,ELISA)、核酸杂交法、逆转录酶-聚合酶链锁反应(reverse transcription-polymerase chain reaction,RTPCR)以及逆转录定量PCR(reverse real-time quantitative polymerase chain reaction,RT-qPCR)。EM购买和维护价格都比较高,一般的诊断实验室负担不起;而胶体金法和ELISA直接抗原检测灵敏度低。近年来,RT-PCR、RT-qPCR结合高效液相色谱法、巢式PCR等核酸检测方法都被用于轮状病毒检测,并被认为具有比直接抗原检测更高的灵敏度,但存在耗时较长的缺点[5-9],不能满足RVA发病急、需要随到随检的快速检测要求。有文献报道新的商品化分子诊断方法FilmArra和Luminex xTAG实现了RVA核酸快速检测[10-12],但其高昂的价格限制了其在临床上的广泛应用。因此建立一种快速、准确、低成本的RVA检测方法能够为临床上实现轮状病毒的快速诊断及预后评价提供有力的技术支撑,对该病防控具有重要意义。
本研究旨在建立一种快速检测RVA的方法,并对其进行系统的性能分析和临床性能评价,以明确该方法在临床应用上的可行性。
1 材料和方法
1.1 病毒株和临床样本
1.1.1 病毒株
RVA毒株购自美国菌种保藏中心(American Type Culture Collection,ATCC),编号VR-2104和VR-2018;特异性病原体包括F组肠道腺病毒40型、F组肠道腺病毒41型、肠道病毒71型、空肠弯曲杆菌、艰难梭菌,购自ATCC,编号分别为VR-931、VR-930、VR-1775、VR-37、33560、9689,肠炎沙门氏菌、福氏志贺氏菌购自中国医学细菌保藏管理中心(National Center for Medical Culture Collection,CMCC),编号50041和51571,诺如病毒为临床样本,来源于南通出入境检验检疫局。
1.1.2 临床样本
收集南通市出入境检验检疫局、南通市妇幼保健院中临床症状符合《儿童腹泻病诊断治疗原则的专家共识(2009年版)》[13]描述的婴幼儿腹泻的临床样本共200例,其中男性病例119例,女性病例81例,年龄32天~6.1岁,平均年龄6.02岁。为考查临床特异性,还收集其它消化道细菌或病毒感染引起的婴幼儿腹泻、非感染性婴幼儿腹泻及健康婴幼儿。标本类型为粪便。
1.2 主要试剂和仪器
一步RT-PCR Master Mix(极速)(货号:G0105)、极速荧光定量PCR仪V280均购自南京美宁康诚生物科技有限公司;病毒基因组DNA/RNA提取试剂盒(离心柱法)(货号:DP315)购自天根生化科技(北京)有限公司。
1.3 引物和探针设计
从Genbank中查找并选择RVA基因组中NSP3基因的序列,利用Primer Premier 5设计一对引物和一条荧光探针,序列分别为上游引物RVAF:5′-GTTGATGCTCAAGATGGAGT-3′,下游引物RVA-R:5′-ACTTCATTGTAATCATATTGAATA CC-3′,荧光探针RVA-P:5′-(FAM)-CAGCAACAACTGCAGCTTCAAAAGAAGTGT-(BHQ1)-3′,扩增片段长度129 bp,经BLAST进行同源性比对发现仅与RVA株的基因组序列完全匹配,而和其它物种的核酸序列均不匹配。引物和荧光探针由生工生物工程(上海)股份有限公司合成。
1.4 质控品的建立
利用空斑减数实验进行RVA培养上清标定,将标定后病毒培养上清稀释到1.0×106PFU/mL,存活后作为阳性质控品。灭菌的生理盐水作为阴性质控品。每次实验待检样本需与阴阳质控品同时检测,用于实验质控。其中阴性质控品要求无典型S型扩增曲线或无循环阈值(cycle threshold value,Ct值)显示;阳性质控品要求呈典型S型扩增曲线且Ct值≤30。
1.5 核酸提取
用粪便采集拭子,取粪便或腹泻物5~8 g,置入无菌粪便收集管(含1 mL生理盐水),粪便悬液静置2 min,或6 000 r/min离心30 s,取200 μL上清进行核酸提取。阳性质控品、阴性质控品200 μL与待检样本同步进行处理。具体提取步骤请参照病毒基因组DNA/RNA提取试剂盒(离心柱法)说明书。提取的核酸可直接用于检测,也可保存于-70℃待用。
1.6 极速实时荧光RT-PCR检测
将提取后的核酸样本3 μL加入到7 μL RVA RT-PCR反应液中(含上下游引物RVA-F、RVA-R各10 pmol,荧光探针RVA-P 5 pmol,一步RTPCR Master Mix 5 μL),取8 μL移至PCR扩增芯片中,盖上芯片盖,使用极速荧光定量PCR仪V280进行扩增,扩增条件:50℃逆转录5 min;95℃预变性8 s;93℃7 s、60℃14 s,共40个循环。由于利用ROC曲线确定了本检测方法的Cutoff值为38,因此V280 RT-PCR实时分析软件计算每个样本的Ct值,结合扩增曲线的形状即可判断样本的阴阳性,如果样本呈典型S型扩增曲线,且Ct值≤38,则判定为阳性,样本无典型S型扩增曲线或者呈典型S型扩增曲线,但Ct值>38,则判定为阴性。
1.7 统计分析
采用EXCEL软件进行精密度分析,SPSS 18.0软件进行Kappa一致性分析,Origin8软件进行灵敏度分析。
2 结果
2.1 极速实时荧光RT-PCR扩增产物分析
将不同来源的RVA阴、阳性样本各8份进行实时荧光RT-PCR检测,图1A中8份阳性样本均呈现出典型的S型曲线,且Ct值均小于38;图1B中8份阴性样本均无典型S型曲线,见图1。
RT-PCR产物电泳结果显示,8份阳性样本全部可见129 bp的RVA特征条带(见图2),8份阴性样本全部未见129 bp的RVA特征条带,见图3。
RAV阳性标本的RT-PCR产物经克隆测序,测序结果如图4所示,结果显示均为RVA基因组编码非结构蛋白3(NSP3)基因的序列。
2.2 极速实时荧光RT-PCR方法灵敏度分析
将经过空斑减数实验标定浓度为5.32×108PFU/mL的RVA病毒上清分别稀释至1.0×105PFU/mL、1.0×104PFU/mL、1.0×103PFU/mL、5.0×102PFU/mL、1.0×102PFU/mL、50 PFU/mL、10 PFU/mL、5 PFU/mL,使用极速实时荧光RT-PCR方法进行24次重复检测,结果如表1所示。
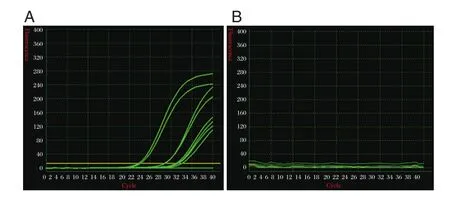
图1 阴、阳性样本的极速实时荧光PCR检测结果Figure 1 The results of ultrafast real-time RT-PCR,including positive and negative samples
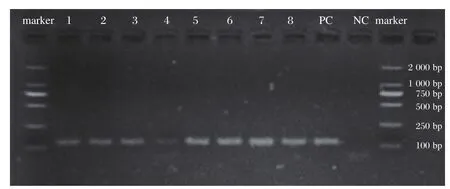
图2 8份阳性标本PCR产物的电泳结果Figure 2 The electrophoresis results of RT-PCR amplified products
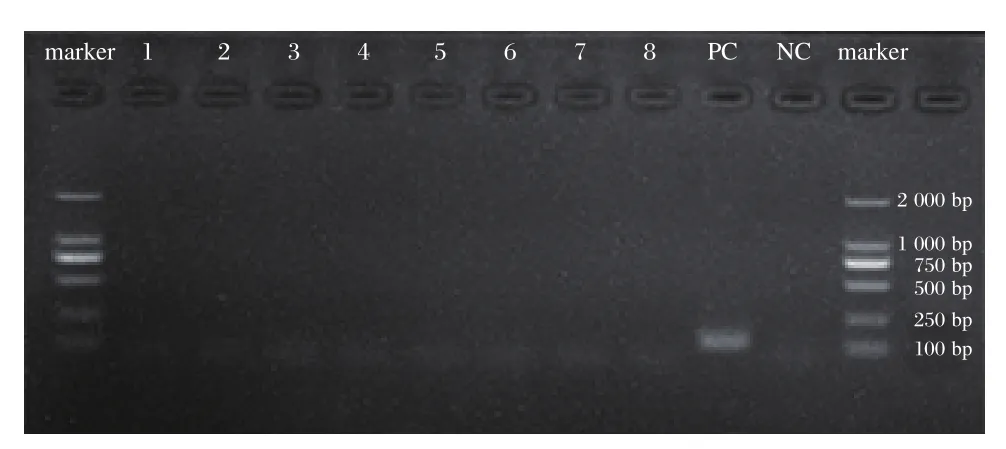
图3 8份阴性标本PCR产物的电泳结果Figure 3 The electrophoresis results of RT-PCR amplified products
按照美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standards,NCCLS)EP17-A文件的要求,以样本浓度值的对数为横坐标,检出率为纵坐标进行描点,用Origin软件的Sigmoidal Fit方法拟合曲线,根据软件给出的曲线公式y=1-0.833 3/(1+exp((x-1.699 02)/0.215 05)),计算出当检出率为95%时所对应的浓度为2.00×102PFU/mL,此浓度即为本方法的灵敏度,见图5。
图4 RVA阳性标本的RT-PCR产物克隆测序图Figure 4 The RVA positive sample sequencing result of RT-PCR amplified products
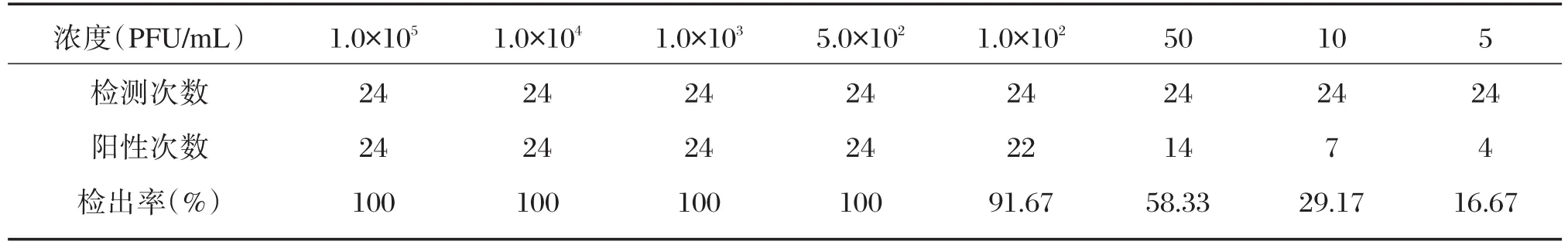
表1 极速实时荧光RT-PCR方法灵敏度检测结果Table 1 Sensitivity test result of ultrafast real-time RT-PCR
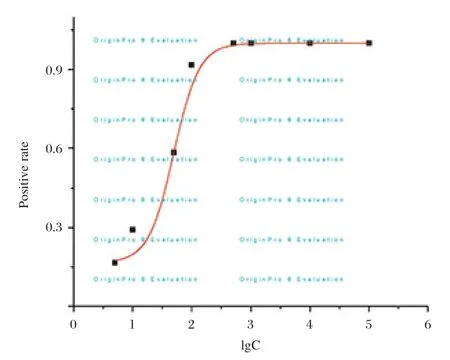
图5 实时荧光RT-PCR方法灵敏度的Sigmoidal拟合曲线Figure 5 Sigmoidal fitting curve of the detection sensitivity of real-time RT-PCR
上述样本同时采用RT-PCR方法进行扩增,产物经2%琼脂糖凝胶电泳,结果显示1.0×105PFU/mL和1.0×104PFU/mL的样本可见129 bp的目的条带,而其余浓度样本均无目的条带(图6),因此RT-PCR方法能够检出的最低样本浓度为1.0×104PFU/mL。
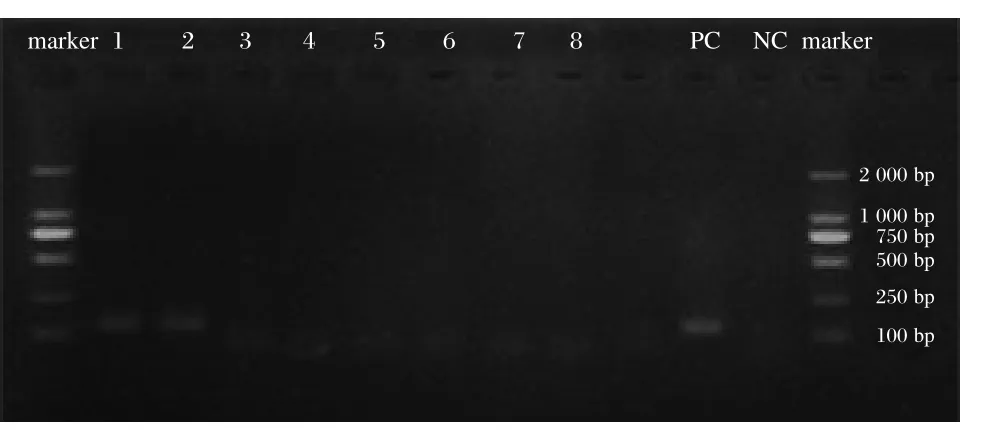
图6 不同浓度样本PCR产物的电泳结果Figure 6 The electrophoresis results of RT-PCR amplified products for different concentration samples
2.3 极速实时荧光RT-PCR方法特异性分析
为了验证极速荧光RT-PCR方法的特异性,分别使用种属相近的、感染部位相同及引起症状相似的其他病原,包括F组肠道腺病毒40型、F组肠道腺病毒41型、肠道病毒71型、空肠弯曲杆菌、艰难梭菌、肠炎沙门氏菌、福氏志贺氏菌、诺如病毒作为待检样本进行检测,结果均为阴性,见图7所示。
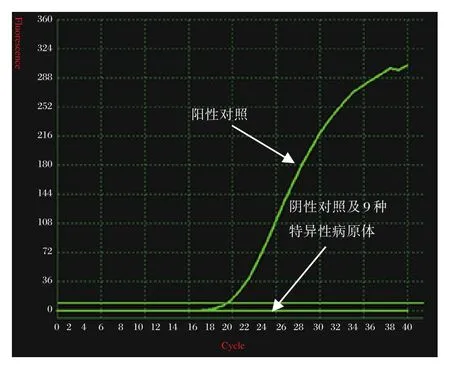
图7 特异性病原体极速实时荧光PCR检测结果Figure 7 The results of ultrafast real-time RT-PCR for Specific pathogens
同时使用RT-PCR方法对上述病原体样本进行扩增,产物经2%琼脂糖凝胶电泳,结果均无目的条带。因此其他病原体对极速荧光RT-PCR方法和RT-PCR方法的检测均无干扰,不存在交叉反应。
2.4 极速实时荧光RT-PCR方法精密度分析
以1.0×107PFU/mL、1.0×106PFU/mL、1.0×105PFU/mL、1.0×104PFU/mL、1.0×103PFU/mL 5个不同浓度的RVA病毒上清作为待检样本,使用极速实时荧光RT-PCR方法进行30次重复检测,结果如表2,Ct值的标准差在0.19~0.43之间,变异系数(CV)在0.82%~2.28%之间,证实本方法可以满足检测的精密度要求。
图8 特异性病原体PCR产物的电泳结果Figure 8 The electrophoresis results of RT-PCR amplified products for Specific pathogens
2.5 极速实时荧光RT-PCR方法与测序方法临床样本检测结果对比
对南通市出入境检验检疫局、南通市妇幼保健院共200例临床样本同时采用本研究建立的极速实时荧光RT-PCR方法和测序方法进行检测,结果如表3所示。其中阳性符合率达100%,阴性符合率达97.4%,总符合率达到98.5%。

表2 极速实时荧光RT-PCR方法精密度检测结果Table 2 Precision test results of ultrafast real-time RT-PCR
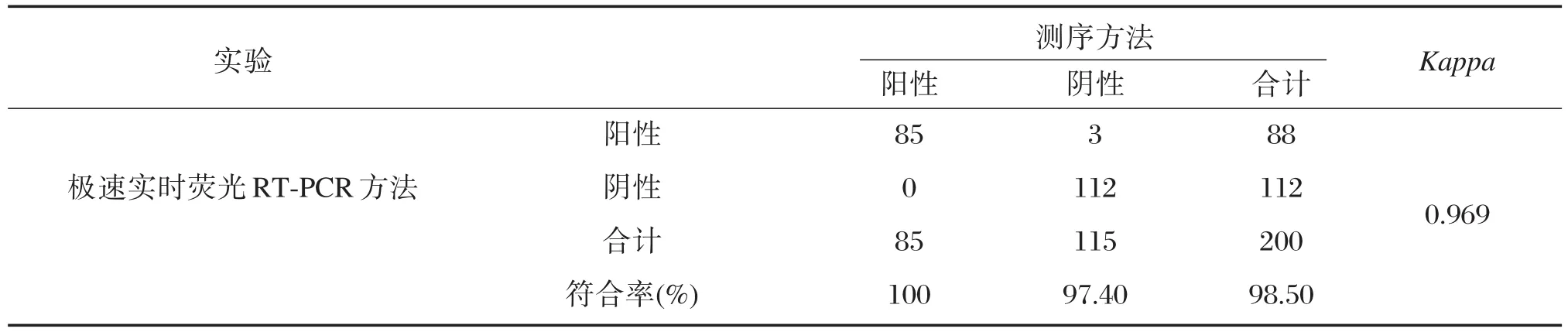
表3 极速实时荧光RT-PCR方法与测序方法检测结果对比Table 3 The results compared between ultrafast real-time RT-PCR and nucleotide sequencing
3 讨论
RVA是导致婴幼儿腹泻的最重要的病原体,是导致5岁以下婴幼儿腹泻的主要原因[14]。在我国,RV感染的发病率高达30%~40%,这种现状不仅对我国婴幼儿的生活质量构成了严重的威胁,而且也对我们国家的医疗资源造成了巨大的损失,给儿童健康带来严重危害,大大增加了防控任务难度[15-17]。
RVA经粪-口途径传播,检测方法目前在临床上积累了一定的经验,其技术的主要开发方向是开发实用、经济,且适用基层实验室的快速检测方法[18]。本研究开发了一种极速实时荧光RT-PCR检测RVA的方法,该方法最低检测限达到2.00×102PFU/ml,Ct值的变异系数小于2.5%,200例腹泻样本的研究发现,本方法与金标准测序方法的检测结果对比,阳性符合率达100%,阴性符合率达97.4%,总符合率达到98.5%,能够对腹泻样本中病原体进行监测,对疫情控制具有重要作用。
目前,基于各种检测原理的RVA的检测方法逐渐被应用于临床。免疫学检测技术,如ELISA,虽然是WHO推荐的检测方法,但该方法要求被测样本病毒含量足够高才能达到其检出限,相较于RT-PCR检测方法其漏诊率高[19-21]。本研究建立的极速实时荧光RT-PCR方法最低检测限达到2.00×102PFU/mL,灵敏度比普通RT-PCR方法高10倍[22],极大地降低了临床漏诊率。此外,免疫学检测技术基于方法学局限性容易出现轮状病毒组间交叉反应[23],造成特异性偏低。本研究中对F组肠道腺病毒40型、F组肠道腺病毒41型、肠道病毒71型、空肠弯曲杆菌、艰难梭菌、肠炎沙门氏菌、福氏志贺氏菌、诺如病毒等样本均进行了极速实时荧光RT-PCR方法的检测,结果均为阴性,表明该方法对种属相近或引起相似症状的其他种属病毒无交叉反应,结果与其他基于RT-PCR原理的检测方法一致[24]。RT-PCR过程中还存在一个重要参数即Ct值,Ct值可以帮助临床医生确定疾病病因,病毒载量的高低可以为临床医生评判疾病过程提供更有力的证据[19,25]。本研究建立的RVA检测方法不同浓度的样本Ct值范围在(17.28±0.39)~(29.69±0.43)之间,相较于文献中报道的基于RT-PCR原理的RVA检测方法Ct值范围26.18~36.01更低,表明本方法的检测灵敏度更高[26]。不同浓度样本的Ct值的变异系数在0.82%~2.28%之间小于2.5%,也表明本研究所建立的RVA检测方法具有良好的重复性,适用于临床检测。此外,200例临床腹泻样本的研究结果显示,本研究新建立的极速实时荧光RT-PCR检测方法与一代测序检测方法有着良好的等效性,阳性符合率达100%,阴性符合率达97.4%,总符合率达到98.5%,Kappa值为0.969,表明本研究的检测方法与现有的金标准测序方法检测性能一致性良好,说明本研究所建立的极速实时荧光RT-PCR检测方法具有临床可应用性。
鉴于RVA对婴幼儿的危害严重,且其流行病学研究显示RV在人群中流行的基因型会随时间、地区的不同而产生变化[27-28],因此及时明确婴幼儿腹泻的根本原因有助于临床医师及时诊断和正确治疗轮状病毒性肠炎,并能动态了解该病的流行情况,对指导和预防该病具有重要意义[29-30]。本研究中仅对200例临床样本进行对比检测分析,尚需更大的临床样本数据来进行性能优化,研究结果显示本研究建立的方法较目前临床上使用的其他检测方法成本低,且具有不易污染、操作简便、灵敏度高、检测时间短的特点,更适合我国国情,有利于在我国推广。