赤霉素拉穗处理对西拉葡萄果实酚类物质的影响
2018-09-26刘迪迪刘美迎张振文
刘迪迪,刘美迎,王 珍,谢 沙,梁 攀,张振文,2,*
酚类物质是苯环上连有一个或多个羟基的小分子有机物,广泛分布于植物体的各个器官中。葡萄果实中酚类物质主要集中在葡萄果皮和葡萄籽中,分为花色苷和非花色苷两类,其中花色苷类物质包括花青素、花翠素、甲基花青素、甲基花翠素、二甲花翠素及其衍生物等,而非花色苷类物质是指除花色苷以外的酚类,主要包括酚酸类(苯甲酸类、肉桂酸类)、黄酮类(黄烷酮类、黄酮醇类)、黄烷-3-醇类以及一些特殊的酚类物质如白藜芦醇等[1-4]。葡萄中酚类物质通过浸渍作用进入到葡萄酒中,是葡萄酒的重要组成成分,其含量和比例对葡萄酒的感官品质,尤其是对葡萄酒的颜色、收敛性[5-7]、澄清度和稳定性等有着重要的作用[8-9]。此外,酚类物质是葡萄酒发挥保健功效的重要成分,葡萄酒中的多酚物质能够消除人体内自由基,降低心脑血管疾病的发生率,具有抗氧化、抗衰老的功效[10-13]。
影响葡萄果实酚类物质合成的因素可以分为内部因素和外部因素,内部因素包括品种、成熟度、树龄、内源激素等[14-15],外部因素则包括光照、温度、土壤、栽培技术、外源激素等[16-17];其中外源激素中的赤霉素作为植物生长发育的重要激素之一,能调控植物的生长发育过程,能够打破种子休眠,促进茎的伸展、叶片生长、芽的萌发、果实发育,防止落花落果,进行果粒膨大等[18-19]。研究发现,通过一定浓度的赤霉素蘸穗处理可以拉长果穗长度、疏松果穗[20]。山西临汾地区西拉葡萄果穗过于紧密,果穗内部果粒颜色较浅或青绿,酚类物质含量低,而赤霉素拉穗处理能有效改善葡萄果穗过于紧密的缺陷。由于国内外关于赤霉素处理对葡萄果实酚类物质影响的报道并不多见,本实验在不同时期,以不同质量浓度的赤霉素蘸穗处理葡萄果实,研究赤霉素拉穗处理对酿酒葡萄酚类物质组分和含量的影响,以期总结提升葡萄果实酚类物质含量的适宜赤霉素处理方法,从而为提高酿酒葡萄果实品质提供理论依据,也对赤霉素处理在酿酒葡萄上的应用可行性进行验证。
1 材料与方法
1.1 材料与试剂
本实验在山西省临汾市尧京酒庄进行,选用欧亚种酿酒葡萄西拉(Vitis vinifera L. cv. Syrah)。2012年定植,东西行向,斜拉“厂”字型单篱架,株行距1 m×3 m,嫁接砧木为5BB,半机械化管理。
花色苷、非花色苷单体酚类物质(简称单体酚)标准品(均为色谱纯) 美国Sigma公司;乙腈、甲醇(均为色谱纯) 上海陆忠化学试剂厂。
1.2 仪器与设备
1200系列液相色谱-质谱联用仪、1100 KC/MSD离子阱高效液相色谱-质谱联用仪、Zorbax SB C18色谱柱美国Agilent公司;FD5-2.5冷冻干燥机 美国GOLD-SIM公司;CentriVap 78100-40离心浓缩系统 美国LABCONCO公司;5804R低温冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 赤霉素处理
实验于2015、2016年分别进行,两年处理方式一致,分别设置6 个处理组,1 个对照(CK)组。处理组即于当年葡萄开花期(2015年葡萄开花期为5月15日,2016年葡萄开花期为5月18日)前20 d和前15 d分别进行赤霉素蘸穗处理,赤霉素质量浓度分别为3、5、7 mg/L,处理编号分别为15CK、15LS203、15LS205、15LS207、15LS153、15LS155、15LS157和16CK、16LS203、16LS205、16LS207、16LS153、16LS155、16LS157。以编号15LS203为例:15表示为2015年,LS表示拉穗处理,20为开花前20 d,3为赤霉素质量浓度为3 mg/L,即编号为15LS203的处理组表示2015年葡萄开花前20 d用3 mg/L的赤霉素处理葡萄果穗;CK组未用赤霉素处理葡萄果穗。
处理时将葡萄花序迅速全部浸入赤霉素溶液中,计时2 s快速拿出,每个处理组150 穗(设3 个重复,每个重复50 穗),共计900 穗,葡萄成熟后每个处理组随机采样30 穗,迅速用冰盒带回实验室,-80 ℃冰箱保存。
1.3.2 不同指标测定
1.3.2.1 果穗长度
果穗长度采用刻度尺测量,葡萄平放于白纸上,拉直后记录果穗最上端和最下端距离作为葡萄果穗长度,每个处理组包含3 个平行,每个平行测10 穗果穗长度。
1.3.2.2 葡萄果实还原糖、总酸质量浓度的测定
葡萄果实挤破揉碎后,取上清液测还原糖和总酸的质量浓度。还原糖质量浓度的测定采用菲林A、B滴定法。总酸质量浓度的测定采用酸碱滴定法,以酒石酸计[21]。葡萄成熟度为还原糖和总酸质量浓度的比值。
1.3.2.3 葡萄果皮花色苷单体酚类物质的测定
葡萄果皮干粉制备:随机选取200 粒葡萄,冷冻状态下迅速将果皮与果肉分离,葡萄果皮液氮冷冻打粉,置于冷冻干燥机冻干24 h后备用。葡萄果皮干粉称样0.5 g,放于离心管中,加入10 mL甲酸-甲醇(甲酸体积分数2%)溶液,超声提取10 min(温度30 ℃、功率40 Hz),25 ℃下摇床(150 r/min)避光提取30 min,然后以8 000 r/min低温离心10 min,收集上清液于50 mL离心管,重复以上提取操作3 次,于旋转蒸发仪中蒸干(30 ℃),再用流动相(A相为V(水)∶V(甲酸)∶V(乙腈)=92∶2∶6,B相为V(水)∶V(甲酸)∶V(乙腈)=44∶2∶54)按A、B相体积比9∶1定容至10 mL,-80 ℃下保存待测。
采用配有二极管阵列检测器的液相色谱离子阱质谱联用仪进行花色苷含量的检测,配备电喷雾离子源和离子阱质谱检测器,所有部件均由Agilent v.5.2化学工作站控制。色谱条件如下:色谱柱采用Zorbax Eclipse SB C18(250 mm×4.6 mm,5 μm)柱。洗脱程序:0~18 min,10%~25% B;18~20 min,25% B;20~30 min,25%~40% B;30~35 min,40%~70% B;35~40 min,70%~100% B;流速1.0 mL/min,柱温50 ℃,检测波长525 nm,波长扫描范围200~900 nm,进样量30 μL。质谱采用电喷雾离子源,正离子模式,离子扫描范围m/z 100~1 500,雾化器压力0.24 MPa,干燥气流速10 L/min,干燥气温度350 ℃。对照标准品保留时间进行定性,外标法定量。
1.3.2.4 葡萄皮单体酚含量测定
称取1.3.2.3节制得的葡萄干粉2 g,加入5 mL蒸馏水和45 mL乙酸乙酯于锥形瓶中,25 ℃下摇床(150 r/min)避光提取30 min,转移上清液于250 mL圆底烧瓶,重复4 次,离心、蒸干(温度33 ℃),用甲醇定容至2 mL,-80 ℃下保存待测。
采用高效液相色谱-质谱联用仪分析标准品和葡萄皮提取物中的单体酚。色谱条件:色谱柱为Zorbax SB C18(50 mm×3 mm,5 μm)柱;柱温25 ℃;进样量10 μL,检测波长280 nm。流动相A:1.0%(体积分数,下同)的醋酸-水溶液;流动相B:1.0%醋酸-甲醇溶液,流速1.0 mL/min。梯度洗脱:0~15 min,l0%~26% B;30~50 min,40%~65% B;50~60 min,65%~95% B;60~63 min,95%~10% B;63~66 min,10% B。电喷雾离子源,负离子模式;雾化器压力0.21 MPa;干燥气流速为10 mL/min;干燥气温度325 ℃;离子扫描范围为m/z 100~1 500;诱导碰撞电压1.0 V。通过对照标准品离子碎片、保留时间进行定性,采用外标法定量。
1.4 数据处理分析
利用Excel 2016软件对数据进行整理;数据处理采用SPSS 20.0软件,利用独立样本T检验在P<0.05水平下,采用Duncan新复极差法进行显著性分析;利用Origin 2016软件进行图表绘制。
2 结果与分析
2.1 赤霉素处理对葡萄果穗长度的影响
果穗拉长可疏松葡萄果穗,增加果穗内部果粒的光照,有利于葡萄着色和酚类物质的生成[22-23]。如图1所示,赤霉素蘸穗对葡萄果穗的伸长具有显著的促进作用。2015年葡萄果穗长度平均增加8.57%,其中15LS207与对照组相比果穗长度增加16.09%,拉长效果为当年最好;2016年葡萄果穗长度平均增加达6.63%,其中16LS157果穗拉长效果最好,与对照组相比果穗长度增加14.20%。
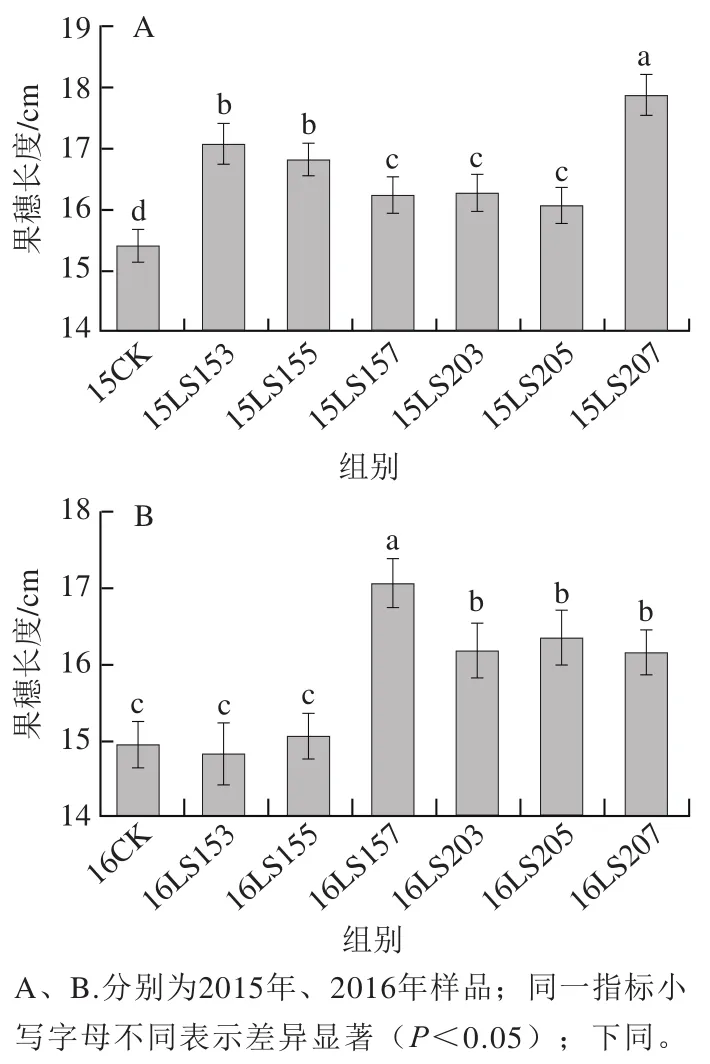
图1 不同赤霉素处理葡萄果穗长度的变化Fig. 1 Change in grape cluster length in different gibberellin treatments
2.2 赤霉素处理对葡萄还原糖、总酸质量浓度的影响

图2 不同赤霉素处理对葡萄还原糖、总酸质量浓度的影响Fig. 2 Effects of different gibberellin treatments on reducing sugar and total acid contents in grapes
如图2所示,赤霉素拉穗处理可提升葡萄果实还原糖质量浓度、降低总酸质量浓度,葡萄成熟度都有提升。2015年和2016年赤霉素处理组的平均还原糖质量浓度分别为225.90 g/L和236.95 g/L,与对照组相比分别提升了5.63%、11.27%,其中还原糖质量浓度最高的处理组分别为2015年的15LS155(231.84 g/L)、2016年的16LS157(244.14 g/L),分别较当年对照组提高了8.39%和14.62%。赤霉素处理能降低葡萄果实的总酸质量浓度,两年赤霉素处理组平均总酸质量浓度分别为5.96 g/L和5.46 g/L,与对照组相比总酸质量浓度分别降低了8.45%、14.55%,两年总酸质量浓度最低的处理组分别为2015年的15LS155(5.69 g/L)、2016年的16LS157(5.21 g/L),分别较当年对照组降低了12.60%和18.46%。
2.3 赤霉素处理对葡萄皮单体花色苷含量的影响
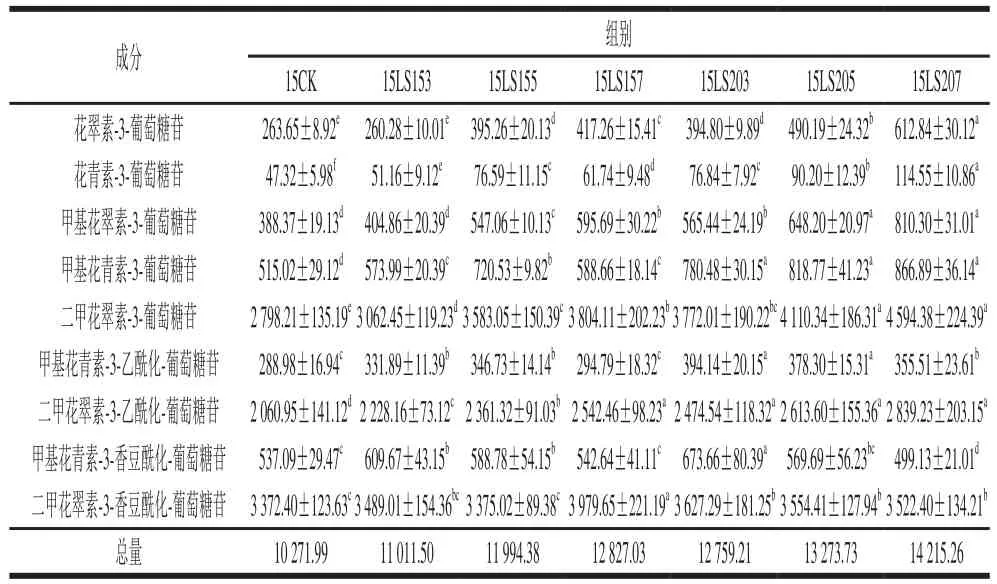
表1 2015年不同赤霉素处理对葡萄皮单体花色苷含量的影响Table 1 Effects of different gibberellin treatments on anthocyanin contents in grapes grown in 2015 μg/g
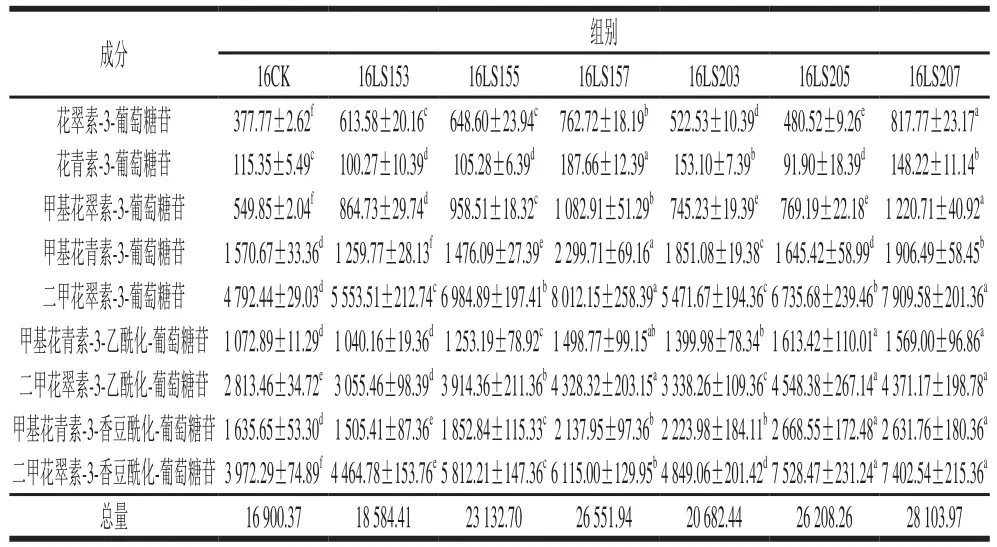
表2 2016年不同赤霉素处理对葡萄皮单体花色苷含量的影响Table 2 Effects of different gibberellin treatments on anthocyanin contents in grapes grown in 2016 μg/g
如表1、2所示,共检测到9 种单体花色苷,包括5 种基本花色苷(非酰化花色苷)和4 种酰化花色苷,其中二甲花翠素-3-葡萄糖苷及其乙酰化合物、二甲花翠素-3-香豆酰化-葡萄糖苷占比较大。两年数据显示赤霉素处理对葡萄皮单体花色苷总量有较大的提升作用。2015年和2016年赤霉素处理组葡萄皮单体花色苷平均总量分别提高了23.44%和41.28%,两年均为LS207处理组的效果最明显,分别提升38.39%和66.29%。此外,两年中均以LS207、LS205、LS157 3 个处理组对葡萄皮二甲花翠素类花色苷含量的提高效果显著。综合来看,赤霉素处理能够提高葡萄皮的花色苷含量,质量浓度在3~7 mg/L的范围内随着赤霉素使用量的增加花色苷的含量也随之增大,且开花前20 d处理组单体花色苷提升量较开花前15 d处理组提升量高。
图3为赤霉素处理对葡萄皮单体花色苷含量和比例的影响。2015年数据显示葡萄皮基本花色苷含量增加幅度较大,酰化花色苷含量有小幅度提升,赤霉素处理组酰化花色苷比例有较大幅度降低。2016年各处理组之间差异较显著:开花前15 d处理组酰化花色苷含量有所提升,但所占比例有所降低;开花前20 d处理组酰化花色苷含量提升幅度较大,酰化花色苷比例也稍有提升。
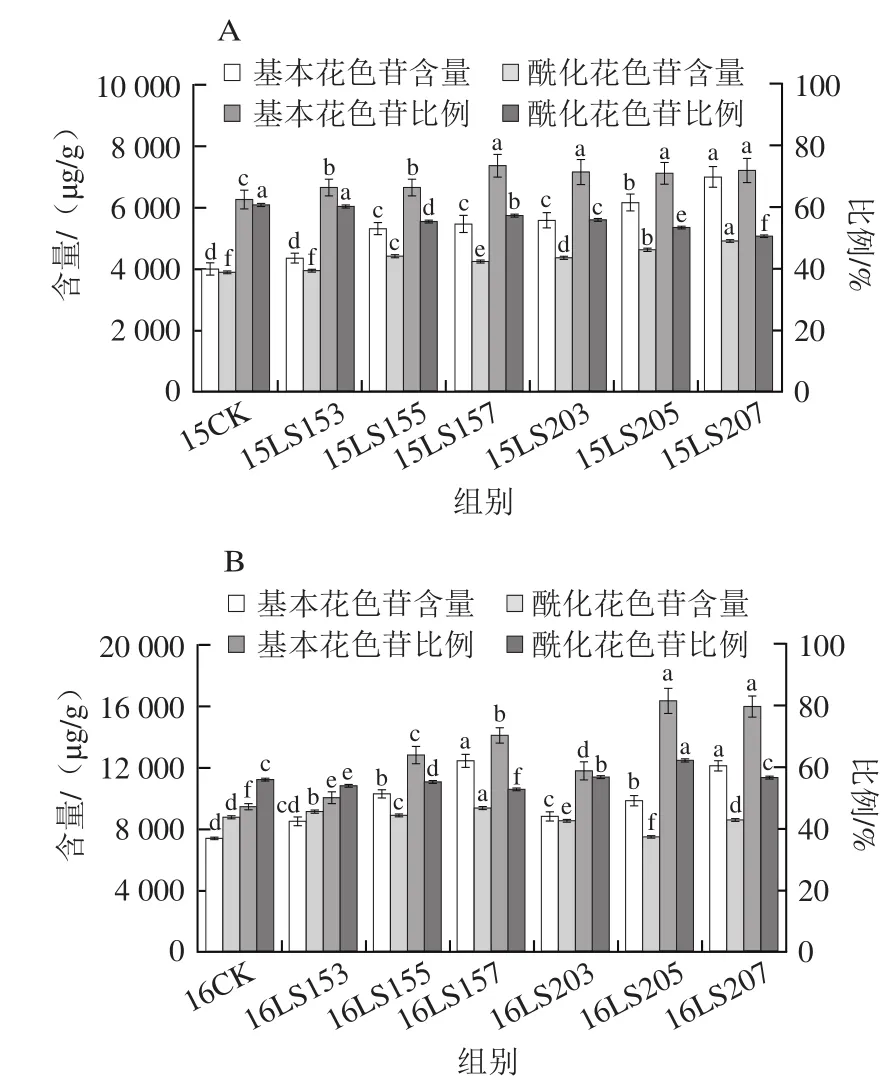
图3 不同赤霉素处理对葡萄皮单体花色苷含量及组分比例的影响Fig. 3 Effects of different gibberellin treatments on the contents and composition of anthocyanins in grapes
2.4 赤霉素处理对葡萄皮单体酚含量的影响
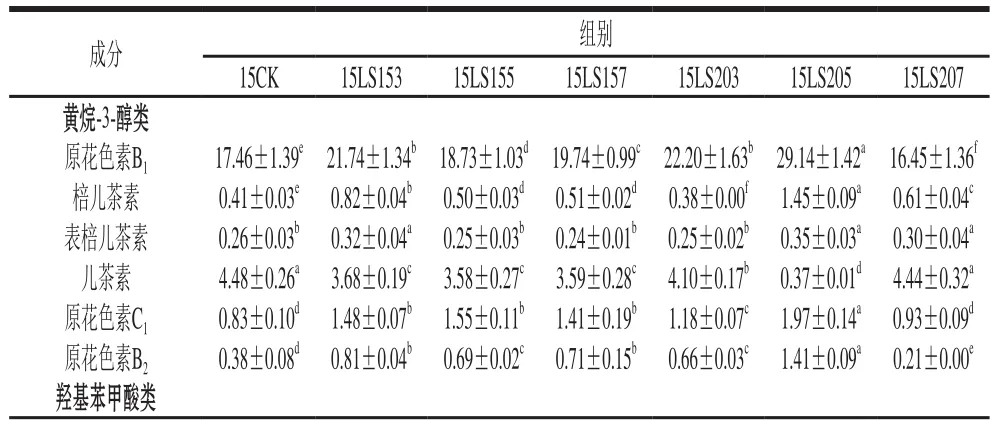
表3 2015年不同赤霉素处理对葡萄皮单体酚含量的影响Table 3 Effects of different gibberellin treatments on the contents of phenols in grapes grown in 2015 μg/g

续表3

表4 2016年不同赤霉素处理对葡萄皮单体酚含量的影响Table 4 Effects of different gibberellin treatments on the contents of phenols in grapes grown in 2016 μg/g
如表3、4所示,2015年共检测到25 种单体酚,其中黄烷-3-醇类6 种、羟基苯甲酸类3 种、黄酮醇类16 种。数据结果显示:单体酚总量随着赤霉素质量浓度的增加而增加,开花前20 d赤霉素处理效果好于开花前15 d处理组;所有单体酚中,杨梅酮-葡萄糖苷、槲皮素-葡萄糖苷、鼠李素-3-O-葡萄糖苷含量较多,均在100 μg/g以上,15LS207、15LS205两个处理组中以上物质含量均具有较大提升,15LS157中槲皮素-葡萄糖苷、鼠李素-3-O-葡萄糖苷含量也有较大提升。2016年检测到25 种单体酚,其中黄烷-3-醇类7 种、羟基苯甲酸类2 种、黄酮醇类16 种,较2015年多检测到了表儿茶素、二氢槲皮素,未检测到香草酸、丁香亭-3-O-葡萄糖苷。2016年葡萄皮单体酚总量较2015年有较大程度提升,且不同赤霉素处理组单体酚总量均高于对照组;其中槲皮素-葡萄糖苷、鼠李素-3-O-葡萄糖苷含量较多,与2015年一致;16LS153、16LS155、16LS203中以上物质含量均具有较大提升,其余处理组以上单体酚含量提升较小。单体酚总量随着赤霉素质量浓度的增加而降低,这与2015年结果不一致,造成实验差距的原因可能是葡萄成熟度存在差异。
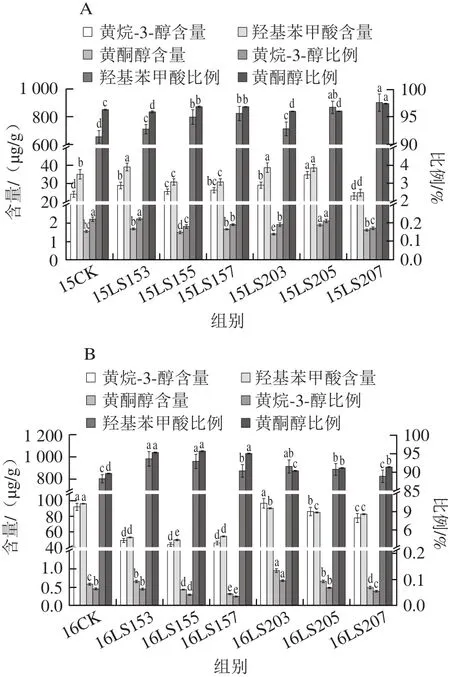
图4 不同赤霉素处理对葡萄单体酚含量及组分比例的影响Fig. 4 Effects of different gibberellin treatments on the contents and composition of phenols in grapes
如图4所示,黄烷-3-醇类物质含量占单体酚总量的2%~10%左右,羟基苯甲酸类所占比例不超过0.3%,黄酮醇类所占比例在90%以上。2015年15LS207、15LS205、15LS157和15LS155中葡萄皮黄酮醇类含量提升较大,其组分所占比例也较高;15LS153、15LS203、15LS205黄烷-3-醇含量提升较大,其组分所占比例也显著提高;羟基苯甲酸类物质含量较低,处理组间效果差异不显著。2016年开花前15 d 3 个赤霉素处理组黄烷-3-醇类含量较2015年有较大提升,但较对照组明显降低;开花前20 d赤霉素处理组黄烷-3-醇类含量随着赤霉素质量浓度的增加而降低,但与对照组相比差异不大;黄酮醇类含量较2015年提升明显,其中16LS153、16LS155处理组黄酮醇类含量较高。
3 讨 论
还原糖、总酸质量浓度对葡萄成熟和葡萄酒酿造有较大影响。成熟度一般表示为还原糖与总酸质量浓度的比值,酿造优质葡萄酒要求成熟度控制在35~45之间[24],本实验中对照组葡萄成熟度均在35以下,赤霉素处理组中除2016年16LS157成熟度大于45外,其余处理组均在35~45之间,赤霉素处理提升了葡萄的成熟度。
花色苷是花色素的糖苷结合形式,是葡萄酒重要的保健成分之一[25-26],对葡萄酒口感和贮存都有较大影响[27]。赤霉素拉穗处理拉长了果穗长度、提升了葡萄成熟度,对花色苷含量有较大的提升作用,这与Oren-Shamir等[28]的研究结果一致,他认为葡萄花色苷含量的增加可能是因为果穗内部果粒花色苷大量增加引起。Alonso等[29]认为适当增强光照能提升葡萄花色素含量,本实验中赤霉素处理疏松了果穗,增加了内部果粒的见光量,使葡萄内部果粒花色苷含量有较大提升。甲基化花色苷含量越多,葡萄的红色色调越明显[30],二甲花翠素类花色苷含有两个甲基,同时在花色苷中占比较大,对葡萄和葡萄酒颜色影响也较大;酰化花色苷能延缓葡萄酒颜色的消退,增加颜色稳定性[31]。两年赤霉素处理组均提升了二甲花翠素类花色苷和酰化花色苷的含量,特别是2016年提升量较大,因此赤霉素处理可以提升葡萄与葡萄酒颜色的深度和稳定性,更利于葡萄酒的长期贮存。
单体酚类物质是葡萄酒中主要的营养成分,决定着葡萄酒的苦味和涩味,影响着葡萄酒的色泽和稳定性[32]。红色葡萄酒口感平衡,追求乙醇体积分数、涩度和酸度的平衡,本实验中两年数据都显示赤霉素处理同时提升了葡萄的还原糖质量浓度和单体酚总量,与Fan Shutian[33]的结果一致。不同之处在于2016年赤霉素处理组葡萄皮单体酚总量存在随赤霉素质量浓度的增加而降低的趋势。相关研究证明葡萄酚类物质含量在成熟过程中并非一直增加,而是不断波动的[34],葡萄成熟后酚类物质含量出现先增加后降低的趋势[15],因此2016年单体酚含量出现的降低现象可能是因为葡萄过度成熟而造成酚类物质减少。
赤霉素拉穗处理能有效拉长葡萄果穗,并且能够提高葡萄果实的还原糖质量浓度、降低总酸质量浓度,对葡萄皮的酚类物含量有显著提升作用,其中高质量浓度处理组(5、7 mg/L)效果总体优于低质量浓度处理组(3 mg/L),开花前20 d处理组优于开花前15 d处理组。所有处理组中以16LS207酚类物质含量提升量最高,该处理组能提高大部分单体花色苷和单体酚的含量,并显著促进葡萄酰基化花色苷和黄酮醇类物质的形成,有利于增加葡萄酒颜色的深度和稳定性,提高葡萄酒的结构层次感,利于葡萄酒的贮存。
