小成像视野薄层靶扫描胰腺动脉CT增强造影对自身免疫性胰腺炎与胰腺癌的鉴别诊断
2018-09-25陆建平
朱 寻,陆建平
0 引 言
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是由自身免疫介导的一种特殊类型的慢性胰腺炎,影像上最具特征性的表现为胰腺弥散性或局限性肿大、胰周假包膜形成和主胰管不规则狭窄。临床症状多数以梗阻性黄疽为首发症状,还可伴有上腹部隐痛、腹泻、消瘦等症状。胰腺癌患者大多也以腹部隐痛或黄疸来医院就诊。当AIP表现为局限性肿块时,在影像学表现、临床症状和胰腺癌很相似,AIP极易被误诊为胰腺癌,而进行不必要的手术切除治疗等。两者治疗及预后也完全不同,AIP激素治疗大多有效,而胰腺癌属于恶性肿瘤,需要手术切除,预后差[1]。因此,对两者进行准确的鉴别诊断至关重要。本研究收集21例AIP患者和21例胰腺癌患者的小成像视野(field of vision,FOV)薄层靶扫描胰腺动脉CT增强造影检查影像资料,旨在提高对2种疾病的鉴别。
1 资料与方法
1.1临床资料回顾性分析2016年8月到2018年2月海军军医大学附属长海医院收治入院的21例AIP患者(AIP组)和21例胰腺癌患者(胰腺癌组)资料,2组术前及治疗前均进行小FOV薄层靶扫描胰腺动脉CT增强造影检查。AIP组中,男16例,女5例,年龄41~82岁,平均(60±12)岁;实验室检查:总胆红素及直接胆红素升高15例,IgG4水平升高者19例,CA19-9升高者3例;均经过穿刺活检证实或激素治疗明显改善证实。胰腺癌组中,男11例,女10例,年龄37~78岁,平均(61±11)岁;实验室检查:CA19-9升高者18例,IgG4水平升高者2例;均经过手术病理证实。
1.2影像检查方法所有患者均采用320排动态容积CT(Aquilion ONE;东芝医疗,东京,日本)进行扫描。扫描参数:螺旋扫描模式,螺距为0.87,管电压120 kV,毫安秒:150 mAs,球管旋转时间为0.5 s,探测器准直宽度100×0.5 mm。数据重建包括厚层与薄层:厚层层厚3 mm,层间距3 mm,薄层层厚1 mm,层间距0.8 mm。视野350 mm×350 mm,滤波函数(FC07)。
胰腺实质期采用靶扫描技术:管电压120 kV,毫安秒:250 mAs,球管旋转时间0.5 s,探测器准直宽度320×0.5 mm,数据重建包括厚层与薄层:厚层层厚3 mm,层间距3 mm,薄层层厚0.5 mm,层间距0.25 mm,视野200 mm×200 mm,滤波函数(FC07)。
对比剂注射方案:自双筒高压注射器经肘静脉依次注射非离子型对比剂(碘比乐,药量:100 mL,速率5.0 ml/s)及0.9%等渗盐水20 mL;速率4.5~5.0 mL/s,对比剂注射后行四期扫描,分别为动脉期25~30 s,胰腺实质期40~45 s,门脉期60~65 s,延迟期110~120 s。
1.3图像分析图像由2名具有主治医师以上职称的放射科医师共同读片。分析病灶所在部位、大小、密度、形态及强化方式,胰周、胰胆管、淋巴结以及相邻血管、组织等改变。
1.4统计学分析采用SPSS 17.0统计学软件对数据进行分析,计算诊断AIP和胰腺癌的敏感性、特异性、准确率、阳性预测值和阴性预测值。计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1小FOV薄层靶扫描胰腺动脉CT增强造影表现AIP与胰腺癌在弥散性肿大、假包膜样结构、CT增强延迟强化、主胰管狭窄>3 cm及上游胰管扩张≥5 mm、胆总管截断、胆总管增厚、周围淋巴结肿大和血管受累影像学表现上差异有统计学意义(P<0.05),见表1。
2.1.1胰腺大小及部位、形态改变AlP组中,12例(57.1%)为胰腺弥散性肿大,呈“腊肠样”改变,见图1;9例为胰腺局限性肿大,其中6例为胰体尾部肿大,3例为胰头肿大;局限性胰腺炎大小(3.46±1.25)cm。胰腺癌组中,5例(23.8%)为弥散性肿大样改变,16例为局限性肿块;13例肿瘤位于胰头,2例位于胰体,1例位于胰尾,5例位于胰体尾;胰腺癌大小(4.28±1.36)cm。在发生部位、病灶大小上两者差异无统计学意义;但在胰腺弥散性肿大上,AIP组发生率较高(P<0.05)。
2.1.2胰腺病变部位密度改变及强化方式AIP组CT平扫有2例胰腺病变区呈低密度;15例(71.4%)胰腺实质期增强后病变区呈现较均匀的延迟强化。胰腺癌组中,13例CT平扫表现为等密度,8例表现为低密度;21例胰腺实质期增强后弱强化,未见明显延迟强化。2组在胰腺实质期增强上增强方式差异有统计学意义(P<0.05)。
2.1.3胰腺周围假包膜样结构AIP患者中,10例(47.6%)增强后显示有假包膜影,见图1。胰腺癌患者中未见明显假包膜影,两者差异有统计学意义(P<0.05)。
2.1.4主胰管的改变AIP组中,小FOV薄层靶扫描上有11例(52.4%)主胰管不规则狭窄>3 cm,见图1;21例AIP上游胰管扩张均<5 mm。胰腺癌组中,13例(62.0%)上游胰管扩张≥5 mm,且主胰管不规则狭窄<3 cm,较AIP组差异有统计学意义(P<0.05)。
2.1.5胆管的改变AIP组中,11例表现为胆总管下段呈“鸟嘴样”狭窄,上游胆管明显扩张;CT显示有11例出现肝内外胆管不同程度的扩张,胆总管可见增厚狭窄(52.4%),见图1。胰腺癌组中,16例(76.2%)表现为胆总管骤然截断,未见明显增厚。两者在胆总管截断、狭窄表现上差异有统计学意义(P<0.05)。
2.1.6邻近血管与淋巴结AIP组中,3例(14.3%)有血管受累(与病灶接触>180°);胰腺癌组中,14例(66.7%)有血管受累,见图2;组间差异有统计学意义(P<0.05)。AIP组中,2例(0.1%)淋巴结肿大(≥1 cm);胰腺癌组中,13例(62.0%)有淋巴结肿大及转移,差异有统计学意义(P<0.05)。
表1自身免疫性胰腺炎和胰腺癌小FOV薄层靶扫描胰腺动脉CT增强造影表现比较[n(%)]
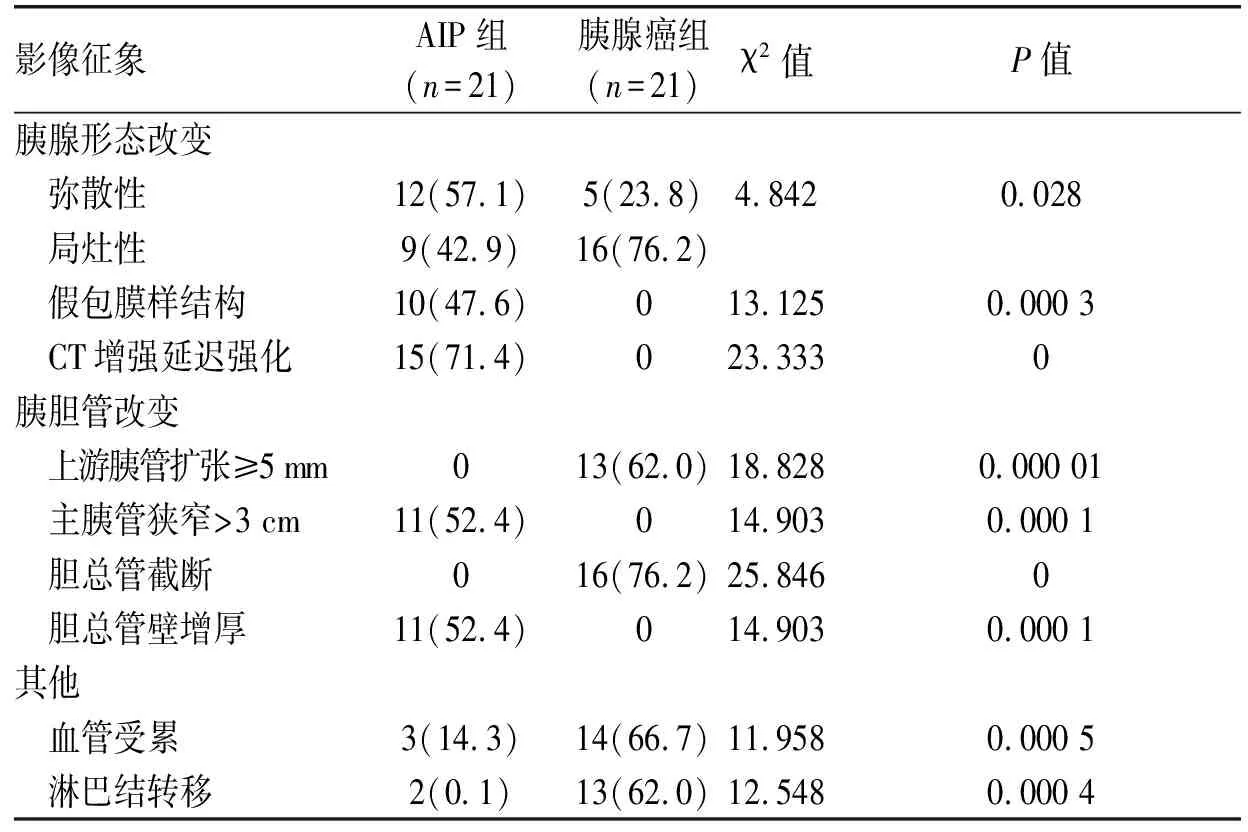
影像征象AIP组(n=21)胰腺癌组(n=21)χ2值P值胰腺形态改变 弥散性12(57.1)5(23.8)4.8420.028 局灶性9(42.9)16(76.2) 假包膜样结构10(47.6)013.1250.000 3 CT增强延迟强化15(71.4)023.3330胰胆管改变 上游胰管扩张≥5 mm013(62.0)18.8280.000 01 主胰管狭窄>3 cm11(52.4)014.9030.000 1 胆总管截断016(76.2)25.8460 胆总管壁增厚11(52.4)014.9030.000 1其他 血管受累3(14.3)14(66.7)11.9580.000 5 淋巴结转移2(0.1)13(62.0)12.5480.000 4
2.2小FOV薄层靶扫描胰腺动脉CT增强造影检查诊断价值21例AIP术前诊断正确17例,误诊为胰腺癌4例。21例胰腺癌术前诊断正确19例,误诊2例。小FOV薄层靶扫描胰腺动脉CT增强造影检查鉴别诊断AIP和胰腺癌的敏感性90.5%(19/21),特异性81.0%(17/21),准确率85.7%(36/42),阳性预测值82.6%(19/23),阴性预测值89.5%(17/19)。

a:箭头示胰周假包膜影;b:主胰管狭窄>3 cm;c:胆总管下端“鸟嘴样”狭窄,管壁增厚强化;d:胆囊壁增厚强化图1 自身免疫性胰腺炎患者小FOV薄层靶扫描胰腺动脉CT增强造影影像
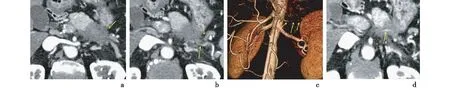
a:胰体尾部见低密度肿瘤影;b:脾动静脉可见受侵(接触>180 °,箭头所示);c:VR血管图像上可见明确显示脾动脉受侵(箭头示);d:箭头示肿瘤细小的供血动脉图2 胰体尾部胰腺癌患者小FOV薄层靶扫描胰腺动脉CT增强造影影像
3 讨 论
自身免疫性胰腺炎是一种比较少见的慢性胰腺炎[2],在慢性胰腺炎中发病率约占2%~11%,平均发病年龄约为(63.0±11.4)岁[3-4]。AIP组织学表现分为2型,1型与IgG4相关,为淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP),2型与粒细胞上皮损害相关,为特发性导管中心性胰腺炎(idiopathic duct-centric chronic pancreatitis,IDCP)[5-6]。亚洲人群中绝大多数为1型AIP,多见于中老年男性,常合并胰外损伤,如硬化性胆管炎、胆管狭窄、腹膜后纤维化、肝肾等脏器受累,激素治疗反应敏感[7-8]。病理上LPSP主要特征有:①胰管周围大量淋巴浆细胞浸润及较多的嗜酸性粒细胞,胰管上皮细胞不受损伤;②胰管和静脉周围席纹状纤维化;③闭塞性静脉炎;④IgG4阳性细胞>10个/高倍视野[9-10]。小FOV薄层靶扫描采用薄层层厚最薄为0.5 mm,视野200 mm×200 mm的技术,可以更好地观察病灶、病灶边界、胰胆管改变、血管及周围淋巴结等情况。
3.1形态改变AIP病变部位的胰腺组织由于大量淋巴细胞浸润而体积明显肿大,呈“腊肠样”改变[11]。多数表现为全胰腺的弥散性肿大,少数为局限性肿大。本研究中有12例胰腺表现为弥散性肿大,占所有病例57%以上。胰腺癌是起源于腺管上皮细胞的恶性肿瘤,大多形成局限性肿块,故AIP和胰腺癌在胰腺形态改变上有明显差异(P<0.05)。
3.2胰腺实质增强表现AIP病变组织由于被淋巴细胞浸润,增强扫描胰腺实质动脉血流灌注减少[12],在动脉期强化程度减弱,门脉期和延迟期出现明显的延迟强化,强化程度一般较均匀[13]。胰腺癌呈浸润性生长,胰内细小动脉容易受到破坏,血供缺乏[14]。增强扫描由于正常胰腺组织血供丰富,而肿瘤组织相对缺血,所以病变部位呈不均匀强化[15],本研究中未见明显延迟强化,延迟后强化程度仍较低,与AIP有明显差异(P<0.05)。
3.3邻近血管本研究中可以观察到胰腺癌患者中14例有血管受累,与手术病理结果一致,有的还可以看到供应肿瘤的细小动脉影。AIP可见周围炎症、纤维化累及血管,但相对于胰腺癌来说血管受累比例少,两者有明显差异(P<0.05)。
3.4假包膜结构AIP胰周可见“假包膜”,是胰腺周围组织炎性浸润纤维化所形成[16]。本研究观察到AIP中有10例增强显示有假包膜影,胰腺癌患者未见明显“假包膜”影,与AIP有明显差异(P<0.05)。
3.5胰管改变小FOV薄层靶扫描上可以较好的观察胰管,进行较准确的测量,对于1 mm的胰管也能清晰的显示。AIP可见胰管狭窄,表现为单节段或多节段狭窄型。单节段狭窄型,其上游胰管多无扩张,少数轻度扩张。多节段狭窄型,病变呈跳跃性多节段分布,非狭窄段胰管多无扩张,少数轻度扩张[17]。AIP患者胰管为多发狭窄,而胰腺癌的胰管均为单发狭窄。AIP患者多数主胰管不规则狭窄>3 cm,而胰腺癌患者多数主胰管不规则狭窄<3 cm[18]。本研究中有11例AIP患者出现主胰管不规则狭窄>3 cm,与胰腺癌有明显差异(P<0.05);有13例胰腺癌患者出现上游胰管扩张≥5 mm,与AIP有明显差异(P<0.05)。有研究显示,上游胰管管径截断值为5 mm时,鉴别局限性AIP与胰腺癌的敏感性为100%,特异性为73%[19]。CT后处理技术可以进行胰管曲面重建,对胰管扩张观察提供帮助。若胰管扩张不明显时,则对重建造成了一些困难[20]。
3.6胆总管改变AIP除胰腺病变以外,其他器官也可见受累,如泪腺、唾液腺、肺、肾等。胆道是胰腺外最常受累的器官,表现为胆管壁均匀增厚、管腔狭窄和管壁延迟强化,典型征象是胆总管下段“鸟嘴样”狭窄伴肝内外胆管扩张[21]。狭窄的原因是由于淋巴细胞浸润,纤维组织增生以及周围胰腺组织炎性增大压迫所致[22]。胰腺癌胆总管多为骤然截断,是肿瘤细胞浸润所致,与AIP有明显差异。本研究中有11例AIP显示胆总管壁增厚,是AIP累及胆道系统的表现,可作为与胰腺癌鉴别诊断的征象之一。
3.7淋巴结小FOV薄层靶扫描上可以清晰显示胰周淋巴结有无肿大,并进行准确的测量。胰腺癌多数有淋巴结的肿大及转移。本研究中21例胰腺癌中,13例有淋巴结肿大(≥1 cm)及转移。AIP中也可见淋巴结肿大,与淋巴滤泡增生有关,本研究中有2例淋巴结肿大,两者有明显差异(P<0.05)。
小FOV薄层靶扫描胰腺动脉CT增强造影检查可以更有利地观察病灶、病灶边界、胰胆管改变、周围血管及淋巴结情况,对小病灶的显示、胰管狭窄及扩张的测量、肿瘤小的供血动脉、血管受累及周围淋巴结的肿大、转移情况显示更加清晰,对于鉴别诊断AIP和胰腺癌的敏感性、特异性、准确率分别为90.5%、81.0%、85.7%,有利于AIP与胰腺癌相鉴别。
