南海浮游植物对沙尘和灰霾添加的响应
2018-09-22牟英春贺敬怡高会旺
牟英春,褚 强,张 潮,贺敬怡,高会旺,2*
南海浮游植物对沙尘和灰霾添加的响应
牟英春1,褚 强1,张 潮1,贺敬怡1,高会旺1,2*
(1.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2.青岛海洋科学与技术国家实验室,海洋生态与环境科学功能实验室,山东 青岛 266071)
通过2016年5月~6月在南海3个站位开展的船基围隔培养实验,研究了沙尘和灰霾添加对南海浮游植物生长和群落结构变化的影响.结果发现,沙尘和灰霾添加由于提供了N、P等营养盐,整体上促进了浮游植物的生长,且促进程度与添加量密切相关.通过定量计算营养盐指数和叶绿素a累积浓度,发现培养期间叶绿素a累积浓度与沙尘添加浓度呈显著正相关关系(2=0.87,<0.01);低浓度灰霾添加的作用与沙尘添加类似(2=0.91,<0.01),但当灰霾浓度增大时,叶绿素a累积浓度的增加受到一定程度的抑制,这可能与灰霾中含有较高含量的毒性物质有关.各粒级浮游植物叶绿素a浓度的变化表明,沙尘和低浓度灰霾添加使浮游植物优势种群由超微型向小型和微型转变;在高浓度灰霾添加组,由于营养盐与毒性物质的综合作用,浮游植物粒级结构变化不明显.超微型浮游植物细胞丰度测定结果表明,沙尘对聚球藻、原绿球藻和超微型真核浮游植物均表现出促进作用,高浓度灰霾添加能够抑制聚球藻和超微型真核浮游植物的生长.
沙尘;灰霾;南海;浮游植物;抑制作用;促进作用
大气沉降被认为是上层海洋营养元素的重要来源,其带来的氮(N)、磷(P)、铁(Fe)等营养物质,能够影响海洋浮游植物的生长,改变海洋对CO2的吸收以及其他气体的海气交换,并进一步影响全球气候变化[1-2].在高营养盐、低叶绿素海区(HNLC),50%的C固定来自于大气沉降中Fe的贡献[1],在占全球海洋面积60%的低营养盐、低叶绿素海区(LNLC),大气沉降能够通过多种形式缓解海区营养盐限制进而影响海洋初级生产力[3-4].目前,对大气沉降及其海洋影响的研究多集中于大西洋、地中海和南大洋区域,而对南海的研究相对较少[5-6].
沙尘沉降作为海洋营养物质的重要来源,每年带来的N营养元素约占表层海洋需N量的1/3,带来的Fe营养元素对表层海洋中的Fe有巨大贡献[7],而带来的其他营养物质以及痕量元素也可能对海洋表层浮游植物的生长和群落结构产生影响[8].已有研究发现,沙尘中的高浓度N能够导致浮游植物暴发性增长,沙尘中的P和Fe能够促进N的固定,促使浮游植物生物量发生变化,进而导致浮游植物的群落结构发生一定程度的改变,能够促进聚球藻细胞丰度的增加,而对原绿球藻没有显著影响[6,9-12].这些研究较多关注了沙尘对浮游植物生长影响的现象,但对于沙尘浓度与浮游植物生物量之间定量关系研究较为缺乏.
随着经济的发展,以灰霾污染为主要特征的大气污染已成为全球关注的大气环境问题[13].然而,目前世界范围内对灰霾沉降及其影响的研究较少,灰霾沉降物中含有较高浓度的N、P等营养物质和Cu、Pb、Zn等痕量金属元素[14],其中Cu、Zn等痕量金属是浮游植物生长的必需元素,但在亚北极太平洋的研究发现,若这些金属元素在海水中超过一定的浓度阈值时,就会对浮游植物的生长产生毒性作用[1,15-16].通过研究发现,高浓度的灰霾颗粒(2mg/L, [Cu]≈10-9mol/L)沉降到海洋中会抑制海洋浮游植物的生长,进而影响海洋生态系统的结构和功能[17].同时,有研究发现,当海水中Cu的浓度高于10-12mol/L时,就会抑制聚球藻的生长[18].但就目前而言,人们对灰霾沉降如何影响海洋生态系统的认识仍严重不足.
南海是世界上最大的边缘海之一,叶绿素a浓度和N、P等营养元素的浓度都较低[3],具有典型的寡营养盐特征[2,19].受季风的影响,亚洲沙尘及其携带的N、P、Fe等营养物质能够经过远距离传输到中国南海海区,对浮游植物的生长产生影响[20-21].另外,有研究表明,南海每年约20%的新生产力来源于大气N沉降,在未来几十年里,南海将成为世界上大气N沉降增加最快的边缘海[22-23].同时,南海毗邻的中国大陆及东南亚各国是当今世界经济发展最快的区域之一,高排放导致灰霾天气及其伴随的灰霾沉降可能会影响南海陆架与中央海盆,从而对海洋浮游植物的生长产生影响[24-26].
为了更好地理解沙尘和灰霾沉降对南海生态系统的影响,本文利用船基围隔培养实验系统,通过营养盐、沙尘和灰霾添加,研究了沙尘和灰霾对浮游植物生物量及群落结构变化的影响,沙尘和灰霾对聚球藻、原绿球藻和超微型真核浮游植物细胞丰度的影响.
1 材料与方法
1.1 船基围隔培养实验设计
于2016年5月~6月搭载东方红2号科考船在南海开展了3组船基围隔培养实验,采样站位是SEATs(18°04′N、116°05′E)、E4(19°08′N、112°16′E)和D5(22°00′N、118°25′E)(图1),分别代表了海盆、陆架和陆坡3个不同特征的水域.利用Sea-Bird 911plus CTD采水系统在每个站位采集表层(2~5m)海水,经过200μm筛绢过滤除去大粒径浮游动物后分装到各培养桶中,待培养桶中海水体积约1/2时,分别添加沙尘、灰霾(沙尘的最终浓度为0.33,1mg/L,灰霾的最终浓度为0.05,0.11mg/L)和各种营养盐(表1),然后定容至规定体积(20L和2L),并轻轻晃动培养桶使桶内海水和添加物混合均匀,最后置于装有循环海水的水槽中,遮光40%进行现场培养.每个站位的培养实验均设置20,2L 2种培养体积,分别用于研究沙尘、灰霾和N、P等营养物质添加对浮游植物的影响.对照组和每个处理组均设置3个平行样(实验结果以3个平行样的平均值和标准偏差的方式呈现),培养时间为5~6d(含采样当天,第0d).
沙尘的添加浓度为0.33,1mg/L.根据研究表明,南海每年沙尘沉降量为2.5~52g/m2,沉降深度为27~57m[27],通过计算每年沉降到海洋表层的沙尘大约为0.04~1.9mg/L[19,21].灰霾添加根据沙尘添加浓度中无机氮含量相对添加,添加浓度为0.05, 0.11mg/L.N、P、Fe等营养盐的添加浓度是依据Guo等[2]在南海实验的添加浓度而确定.
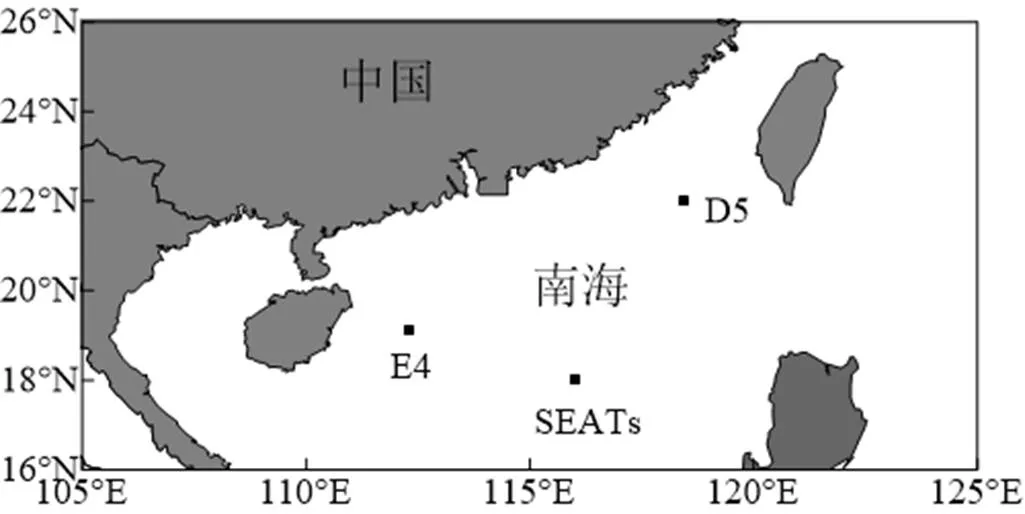
图1 船基围隔培养实验海水采集站位

表1 培养实验添加方案
注:[DIN]为NO3-、NO2-和NH4+的浓度之和.Control代表对照组, Dust-L代表低浓度沙尘添加组,Dust-H代表高浓度沙尘添加组,Haze-L代表低浓度灰霾添加组,Haze-H代表高浓度灰霾添加组.
1.2 沙尘和灰霾样品的采集和分析
实验中添加的沙尘样品(Dust)为在腾格里沙漠(38°47′N、105°30′E)采集的表层土壤,经过20μm筛网过滤、人工老化处理后[4],在-20℃冷冻保存的人工处理沙尘(简称为沙尘).灰霾样品(Haze)为重度霾污染期间(2015年12月)在中国海洋大学崂山校区采集的总悬浮颗粒物(TSP),采样器为KC-1000大流量采样器(青岛崂山电子公司),采样时间为15h.
沙尘和灰霾颗粒中的营养盐浓度采用Auto Analyzer 3营养盐自动分析仪进行测定,溶解态的Fe、Cu、Zn等微量金属元素采用Agilent 7500c ICP- MS进行测定[28-29](表2).比较表2中沙尘和灰霾的化学组成可知:灰霾颗粒中的N、P等营养组分浓度明显高于沙尘,溶解无机氮(DIN)浓度约为沙尘的8.8倍,SiO32-和PO43-浓度分别约为沙尘的4.6和7.6倍.灰霾中Cu、Pb等重金属元素的浓度也高于沙尘,Cu浓度约为沙尘的40倍,Pb浓度约为沙尘的108倍.
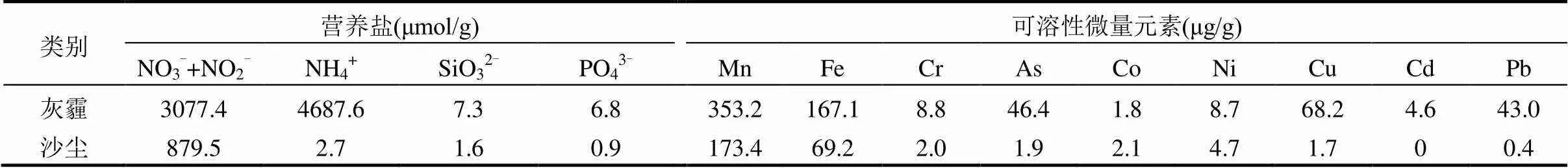
表2 沙尘和灰霾颗粒中营养盐和可溶性微量元素浓度
1.3 营养盐浓度测定
培养期间,在第0,2,4d和最后1d早晨8:00采集水样用于测定培养系统的营养盐浓度.利用0.45μm的醋酸纤维滤膜过滤200mL水样至高密度聚乙烯样品瓶中,在-20℃条件下保存.将样品带回陆地实验室,并利用Auto Analyzer 3营养盐自动分析仪进行NO3-、NO2-、NH4+、SiO32-和PO43-的测定.营养盐自动分析仪对NO3-、NO2-、NH4+、SiO32-和PO43-的检测限分别为0.02,0.003,0.04,0.03和0.005μmol/L.
1.4 叶绿素a浓度测定
培养期间,每天早晨8:00采集水样用于测定培养系统的叶绿素a浓度.从2L培养桶中取200mL水样并经Whatman GF/F滤膜过滤,滤膜用于测定总叶绿素a浓度;从20L培养桶中取300mL水样,依次经20,2和0.2μm孔径的Whatman滤膜过滤,滤膜用于测定分粒级(小型浮游植物20~200μm、微型浮游植物2~20μm和超微型浮游植物0.2~2μm)叶绿素a浓度.过滤后的滤膜在-20℃、避光条件下利用90%丙酮萃取18~24h,然后利用Trilogy(Turner Designs)荧光仪测定叶绿素a浓度.
1.5 超微型浮游植物细胞丰度测定
在培养期间的第0d和最后1d,从20L培养桶中取1.8mL水样,然后加入0.2mL10%的多聚甲醛,室温避光条件下放置15min,然后利用液氮速冻,速冻后的样品在-20℃避光条件下保存,之后带回陆地实验室利用Becton-Dickson FACSCalibur流式细胞仪测定超微型浮游植物的主要藻种——聚球藻、原绿球藻、超微型真核浮游植物picoeukaryotes的细胞丰度.
1.6 数据分析
文中使用单因素方差分析(ANOVA)的方法对数据进行显著性检验.
2 结果与分析
2.1 培养站位表层海水初始特征
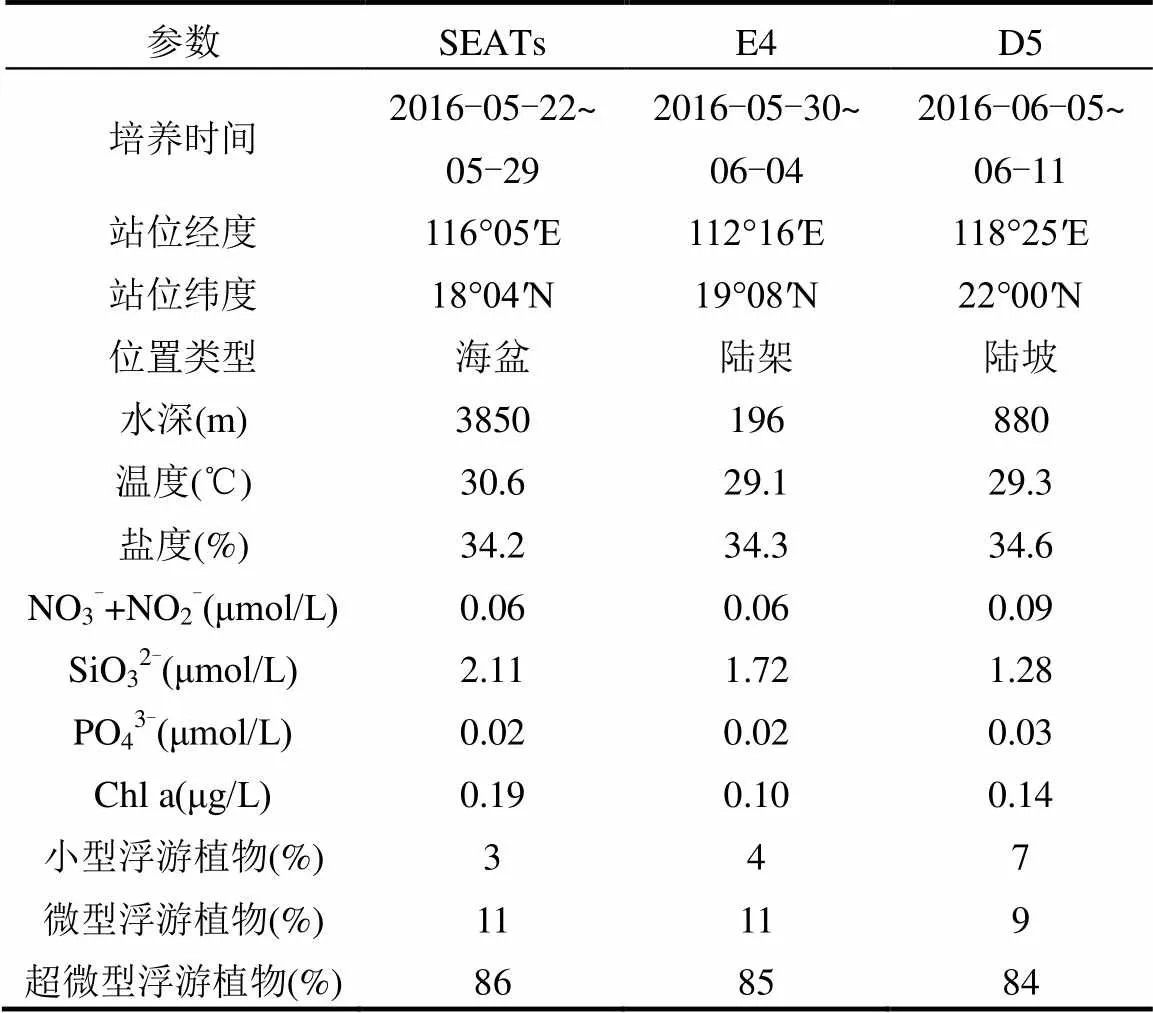
表3 培养站位信息
培养站位表层海水初始营养盐和叶绿素a浓度均较低(表3).在3个站位中,NO3-+NO2-浓度为0.06~ 0.09μmol/L;PO43-浓度低于0.03μmol/L,陆坡(D5)处浓度最高,陆架(E4)和海盆(SEATs)浓度相当;硅酸盐的浓度为1.28~2.11μmol/L,叶绿素a浓度低于0.19μg/L,海盆处(SEATs)最高.在3个站位中,各粒级浮游植物均为超微型浮游植物占主导,其对总叶绿素a质量浓度的贡献率约为84%~86%.
2.2 营养盐添加组总叶绿素a浓度与营养盐浓度的变化
培养期间,SEATs、E4和D5站浮游植物对N+P+Fe和N+P添加的响应最显著(ANOVA,<0.05),但N+P+Fe与N+P组之间没有显著差异(ANOVA,>0.05).其中,N+P组中叶绿素a浓度最大值依次是1.29,1.38和0.87μg/L,分别是其对照组的4.6、9.2和4.8倍(图2).单独添加N或者P,也能一定程度上促进浮游植物生长,加N组中叶绿素a浓度最大值是对照组的1.2~2倍,加P组是对照组的1.2~ 1.9倍.在SEATs站位(其他站位没有做Fe的添加实验),加Fe组中叶绿素a浓度与对照组相比并没有显著差异(ANOVA,>0.05).
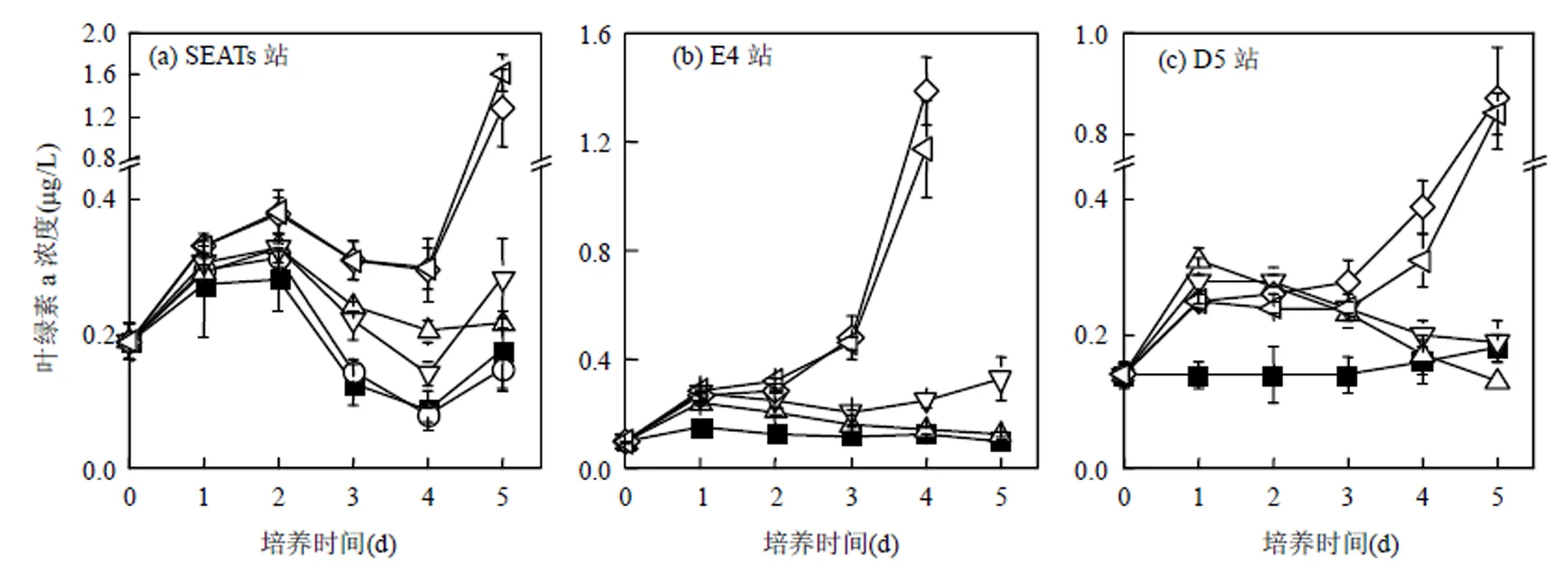
图2 各站位营养盐添加组总叶绿素a浓度的变化
2.3 沙尘和灰霾添加组总叶绿素a浓度与营养盐浓度的变化
沙尘和灰霾添加组中,各站总叶绿素a浓度在培养期间相较于对照组均显著增加(ANOVA,<0.05)(图3),并呈现双峰变化的特征.在培养第1d达到第1个峰值,第2~3d处于下降(SEATs)或平缓变化(E4、D5)过程,第4~6d再次增长达到第2个峰值(培养过程的最大值).沙尘添加组中,叶绿素a浓度随沙尘添加量的增加而增大:Dust-L组中叶绿素a浓度最大值为对照组的2.0~2.9倍;Dust-H组中叶绿素a浓度最大值为对照组的3.7~5.6倍.灰霾添加组中,叶绿素a浓度随灰霾添加量的增加呈先增大后降低的趋势:Haze-H组中叶绿素a浓度最大值为对照组的1.5~3.7倍,且在SEATs站Haze-L组中叶绿素a浓度最大值要高于Haze-H组,是对照组的2.2倍.
沙尘添加组中,NO3-+NO2-、SiO32-和PO43-浓度在培养过程中整体呈下降趋势(图4).在叶绿素a浓度达到最大值当天(SEATs和D5站的第6d和E4站的第4或5d),NO3-+NO2-浓度为初始浓度的0%~72%,SiO32-浓度为初始浓度的72%~86%. SEATs站PO43-浓度为初始浓度的77%~81%,E4和D5站PO43-浓度无明显变化.灰霾添加组中,Haze-H的NO3-+NO2-最终浓度在SEATs和E4站分别是初始浓度的1.7和2.5倍.D5站位NO3-+NO2-浓度下降为初始浓度的87%;各站位SiO32-和PO43-浓度变化不明显.
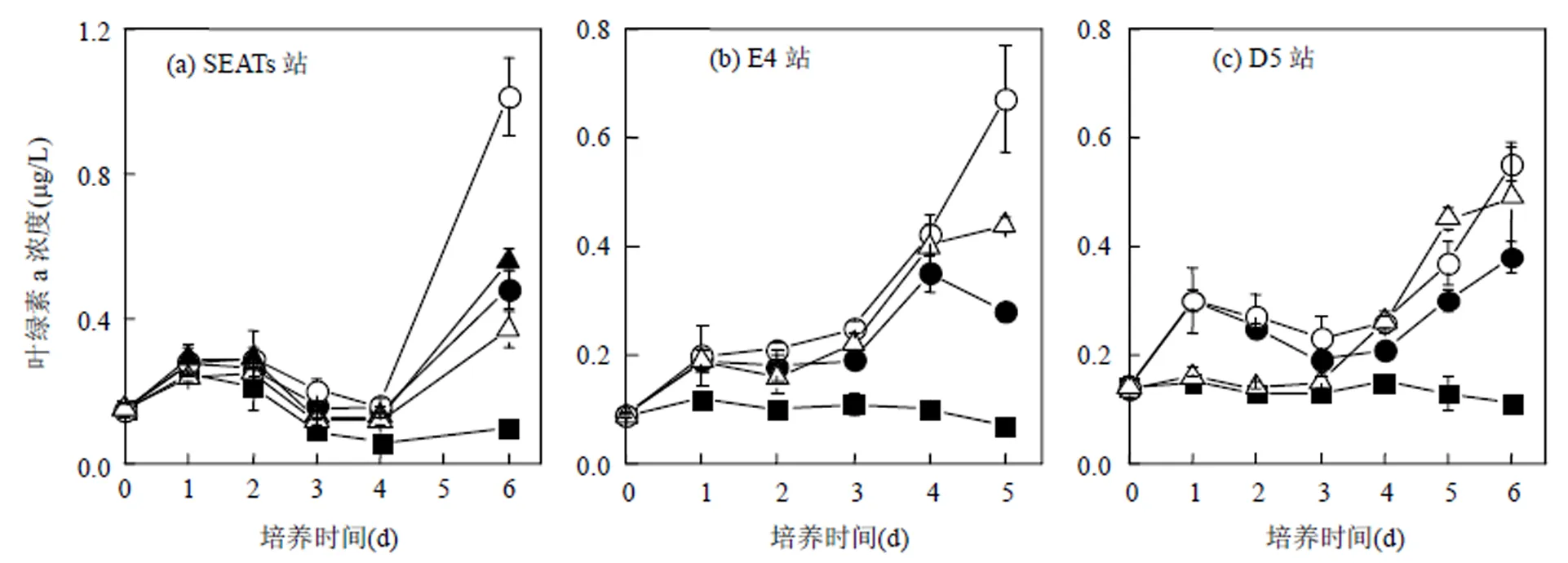
图3 各站位沙尘和灰霾添加组总叶绿素a浓度的变化
3 讨论
3.1 沙尘和灰霾添加对浮游植物生长的影响
3.1.1 浮游植物生长的营养盐限制 营养盐限制会影响海洋浮游植物的群落结构、初级生产力和海洋碳循环[30],在南大洋、赤道太平洋上升流区及亚北极太平洋等HNLC海区,Fe是浮游植物生长的主要限制性营养盐[31-32];北大西洋副热带区域和西北太平洋热带区域等LNLC海区,N是主要限制性营养盐[33];一些研究中也发现,在贫营养环境中,由于水体中营养盐含量极低,浮游植物的生长可能受到多种营养盐的共同影响[6].本培养实验中,3个站位海水的初始N、P营养盐浓度均处于较低水平(表3),是典型的贫营养盐水体.在各营养盐添加实验中,仅N与P同时添加时(N+P和N+P+Fe组)叶绿素a浓度有显著增加,明显高于加N组、加P组和加Fe组(图2),表明3个站位浮游植物的生长受到了N和P的共同限制.这种营养盐限制状况,在海盆、陆架和陆坡等不同海域并没有显示区域性差异.其他研究中,Wu等[34]认为N是南海主要的限制性营养盐,而Guo等[2]在研究中发现南海浮游植物的生长并非只受到N的限制.在其他贫营养盐海区的研究中,Moore等[30]发现,亚热带北大西洋N和P营养盐含量同样处于较低水平,N+P添加组叶绿素a的生长量要明显高于单独加N组和加P组,也表现出了N和P的共同限制作用.由于海洋生态系统中浮游植物种类较多,不同藻种对营养盐的需求不同,而表层海水的营养盐供给也容易受到多种外源因素的影响,因此营养盐限制问题还需要进一步研究.
3.1.2 沙尘和灰霾添加对浮游植物生长的促进作用 沙尘和灰霾添加在一定程度上优化了海水的初始营养盐状况,促进了浮游植物的生长.为反映不同浓度的沙尘和灰霾添加对浮游植物生长的影响,引入CEI(营养盐指数)表征沙尘和灰霾添加前后海水的营养盐水平[35],CC(叶绿素a累积浓度)表征培养期间叶绿素a的累积量:
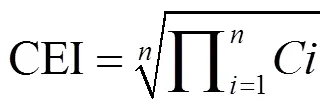
式中:代表培养体系中每种营养盐的初始浓度;代表营养盐的种类;代表叶绿素a浓度.
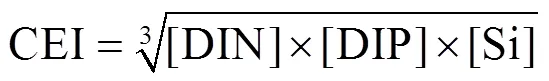
式中:[DIN]和[DIP]分别代表NO3-+ NO2-+ NH4+和PO43-的浓度;[Si]代表SiO32-的浓度.
通过对各站位沙尘添加组和对照组第0d的CEI与各对应组前5d的CC进行线性拟合(图5),发现CEI与CC呈明显的正相关关系(2=0.87,<0.01),即沙尘添加浓度越高,叶绿素a累积浓度越大.比较图5中灰霾添加组CEI与CC的关系,发现当灰霾浓度较低时,CEI与CC呈明显的正相关关系(2=0.91,<0.01),灰霾对浮游植物的促进作用与沙尘添加组相似,但当灰霾浓度增大时(图中黑色圆圈内的点),灰霾添加组的CC要明显低于沙尘添加组.通过对比灰霾添加组和沙尘添加组中的营养元素及可溶性重金属元素的浓度发现(表2),Haze-H组中的DIN含量与Dust-H组中含量相当,但是Haze-H组中含有的可溶性重金属Cu、Pb等的浓度明显较高.Haze- H组中,CC的偏离可能是由于重金属对浮游植物存在一定程度的毒性作用.有研究表明,如果气溶胶中重金属Cu浓度超过2mg Cu/(mg Chl),会对浮游植物的生长产生毒性作用,降低浮游植物的初级生产力[1].即当灰霾中重金属浓度未达到浮游植物生长毒性阈值时,海水中的营养盐浓度与浮游植物的生长量呈现明显的正相关关系,但当重金属浓度过高,灰霾则呈现对浮游植物生长的抑制作用.
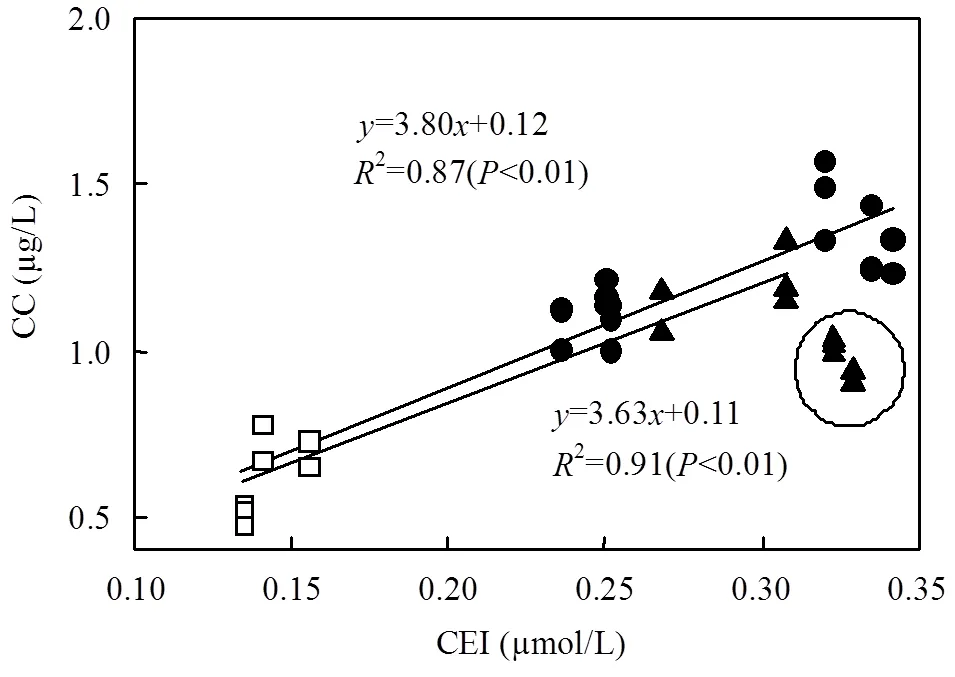
图5 叶绿素a累积浓度随营养盐指数的变化
□对照组,●沙尘添加组,▲灰霾添加组;长线由沙尘组拟合得到,短线由灰霾组拟合得到
与对照组相比,灰霾和沙尘的添加在3个站中的总体作用相似,都能够促进浮游植物的生长.同时,不同站位相同培养时间内的叶绿素a累积浓度差异也不明显(ANOVA,>0.05)(图6).低浓度与高浓度沙尘添加组中,叶绿素a累积浓度随站位的变化相似,E4站稍大,SEATs和D5站次之.灰霾添加组中,3个站位叶绿素a累积浓度无差异.对比3个站位的初始状态(表3),其理化特征(温度、盐度、营养盐浓度)及生物学特征(总叶绿素a浓度及不同粒级浮游植物的比例)均没有明显差异.因此,当添加相同浓度的沙尘和灰霾时,各站位叶绿素a累积浓度之间也会保持一致.
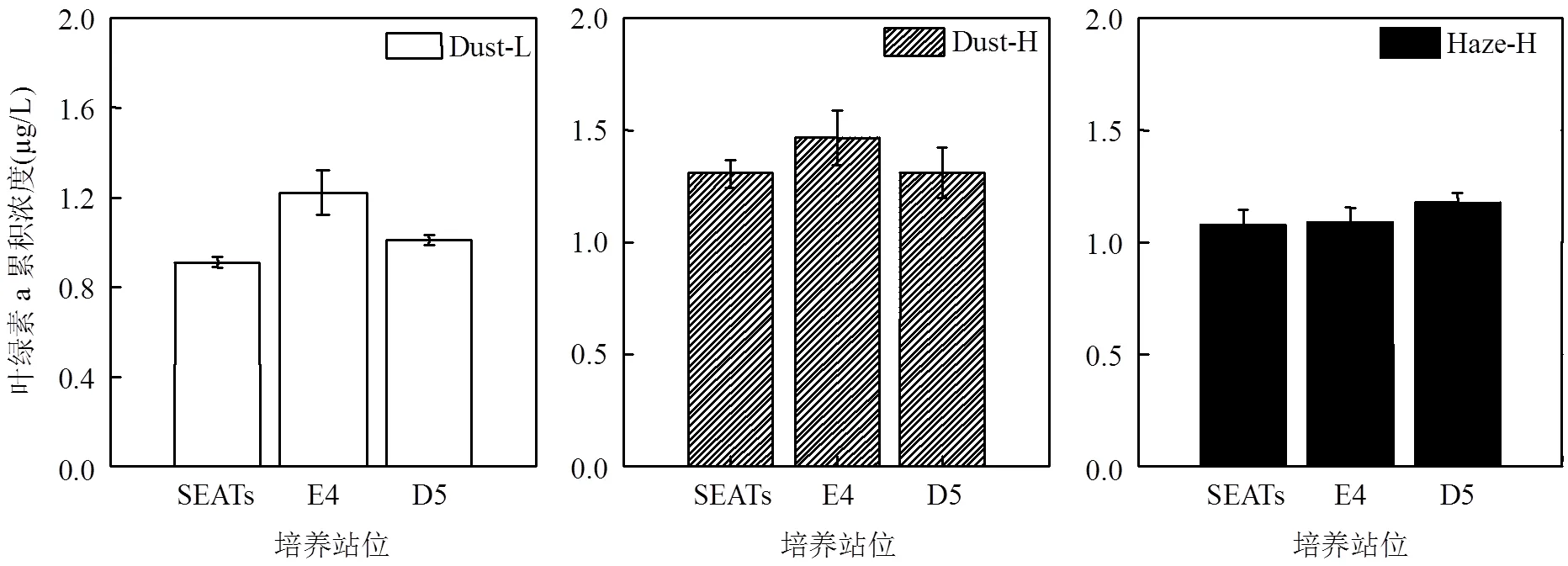
图6 各培养站位沙尘和灰霾添加组叶绿素a累积浓度的对比
3.2 沙尘和灰霾添加组浮游植物的生长变化过程
3.2.1 沙尘和灰霾添加组叶绿素a浓度的变化 在过去的研究中,现场观测和模型模拟更多地关注浮游植物受营养盐影响的最终结果,对其增长变化过程的研究较少[2,36-37].在培养实验中发现,沙尘和灰霾添加组叶绿素a浓度变化呈现双峰分布特征(图2~3):在培养的第1d就有明显增长,第4~6d出现再次增长.Paytan等[1]的研究中也曾出现了浮游植物生长的双峰现象,但没做具体讨论.沙尘和灰霾添加均能促进各粒级浮游植物的生长,从总叶绿素a和分粒级叶绿素a浓度的变化可以看出(图3,图7),叶绿素a的第1个峰值是由于超微型浮游植物能够较快地利用添加的营养物质,因此出现了浮游植物的短暂生长;在第1个峰值之后,叶绿素a浓度出现下降或平缓变化的现象,可能是由于更多种类的浮游植物对添加营养盐的适应过程导致的;由于小型、微型浮游植物和超微型浮游植物的共同增长造成了第4~6d叶绿素a浓度的快速增加.
在3个站位中(图3),SEATs站对照组叶绿素a浓度与沙尘和灰霾添加组的增长趋势相似,均在第1~2d出现第1个峰值,但沙尘和灰霾的添加促进了叶绿素a浓度第2个峰值的形成.同时,与对照组相比,沙尘和灰霾添加能为浮游植物提供营养物质,使添加组第1个峰值略高于对照组.E4站,沙尘和灰霾添加能够明显促进双峰现象的出现,可能是由于该区域浮游植物能够较快适应营养环境的变化.D5站,灰霾添加组中,叶绿素a浓度的双峰现象不明显,对比灰霾添加组各粒级叶绿素a浓度变化可见,灰霾的添加在培养第1天并没有明显促进超微型浮游植物的生长,这可能是由于在D5站位灰霾添加组的重金属对超微型浮游植物的生长表现出了抑制作用.
3.2.2 沙尘和灰霾添加组浮游植物群落结构的变化 沙尘和灰霾的添加能够通过影响不同粒级浮游植物的生长优势来改变浮游植物的群落结构.通过培养过程中第0,1d和最后1d(出现第2个峰值)各粒级叶绿素a占总叶绿素a比例发现(图8~9):在培养第1d(出现第1个峰值)与第0d相比变化不明显,仍然是超微型浮游植物占绝对优势,这也是导致总叶绿素a浓度在培养第1d出现一个峰值的原因;但最后1d与对照组相比,各站位添加组中超微型浮游植物贡献率有明显变化.
SEATs站培养的最后1d,在对照组,超微型浮游植物叶绿素a浓度占总叶绿素a浓度的比例仍在80%以上;在低、高浓度沙尘添加组,超微型浮游植物叶绿素a浓度占总叶绿素a浓度比例降为32%和24%.在E4站位,对照组超微型浮游植物贡献率降为58%,低、高浓度沙尘组超微型浮游植物的贡献率较对照组贡献率下降更明显,分别为45%和39%.在D5站,对照组超微型浮游植物贡献率降为67%,低、高浓度沙尘组超微型浮游植物贡献率略有下降,分别为61%和48%.可见,培养开始时,各站位超微型浮游植物占比具有明显优势(84%~86%),沙尘添加后,能够显著提高小型和微型浮游植物的比率,明显降低超微型浮游植物的比率,使浮游植物优势种群由超微型向小型和微型浮游植物转变.
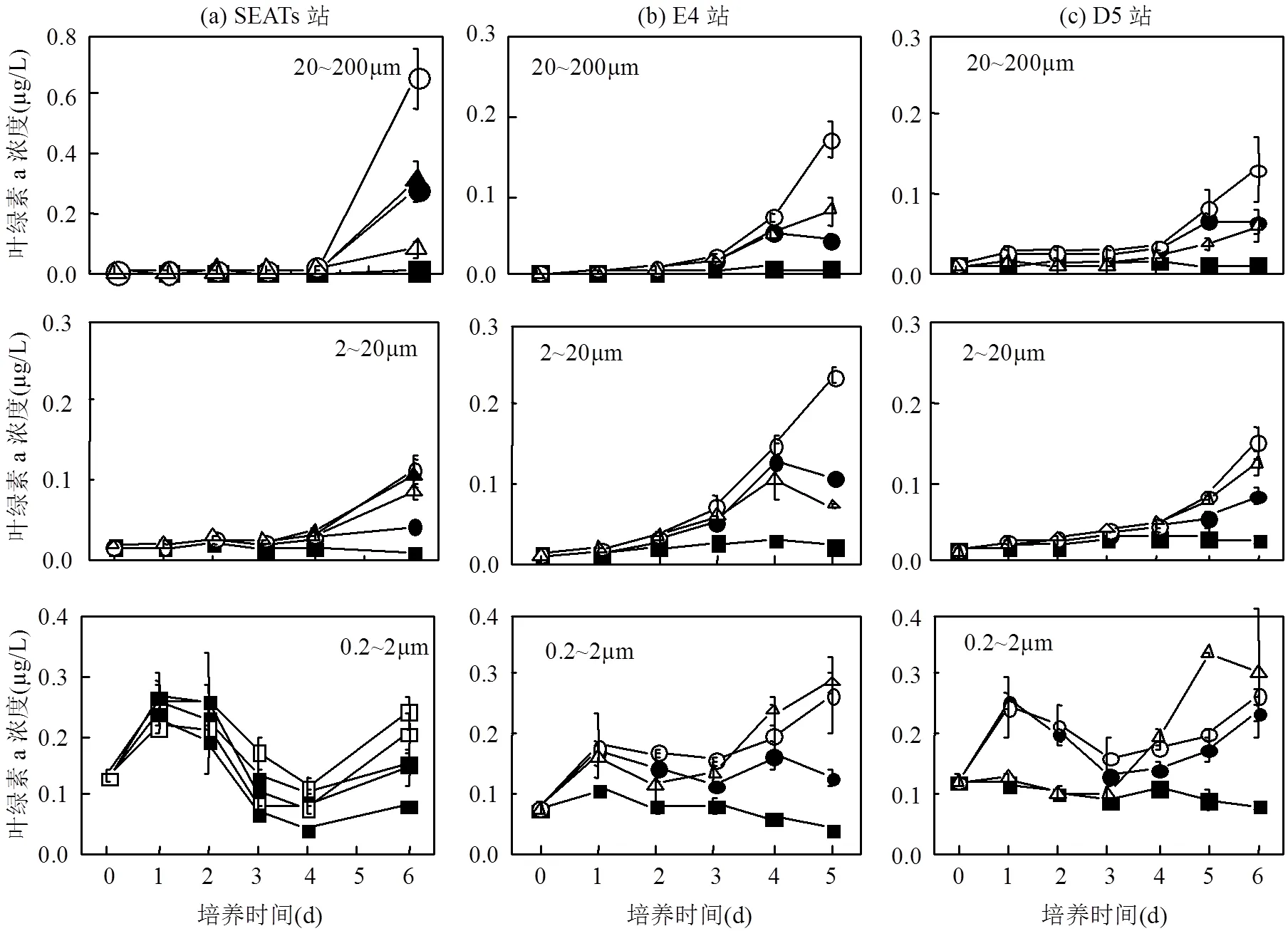
图7 各站位灰霾和沙尘添加组不同粒级叶绿素a浓度的变化
C、L、H分别代表对照组、低浓度沙尘添加组、高浓度沙尘添加组
在SEATs站,培养的最后1d,低浓度灰霾添加组中超微型浮游植物贡献率比例降为26%,明显低于对照组;高浓度灰霾添加组中,超微型浮游植物贡献率降为55%,与对照组相比变化不大.在E4和D5站,灰霾添加组各粒级浮游植物的比例与对照组相比无显著差异.培养初期,超微型浮游植物贡献率最大,但在培养末期,各粒级浮游植物都有一定程度增长,导致了群落结构的一定变化,使超微型浮游植物占绝对优势(>80%)变为以超微型浮游植物为主(>50%).
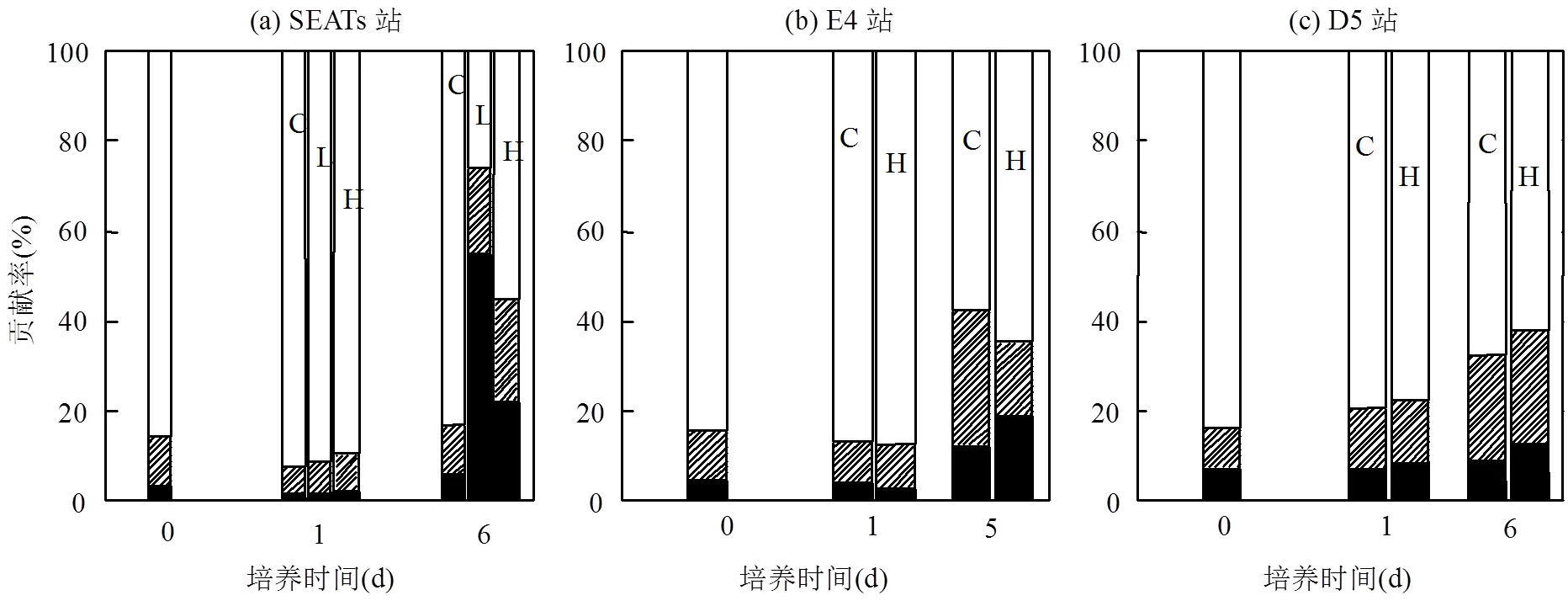
图9 各站位灰霾添加组分粒级叶绿素a贡献率的变化
C、L、H分别代表对照组、低浓度灰霾添加组、高浓度灰霾添加组
南海等寡营养海区,超微型浮游植物具有竞争优势,因此成为海区浮游植物的优势种群.而在营养盐添加条件下,硅藻等小型浮游植物具有较强的吸收营养盐能力[2,38-39],在种间竞争中逐渐占优,故导致在有沙尘添加的条件下,由超微型浮游植物占绝对优势转变为小型或微型占优.高浓度灰霾添加组与对照组相比,在培养末期各站位并没有出现浮游植物群落结构的明显变化,这可能是由于高浓度灰霾中既含有丰富的营养盐,也含有较高浓度的Cu、Pb等重金属,这些物质对小型和微型浮游植物生长的促进和抑制作用可能产生了某种程度的抵消.
3.3 沙尘和灰霾添加对超微型浮游植物的影响
在南海的贫营养海域,相对于硅藻等小型浮游植物,超微型浮游植物能够更好地适应低营养盐环境,在浮游植物群落中占有明显的优势[2].本研究对比了培养第0和最后1d聚球藻(Syn)、原绿球藻(Pro)和超微型真核浮游植物(Peuk)在沙尘和灰霾添加组中的细胞丰度变化(图10).沙尘添加组与对照组相比,培养的最后1d各站超微型浮游植物的细胞丰度都有明显增大.SEATs站低、高浓度沙尘添加组原绿球藻分别是对照组的2.1倍和1.7倍,聚球藻和超微型真核浮游植物略有增长.E4站低、高浓度沙尘添加组原绿球藻细胞丰度略有变化,聚球藻细胞丰度分别为对照组的1.7倍和1.8倍;超微型真核浮游植物细胞丰度分别为对照组的2.8倍和3.9倍.D5站低、高浓度沙尘添加组3种藻种细胞丰度都有一定的增长,原绿球藻细胞丰度分别是对照组的1.8倍和1.7倍,聚球藻分别为对照组的2.3倍和3.0倍,超微型真核浮游植物分别为对照组的3.0倍和2.0倍.由此可见,低、高浓度沙尘对超微型浮游植物藻种生长的影响与沙尘添加量没有明显的正相关关系.灰霾添加组与沙尘添加组不同,培养的最后1d,各站位高浓度灰霾组的原绿球藻与对照组相比变化不大,但聚球藻和超微型真核浮游植物有不同程度的降低,SEATs、E4和D5站位聚球藻细胞丰度分别降为对照组的10%、19%和59%,超微型真核浮游植物分别降为对照组的71%、48%和48%.由此可见,高浓度灰霾对聚球藻和超微型真核浮游植物生长有一定的抑制作用,而对原绿球藻无明显的抑制作用.Paytan等[1]发现,自然沙尘对原绿球藻、聚球藻和超微型真核浮游植物的生长有促进作用,而含有高浓度重金属的撒哈拉沙尘对聚球藻和超微型真核浮游植物有一定的毒性作用.本实验中,由于灰霾中含有较高浓度的重金属,导致了聚球藻和超微型真核浮游植物细胞丰度的减少.
有研究认为,超微型浮游植物的碳含量是高营养级生物的有机碳来源,也对上层海洋向深海的碳输出有贡献[38].本文定义CA为超微型浮游植物碳生物量(mg/m3),b为超微型浮游植物细胞丰度,为碳转化因子,则根据乐凤凤等[38]的公式,
CA=b×
参照Liu等[40]的工作,在海洋表层,聚球藻和原绿球藻的碳转化因子分别是67fg (10-12mg)/cell和24fg/cell,超微型真核浮游植物的碳转化因子是1500fg/cell.
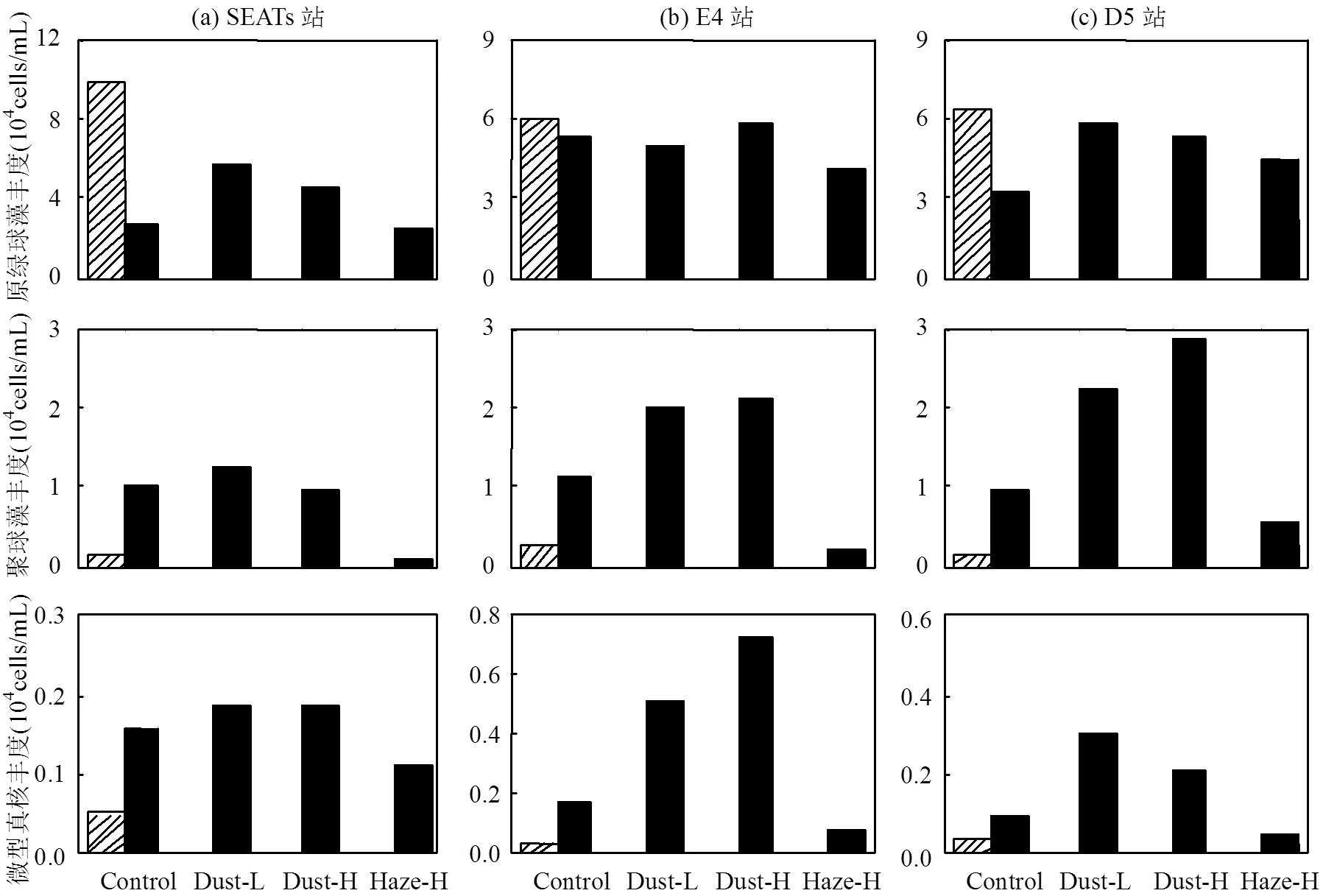
图10 各站位超微型浮游植物细胞丰度的变化


由此得到了沙尘和灰霾添加组总碳生物量(聚球藻、原绿球藻和超微型真核浮游植物碳生物量的总和)的分布(图11).培养最后1d与培养第0d相比,各站位对照组的碳生物量都有一定量增加.沙尘的添加能够促进超微型浮游植物总碳生物量的增大,培养的最后1d,在SEATs站,低、高浓度沙尘添加组总碳生物量分别是对照组的1.3倍和1.2倍;在E4站,低、高浓度沙尘添加组总碳生物量分别是对照组的2.2倍和2.9倍;在D5站,低、高浓度沙尘添加组总碳生物量分别是对照组的2.5倍和2.2倍.由于超微型真核浮游植物的细胞含碳量较大且其细胞丰度随沙尘浓度变化较小,导致低浓度和高浓度沙尘之间总碳生物量差异较小.在SEATs、E4和D5站,灰霾添加导致超微型浮游植物总碳生物量的减少,培养最后1d分别降为对照组的63%、51%和74%.由于各超微型浮游植物不同的细胞碳含量及培养前后所占比例的变化,总体来看灰霾添加对超微型浮游植物叶绿素a浓度有促进作用(图7),而对细胞丰度和碳生物量有一定的抑制作用(图10,图11).这种高浓度灰霾对超微型浮游植物固碳的抑制作用,可能会对贫营养海区的碳循环过程以及海洋表层向深层的碳输出产生影响,因此大气灰霾沉降对海洋生物地球化学过程影响的研究亟待加强.
4 结论
4.1 在南海的陆坡、陆架和海盆区域,海洋表层浮游植物的生长均受到N和P的共同限制.沙尘和灰霾添加均能够促进浮游植物的生长,且培养期间叶绿素a累积浓度与沙尘添加浓度之间呈显著的正相关关系.在南海的3个不同海区,沙尘和灰霾添加对浮游植物生长的影响无显著差别.
4.2 在沙尘和灰霾添加实验中,叶绿素a浓度的变化呈现双峰分布特征,第1~2d出现第1个峰值,主要是超微型浮游植物的生长造成的;在第5~6d出现浮游植物的再次增长,第2个峰值是小型、微型和超微型3种粒级浮游植物的共同贡献,且在陆坡(E4)区域的双峰现象最为明显.
4.3 沙尘和低浓度灰霾溶出的营养盐使小型和微型浮游植物叶绿素a浓度增加幅度较大,浮游植物粒级结构由超微型向小型和微型转移,超微型浮游植物贡献率由高于80%降至24%~61%;在高浓度灰霾添加组,由于营养盐与毒性物质的综合作用,小型和微型浮游植物的生长幅度较小,浮游植物粒级结构变化不明显,培养期间超微型浮游植物的贡献率始终高于50%.
4.4 沙尘添加能够促进超微型浮游植物细胞丰度和碳生物量的增加,而高浓度灰霾添加抑制聚球藻和超微型真核浮游植物的生长,从而降低超微型浮游植物的细胞丰度和碳生物量.
[1] Paytan A, Mackey K R, Chen Y, et al. Toxicity of atmospheric aerosols on marine phytoplankton [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(12):4601-4605.
[2] Guo C, Yu J, Ho T Y, et al. Dynamics of phytoplankton community structure in the South China Sea in response to the East Asian aerosol input [J]. Biogeosciences, 2011,8(4):1519-1536.
[3] Chien C T, Mackey K R M, Dutkiewicz S, et al. Effects of African dust deposition on phytoplankton in the western tropical Atlantic Ocean off Barbados [J]. Global Biogeochemical Cycles, 2016,30(5): 716-734.
[4] Guieu C, Dulac F, Desboeufs K, et al. Large clean mesocosms and simulated dust deposition: a new methodology to investigate responses of marine oligotrophic ecosystems to atmospheric inputs [J]. Biogeosciences Discussions, 2010,7(9):2765-2784.
[5] Mills M M, Moore C M, Langlois R, et al. Nitrogen and phosphorus co‐limitation of bacterial productivity and growth in the oligotrophic subtropical North Atlantic [J]. Limnology and Oceanography, 2008, 53(2):824-834.
[6] Herut B, Zohary T, Krom M D, et al. Response of East Mediterranean surface water to Saharan dust: On-board microcosm experiment and field observations [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2005,52(22):3024-3040.
[7] Jickells T D, An Z S, Andersen K K, et al. Global iron connections between desert dust, ocean biogeochemistry, and climate [J]. Science, 2005,308(5718):67-71.
[8] Shi J H, Gao H W, Zhang J, et al. Examination of causative link between a spring bloom and dry/wet deposition of Asian dust in the Yellow Sea, China [J]. Journal of Geophysical Research: Atmospheres, 2012,117(D17034):1-8.
[9] Moore C M, Mills M M, Milne A, et al. Iron limits primary productivity during spring bloom development in the central North Atlantic [J]. Global Change Biology, 2006,12(4):626-634.
[10] Liu Y, Zhang T R, Shi J H, et al. Responses of chlorophyll a to added nutrients, Asian dust, and rainwater in an oligotrophic zone of the Yellow Sea: Implications for promotion and inhibition effects in an incubation experiment [J]. Journal of Geophysical Research, 2013, 118(4):1763-1772.
[11] Wang F J, Chen Y, Guo Z G, et al. Combined effects of iron and copper from atmospheric dry deposition on ocean productivity [J]. Geophysical Research Letters, 2017,44(5):2546-2555.
[12] Zheng M, Guo Z, Fang M, et al. Dry and wet deposition of elements in Hong Kong [J]. Marine Chemistry, 2005,97(1/2):124-139.
[13] Sun Y, Zhuang G, Tang A, et al. Chemical characteristics of PM2.5and PM10in haze-fog episodes in Beijing [J]. Environmental science and technology, 2006,40(10):3148-3155.
[14] Mohamed C A R, Sabuti A A, Saili N A. Atmospheric deposition of210Po and210Pb in Malaysian waters during haze events [J]. Journal of Radioanalytical and Nuclear Chemistry, 2013,297(2):257-263.
[15] Coale K H. Effects of iron, manganese, copper, and zinc enrichments on productivity and biomass in the subarctic Pacific [J]. Limnology and Oceanography, 1991,36(8):1851-1864.
[16] Duce R A, Tindale N W. Atmospheric transport of iron and its deposition in the ocean [J]. Limnology and Oceanography, 1991,36(8): 1715-1726.
[17] 李佳慧,张 潮,刘 莹,等.沙尘和灰霾沉降对黄海春季浮游植物生长的影响[J]. 环境科学学报, 2017,37(1):112-120.
[18] Mann E L, Ahlgren N, Moffett J W, et al. Copper toxicity and cyanobacteria ecology in the Sargasso Sea [J]. Limnology and Oceanography, 2002,47(4):976-988.
[19] Gao Y, Arimoto R, Duce R A, et al. Temporal and spatial distributions of dust and its deposition to the China Sea [J]. Tellus. Series B, Chemical and physical meteorology, 1997,49(2):172-189.
[20] Lekunberri I, Lefort T, Romero E, et al. Effects of a dust deposition event on coastal marine microbial abundance and activity, bacterial community structure and ecosystem function [J]. Journal of Plankton Research, 2010,32(4):381-396.
[21] Wang S H, Hsu N C, Tsay S C, et al. Can Asian dust trigger phytoplankton blooms in the oligotrophic northern South China Sea? [J]. Geophysical Research Letters, 2012,39(5):L05811:1-6.
[22] Kim T W, Lee K, Duce R, et al. Impact of atmospheric nitrogen deposition on phytoplankton productivity in the South China Sea [J]. Geophysical Research Letters, 2014,41(9):3156–3162.
[23] Chen Y L L, Chen H Y, Karl D M, et al. Nitrogen modulates phytoplankton growth in spring in the South China Sea [J]. Continental Shelf Research, 2004,24(4):527-541.
[24] Duce R A, Laroche J, Altieri K, et al. Impacts of atmospheric anthropogenic nitrogen on the open ocean [J]. Science, 2008, 320(5878):893-897.
[25] 李丽云,邓雪娇,何启华,等.近35年广东省区域灰霾天气过程的变化特征及突变分析[J]. 中国环境科学, 2016,36(8):2297-2303.
[26] Wang H J, Chen H P. Understanding the recent trend of haze pollution in eastern China: roles of climate change [J]. Atmospheric Chemistry and Physics, 2016,16(6):4205-4211.
[27] Chen, Y-L L, Chen H-Y (2006), Seasonal dynamics of primary and new production in the northern South China Sea: The significance of river discharge and nutrient advection, Deep Sea Res. Part I, 53(6): 971-986.
[28] 贲孝宇,石金辉,仇 帅,等.青岛大气气溶胶中铁的溶解度及其影响因素[J]. 环境科学学报, 2015,35(1):65-71.
[29] Wang L, Qi J H, Shi J H, et al. Source apportionment of particulate pollutants in the atmosphere over the Northern Yellow Sea [J]. Atmospheric Environment, 2013,70(4):425-434.
[30] Moore C M, Mills M M, Langlois R, et al. Relative influence of nitrogen and phosphorous availability on phytoplankton physiology and productivity in the oligotrophic sub-tropical North Atlantic Ocean [J]. Limnology and Oceanography, 2008,53(1):291-305.
[31] Martin J H. Glacial-interglacial CO2change: The Iron Hypothesis [J]. Paleoceanography, 1990,5(1):1-13.
[32] Li Q, Legendre L, Jiao N. Phytoplankton responses to nitrogen and iron limitation in the tropical and subtropical Pacific Ocean [J]. Journal of Plankton Research, 2015,37(2):306-319.
[33] Moore C M, Mills M M, Arrigo K R, et al. Processes and patterns of oceanic nutrient limitation [J]. Nature Geoscience, 2013,6(9):701-710.
[34] Wu J, Chung S W, Wen L S, et al. Dissolved inorganic phosphorus, dissolved iron, and Trichodesmium in the oligotrophic South China Sea [J]. Global Biogeochemical Cycles, 2003,17(1):1-10.
[35] Zhang J, Zou L, Wu Y, et al. Atmospheric Wet Deposition and Changes in Phytoplankton Biomass in the Surface Ocean [J]. Geophysical Research Letters, 2004,31(11):L11310:1-4.
[36] Mélançon J, Levasseur M, Lizotte M, et al. Effects of dust additions on phytoplankton growth and DMS production in high CO2northeast Pacific HNLC waters [J]. Biogeosciences, 2015,13(5):1677-1692.
[37] Zubkov M V, Sleigh M A, Tarran G A, et al. Picoplanktonic community structure on an Atlantic transect from 50°N to 50°S [J]. Deep Sea Research Part I Oceanographic Research Papers, 1998,45(8):1339-1355.
[38] 乐凤凤,蔡昱明,孙 军,等.2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析[J]. 海洋学报, 2015,37(12): 41-55.
[39] Waite A M, Safi K A, Hall J A, et al. Mass sedimentation of picoplankton embedded in organic aggregates [J]. Limnology and Oceanography, 2000,45(1):87-97.
[40] Liu H, Chang J, Tseng C M, et al. Seasonal variability of picoplankton in the Northern South China Sea at the SEATS station [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2007,54(14):1602- 1616.
致谢:感谢中国海洋大学张国玲老师对本研究中营养盐样品测定的帮助、石金辉老师组对气溶胶样品采集和测定的帮助、高阳老师对文章内容修改的帮助;感谢国家海洋局第一海洋研究所王宗灵课题组对研究中超微型浮游植物样品的测定;感谢为实验提供帮助的所有老师和同学.
Responses of phytoplankton to dust and haze particle additions in the South China Sea.
MU Ying-chun1, CHU Qiang1, ZHANG Chao1, HE Jing-yi1, GAO Hui-wang1,2*
(1.Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;2.Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China)., 2018,38(9):3512~3523
On-board incubation experiments were conducted at three sampling stations from May to June 2016 in the South China Sea (SCS) to explore the impact of dust and haze addition on phytoplankton biomass and community structure. By providing the nutrients such as N and P, the addition of dust and haze in general promoted the growth of phytoplankton, and the promotion magnitude is tightly related to the amount of dust and haze addition. By calculation of nutrient index and chlorophyll a cumulative concentration, it was found that the accumulatedchlorophyll a during the incubation experiment showed statistically significant positive correlation with the amount of added dust (2=0.87,<0.01); In terms of the dust, similar promotion mechanism was found when the haze concentration was low (2=0.91,<0.01). However, when the haze concentration continued to increase, the accumulation of chlorophyll a was hindered to some extent, likely an effect of the high content of toxic substances in haze. Size-fraction chlorophyll a showed that the addition of dust and low concentration of haze facilitated that the transition of dominant phytoplankton species from pico-sized phytoplankton to micro- and nano-sized phytoplankton, while the synthetic effect of nutrients and toxic substance, resulting from the addition of high haze concentration, yielded no obvious effect on the size structure of phytoplankton. The pico-sized phytoplankton abundance tests showed that the dust addition promoted the development of all three species includingand picoeukaryotes, whereas the addition of high concentration haze addition may inhibit the growth ofand picoeukaryotes.
dust;haze;South China Sea;phytoplankton;inhibition;promotion
X513
A
1000-6923(2018)09-3512-12
牟英春(1991-),女,山东滨州人,中国海洋大学硕士研究生,主要研究方向为海洋生态动力学.
2018-01-29
国家自然科学基金资助项目(41210008);国家重点基础研究发展规划(973)项目(2014CB953702)
* 责任作者, 教授, hwgao@ouc.edu.cn
