原发性中枢神经系统弥漫性大B细胞淋巴瘤诊疗分析*
2018-09-21周华华董坚黄梅芳
周华华 董坚 黄梅芳
(1.云南省曲靖市第一人民医院肿瘤科,云南 曲靖 655000;2.云南省肿瘤医院肿瘤内科,云南 昆明 655031)
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种罕见的原发于中枢神经系统的结外侵袭性非霍奇金淋巴瘤,主要累及大脑、小脑、脑干、眼、软脑膜和脊髓等中枢神经部位,不伴有全身其他部位受累,约占原发性颅内肿瘤的3%,所有非霍奇金淋巴瘤的1%~2%和结外淋巴瘤的4%~6%[1]。约90%的PCNSL的病理类型是弥漫性大B细胞瘤,其他亚型有低度恶性淋巴瘤、伯基特淋巴瘤及T细胞淋巴瘤[2]。近30余年,无论是免疫抑制性还是免疫功能正常的中枢神经系统淋巴瘤的发病率均明显上升。在免疫功能正常的患者中,PCNSL平均诊断年龄是55岁,免疫抑制性患者则较为年轻,在艾滋病患者中平均诊断年龄为31岁[3]。本文对2015年1月~2017年1月曲靖市第一人民医院肿瘤科收治的2例原发性中枢神经系统弥漫性大B细胞淋巴瘤患者的临床特征、治疗方案及疗效进行探讨。
1 资料与方法
1.1 病例1 患者女性41岁,因颅内弥漫性大B细胞淋巴瘤术后1月余,拟化疗入院。患者2014年12月无诱因突发头痛,伴恶心、呕吐,无畏寒发热、无昏迷、抽搐,无视物旋转及视物模糊,无肢体活动障碍,行头颅CT发现左侧颞、顶叶占位,遂在外院行左颞顶叶肿块切除术,术后病检示(左颞顶部)非霍奇金淋巴瘤,弥漫性大B细胞淋巴瘤GCB。免疫组化提示瘤细胞GFAR(灶+),Ki-67(灶性20%),CD34(血管+),LCA(+),CD20(+),CD79a(+),Bcl-6(灶+),pax-5(+),Bcl-2(-),PR(-),CD3(-),CD38(-),CD138(-),CD43(-),CD56(-),CD45RO(-),CD10(-),CK(-),EMA(-),S-100(-),Vim(-),P53(-),MUM-1(-),MPO(-)。术后半月在外院行术区伽马刀治疗,治疗后复查头颅CT示颅内无占位,大片水肿带。躯干CT:心肺、纵隔、肝胆、胰脾、双肾、膀胱、子宫及双侧附件扫描未见明显异常。既往史:无特殊。入院查体:体温36.4℃,心率68次/min,呼吸20次/min,血压120/75mmHg,皮肤巩膜无黄染,无瘀点瘀斑。浅表未触及肿大淋巴结,左颞顶部可见手术瘢痕,愈合可,肺部听诊双肺呼吸音清,未闻及干湿啰音,心律齐,各瓣膜听诊区未闻及病理性杂音,腹软,无压痛,肝脾肋下未触及,双下肢无浮肿,足背动脉搏动良好。神经系统:语言流利,回答切题,反应灵敏,理解力正常,双瞳孔等大正圆,直径约3.0mm,对光反应灵敏。双眼向各方向运动充分,无眼球眼震。双侧额纹以及鼻唇沟对称,软腭及悬雍垂居中,反射正常,伸舌居中,脑膜刺激征(-),颈强阴性。四肢肌力Ⅴ级,肌张力正常。肌腱反射BCR,TCR,PSR,ASR均(++),双侧Babinski征(-)。痛觉、轻触觉、运动觉、位置觉、振动觉查体未见明显异常。指鼻试验双侧稳准。跟膝胫试验双侧稳准。辅助检查:血液常规、生化常规、脑脊液及骨髓常规无异常。糖类抗原(CA724)39.75U/L。HBVsAg阴性。抗HIV抗体阴性。入院诊断:原发中枢神经系统弥漫大B细胞淋巴瘤术后伽马刀治疗后。ECOG评分:1分。
治疗及转归:于2015年1月~5月予ECHOP方案(第1-3天替尼泊苷100mg静脉滴注,第1天环磷酰胺1.0 g静脉注射,第1天长春新碱2mg静脉注射,第1天阿霉素60mg静脉注射,第1~5天口服强的松100 mg,每3周重复)化疗6周期,化疗过程顺利,有Ⅰ-Ⅱ级消化道反应,Ⅱ-Ⅲ骨髓抑制,对症治疗后好转。全身化疗结束后于2015年5月7日行头颅核磁示左侧颞叶、顶枕叶交界区白质区见小片状稍长T2信号病灶,边界欠清楚,无占位表现,在FLAIR像上呈高信号(见图1)。2015年6月末因再发头痛,伴恶心、呕吐收住我科,2015年6月27日复查头颅示核磁示右额顶叶、双枕叶、胼胝体、左侧大脑脚及双侧脑室三角区见多发大小不一块状及不规则长T1稍长T2信号灶,边缘模糊,周围见大片状水肿信号,部分病灶呈“握拳征”改变,侧脑室受压变窄,中线结构向对侧偏移较大约11mm,增强扫描后病灶明显均匀强化(见图2)。患者颅内多发转移灶,予总量DT 45 Gy/25 次全脑放疗,放疗结束后未行化疗。2015年9月因再发头痛头昏,伴恶心、呕吐,无明显头痛,无肢体活动障碍,遂至我科,2015年9月11日复查头部核磁示右额顶叶、左侧颞叶及大脑脚、双枕叶、胼胝体、脑室三角区见多发大小不一块状及不规则状长T1稍长T2信号灶,边缘模糊,周围见水肿信号,轻度占位效应,中线结构无明显偏移(见图3)。患者颅内病灶较前缩小,建议更换化疗方案化疗,患者拒绝。2015年10月因头痛、恶心、呕吐至我科,2015年10月17日行头部核磁示左侧额颞骨局部缺损,右侧额叶、左侧左侧颞、枕叶、双侧顶叶胼胝体后份、延髓及上段颈髓内见多发大小不等片状等、稍长T1、长T2信号病灶,边界欠清,FLAIR像上呈高及稍低信号,增强扫描见左侧额颞部脑膜呈均匀线样强化,延髓及颈髓内病灶呈明显不均匀强化,颈髓内病灶达第3颈椎椎体平面,与前MRI片对比:延髓及颈1-3椎体平面颈髓内异常信号病灶:淋巴瘤浸润(见图4)。患者ECOG评分4分,无法耐受全身/局部放化疗,予脱水、对症支持治疗,半月后因呼吸循环衰竭死亡。
1.2 病例2 患者男性51岁,因“颅内弥漫性大B细胞淋巴瘤术后半月,头痛、呕吐2天”入院。患者2016年7月无诱因反复头痛1月余,呈进行性加重,伴恶心呕吐、头昏乏力,无发热、无视物模糊,无肢体活动障碍,无意识丧失、抽搐,未予诊治。半月后出现记忆力减退,行走不稳,行头颅CT发现左侧小脑、左枕叶占位,遂在外院行左侧小脑半球占位探查切除术,术后病检提示(左侧小脑半球)非霍奇金淋巴瘤,弥漫性大B细胞淋巴瘤non-GCB型。免疫组化提示瘤细胞Bcl-6(+),MUM-1(+),Bcl-2(+/-),LCA(+),CD20(+),Ki-67(+约90%),CD79a(+),pax-5(+),C-myc(+),GFAR(-),CD3(-),CD5(-),CD10(-),CK(-)。术后半月再发头痛,头昏,伴恶心、呕吐,为进一步诊治就诊我院并收住我科。既往史:无特殊。入院查体:体温36.7℃,心率95次/min,呼吸20次/min,血压110/68mmHg,皮肤巩膜无黄染,无瘀点瘀斑。浅表未触及肿大淋巴结,左后枕部见手术瘢痕,愈合可,肺部听诊双肺呼吸音清,未闻及干湿啰音,心律齐,各瓣膜听诊区未闻及病理性杂音,腹软,无压痛,肝脾肋下未触及,双下肢无浮肿,足背动脉搏动良好。神经系统:语言流利,回答切题,反应灵敏,理解力正常,双瞳孔等大正圆,直径约3.0mm,对光反应灵敏。双眼向各方向运动充分,无眼球眼震。双侧额纹以及鼻唇沟对称,软腭及悬雍垂居中,反射正常,伸舌居中,脑膜刺激征(-),颈强阴性。四肢肢体肌力Ⅳ级,肌张力正常。肌腱反射BCR,TCR,PSR,ASR均(++),双侧Babinski征(-)。痛觉、轻触觉、运动觉、位置觉、振动觉查体未见明显异常。指鼻试验阳性。跟膝胫试验阳性。辅助检查:血液常规、生化常规、脑脊液及骨髓常规无异常。肿瘤标志物无异常。HBVsAg阴性。抗HIV抗体阴性。2016年8月15日行头颅核磁示:左后枕部局部骨质及皮下软组织呈术后改变,左侧小脑半球形态肿胀,其内见片状等长T1、T2混杂信号灶,静脉注入造影剂增强扫描见手术区呈环形强化并可见片状明显强化病变,病变大小约33mmX24mmX13mm(见图5)。躯干CT示:①双肺、纵隔未见异常。②肝胆胰脾肾膀胱未见异常。入院诊断:原发中枢神经系统弥漫大B细胞淋巴瘤术后。ECOG评分:2分。
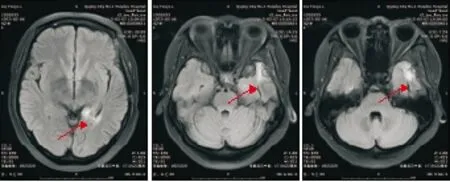
图1例1患者2015年5月7日头颅MRI检查结果(术后、6周期化疗后)
Figure1Thefirstcase'sheadmagneticresonanceimagingresultsinMay7,2015(aftersurgeryandthesixthcyclesofsystemicchemotherapy

图2 例1患者2015年6月27日头颅MRI检查结果(6周期化疗后1月余)
Figure2Thefirstcase'sheadmagneticresonanceimagingresultsinJune27,2015(morethanonemonthafterthesixthcyclesofsystemicchemotherapy)
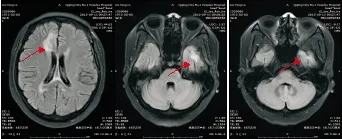
图3 例1患者2015年9月11日头颅MRI检查结果(全脑放疗后1月余)Figure 3 The first case's head magnetic resonance imaging results in September 11, 2015 (more than one month after whole brain radiation therapy)
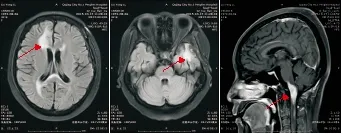
图4 例1患者2015年10月17日头颅MRI检查结果(全脑放疗后2月余)Figure 4 The first case's head magnetic resonance imaging results in October 17,2015(more than two months after whole brain radiation therapy)
治疗及转归:患者术后病灶残留,有放化疗指征,于2016年8月-11月予大剂量甲氨蝶呤联合阿糖胞苷方案(第1天甲氨蝶呤5g静脉滴注22.5h,第2,3天阿糖胞苷2g静脉滴注,每3周重复)化疗6周期,同时水化利尿,碱化尿液,止吐,抑酸护胃,保护粘膜,亚叶酸钙解救及对症治疗。化疗期间有轻度消化道反应及Ⅱ级骨髓抑制,予升白及对症治疗后好转。2016年10月19日复查头颅核磁示:左枕部局部骨质及皮下软组织呈术后改变,左侧小脑半球及颞枕叶交界区见不规则片状等长、混杂T1及稍长T2混杂信号影,边界不清楚,增强扫描左侧小脑半球见环形强化,大小约22mmX18mmX11mm(见图6)。化疗结束后予总量DT 40Gy/25次的全脑放疗。2017年3月2日复查头颅核磁示:左侧枕骨形态及信号异常,左侧小脑半球及颞叶见不规则斑片状长T1长T2信号影,FLAIR像病灶呈高、低不等信号(见图7)。2017年7月1日行头颅核磁示左侧小脑半球、左颞叶片状长T2信号影,FLAIR像左侧小脑半球病灶中间部分呈稍高信号,外周部呈低信号,左颞叶病灶呈高、低混合信号;灶周见斑片状水肿信号影,见图8。
2 结果
截止2017年7月30日随访结束,本文2例患者中例1患者手术切除肿瘤较完全,术后给予6周期ECHOP方案全身化疗及全脑放疗的联合治疗后3月余病情进展,肿瘤浸润延髓,呼吸循环衰竭死亡。另1例患者手术未全切肿瘤,术后给予大剂量甲氨蝶呤联合阿糖胞苷化疗及全脑放疗的联合治疗,现患者存活且放化疗后5月余病情稳定,随访期间未发现迟发性神经毒性。
3 讨论
原发性中枢神经系统淋巴瘤是一种高度侵袭性淋巴瘤,主要为B细胞来源,肿瘤好发于幕上、脑室旁,也可发生于小脑和脑干,软脑膜和脊髓少见,中位生存期3个月左右[4]。其临床表现无特异性,严重程度主要取决于肿瘤部位、大小和数量,超过1/2的患者表现为局部神经系统功能障碍(如轻偏瘫、言语困难),约1/3的患者表现为智力下降及颅内压增高,眼部受侵可出现视物模糊或事物成漂浮状,癫痫发作较少见。原发性中枢神经系统淋巴瘤MRI的影像学特征表现:T1WI呈等或低信号、T2WI呈等或稍高信号、FLAIR成像呈高信号、DWI呈高信号,增强后呈均匀一致强化,可形成“缺口征”、“尖角征”、“握拳征”特征性表现[5]。本文2例患者年龄均小于60岁,无乙肝,免疫功能正常,临床表现除癫痫发作外,均具有颅内高压、局部神经系统功能障碍。影像学检查均符合T1WI等或低信号、T2WI等或稍高信号、FLAIR成像高信号、DWI高信号等特征。需要注意的是当颅内病变弥漫分布,早期占位效应不明显,且MRI提示脑室旁白质内多个大小不等的异常信号时,PCNSL需要与脑脱髓鞘疾病相鉴别[6]。因此PCNSL的诊断标准应满足以下条件[7]:①临床症状:以中枢神经系统为首发表现。②辅助检查:主要为影像学检查,且诊断>3月未发现颅外有淋巴瘤的发生。③病理学:病理组织形态学检查及免疫组化标记是诊断PCNSL的金标准。由于PCNSL多灶性、弥漫浸润特点,手术不推荐广泛切除,目前多数专家推荐立体定向活检作为外科首选[8]。只有当 PCNSL患者出现脑积水、占位效应明显或存在诊断不明的单个易切除病灶情况才考虑手术治疗[9]。本文2例患者肿瘤占位效应明显,伴明显颅内压增高,手术减压为主要目的,故选择开颅手术明确诊断和治疗。
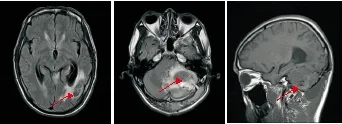
图5 例2患者2016年8月15日头颅MRI检查结果(术后半月化疗前)
Figure5Thesecondcase'sheadmagneticresonanceimagingresultsinSeptember15,2016(halfmonthaftersurgeryandbeforesystemicchemotherapy)
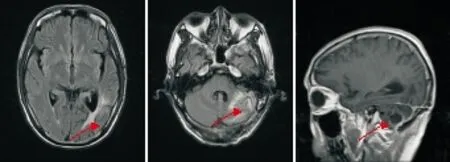
图6 例2患者2016年10月19日头颅MRI检查结果(4周期化疗后)Figure 6 The second case's head magnetic resonance imaging results in October 19, 2016 (after the fourth cycles of systemic chemotherapy)
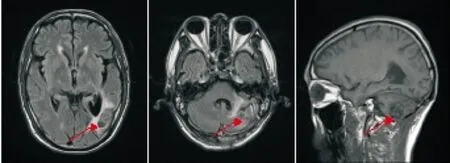
图7 例2患者2017年3月2日头颅MRI检查结果(全脑放疗后2月余)Figure 7 the second case's head magnetic resonance imaging results in March 2,2017(more than two months after whole brain radiation therapy)
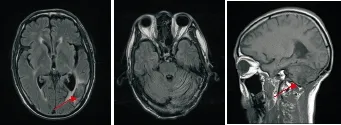
图8 例2患者2017年7月1日头颅MRI检查结果(全脑放疗后5月余)Figure 8 The second case's head magnetic resonance imaging results in July 1, 2017 (more than five months after whole brain radiation therapy)
根据第四版WHO中枢神经系统分类标准,原发性中枢神经系统弥漫性大B细胞淋巴瘤分为生发中心B细胞(germinal center B-cell like,GCB)亚型和活化的外周血B细胞(non-GCB)亚型[10]。GCB亚型的免疫表型包括:CD10+,BCL-6+/-,MUM-1-;CD10+/-,BCL-6+,MUM-1-;CD10+,BCL-6+/-,MUM-1+。non-GCB亚型的免疫表型包括:CD10-,BCL-6+/-,MUM-1+;CD10-, BCL-6+/-,MUM-1-。不同类型的预后各不相同,前者对化疗敏感,预后较好,5年总生存期为74%;后者对化疗不敏感,预后较差,5年总生存期为36%[11]。化疗在PCNSL的治疗中具有重要的地位,但由于血-脑脊液屏障的存在,多数化疗药物很难进入脑组织,根据其对血脑屏障的通透程度,分为低通透性(蒽环类、长春新碱、环磷酰胺)、中通透性(甲氨蝶呤、阿糖胞苷)、高通透性(类固醇、烷化剂)3类[12]。类固醇激素高度通透血脑屏障,一方面能使淋巴瘤细胞凋亡,迅速缓解症状,而另一方面激素破坏瘤细胞的形态结构,使肿瘤在放射影像上消退,使病理学检查困难,故对疑为PCNSL的患者病理确诊前不宜使用类皮质醇激素[13]。甲氨蝶呤(Methotrexate,MTX)中度通透血脑屏障,是治疗PCNSL最有效的化疗药物,也是美国国立综合癌症网络(NCCN)指南推荐的一线药物[14]。研究表明静脉给予HD-MTX(≥3.5/m2)能透过血-脑脊液屏障并在脑组织中达到有效的治疗浓度[15]。大量循证医学证据表明单纯的开颅手术全切或近全切肿瘤并不能使PCNSL患者生存获益,而以全身大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)为基础的单药或联合其他药物(如环磷酰胺、长春瑞滨、卡莫司汀、丙卡巴肼、阿糖胞苷、利妥昔单抗)化疗加或不加鞘内注射甲氨蝶呤,再联合全脑放疗的综合治疗是PCNSL的标准治疗方案[2,16]。鞘内注射MTX化疗仅用于脑脊液(CSF)癌细胞阳性患者。本文2例PCNSL患者均为弥漫性大B细胞淋巴瘤,例1患者为GCB型,手术近全切除肿瘤,选择不含HD-MTX方案的全身化疗及全脑放疗的挽救治疗未能有效地控制疾病,病情进展迅速,最后淋巴瘤浸润延髓死亡,放化疗效果差,而例2患者为non-GCB型,手术未全切肿瘤,术后予大剂量甲氨蝶呤(3.5/m2)联合阿糖胞苷化疗及全脑放疗的综合治疗显示较好的疗效,具有较高的肿瘤缓解率,病人带瘤生存5月余,病情稳定,随访期间未发现迟发性神经毒性。因此,原发中枢神经系统弥漫性大B细胞淋巴瘤化疗方案的选择在一定程度上影响其疗效、无进展生存期(PFS)和总生存期(OS)。
全脑放射治疗(whole brain radiation therapy,WBRT)也是PCNSL的有效治疗手段,PCNSL一般不推荐单纯放疗[17]。大剂量甲氨蝶呤对原发中枢神经系统淋巴瘤治疗有效,并且与WBRT联合使用可延长生存期[18],但对于年龄超过60岁的人群,该治疗可增加迟发性认知功能障碍的发生率[19]。目前WBRT很少用于PCNSL的早期治疗,而作为年轻复发/难治性患者的挽救性治疗手段之一[20-21]。本文例1患者对ECHOP方案化疗无反应,短期内复发,且非原位复发,行总量DT45Gy的全脑放射挽救治疗后颅内肿瘤明显缩小。由于放疗前血脑屏障已被肿瘤极大破环,致使进入颅内病灶的化疗药物浓度增加,且放疗前化疗还能减轻药物的神经毒性,因此WBRT常在化疗之后进行,更好地发挥化疗疗效[14]。本文例2患者年龄小于60岁,全身化疗后未完全缓解,行总量DT40Gy的全脑放射巩固治疗,随访至今病情稳定,且未发现迟发性神经毒性。
复发性/难治性原发性中枢神经系统淋巴瘤患者预后较差,目前尚没有标准治疗方案。文献推荐[22]复发患者如既往接受过全脑放疗,可考虑挽救化疗或再放疗(立体定向放疗),或最佳支持治疗。复发时的化疗包括:继续使用HD-MTX、替莫唑胺、拓泊替康、联合利妥昔单克隆抗体等[23]。替莫唑胺是一种新型的口服烷化剂,咪唑四嗪类衍生物,因其易透过血脑屏障,口服生物利用度高,酸性环境性质稳定,毒性作用小,是NCCN推荐用于复发性PCNSL患者[24]。利妥昔单克隆抗体为人-鼠嵌合抗CD20单克隆抗体,可诱导B细胞凋亡并能提高肿瘤细胞对化疗敏感性,发挥抗B细胞淋巴瘤作用[25]。罗伟等研究发现靶向治疗联合化疗治疗原发中枢性神经系统淋巴瘤可提高患者治疗效果,降低不良反应发生率,提高患者生活质量和生存率,具有显著治疗效果[26]。大剂量化疗联合自体造血干细胞移植(High dose chemotherapy with autologous stem cell transplantation,HDC/ASCT)用于复发/难治PCNSL患者的挽救性治疗,或作为大剂量化疗后的巩固治疗,从而代替了WBRT,减少治疗相关的神经毒性[27]。
4 结论
尽管PCNSL的治疗效果较中枢神经系统外淋巴瘤差,最终仍会出现疾病的复发和进展,但是以HD-MTX为基础的化疗方案的应用在一定程度上改善患者的PFS和OS。本文例1证实WBRT作为年轻复发/难治性患者的挽救治疗,可有效地控制颅内肿瘤;例2患者的治疗再次证实以大剂量甲氨蝶呤联合阿糖胞苷的化疗,辅以全脑放疗的巩固治疗能够有效控制PCNSL肿瘤生长,使病人长期带瘤生存成为可能。但对于复发/难治性PCNSL患者,其最佳治疗方案仍需要进一步研究。
