桑叶总黄酮对T2DM大鼠骨骼肌糖代谢及GSK-3β表达的影响
2018-09-20
(成都医学院药学院,四川成都610083)
骨骼肌是机体葡萄糖氧化利用的主要场所,同时也是胰岛素作用的主要靶组织之一,对糖尿病的发生发展有重要影响[1]。在骨骼肌细胞中,葡萄糖在己糖激酶(hexokinase,HK)的作用下磷酸化成为葡萄糖-6-磷酸,继而在其它酶催化作用下生成肌糖原,为肌肉收缩提供能量。在2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠模型中,出现了肌糖原合成下降[2],HK活性下降的现象[3],从而认为骨骼肌中糖原合成的紊乱会引起血中葡萄糖浓度的升高。
糖原合成激酶-3β(glycogen synthase kinase 3β,GSK-3β)是一种丝氨酸/苏氨酸蛋白激酶,可以磷酸化糖原合酶来调控其活性,影响糖原的合成和分解过程。有研究发现,高糖高脂饮食加链脲佐菌素(streptozotocin,STZ)诱导可使猪骨骼肌GSK-3β mRNA和蛋白表达增加,肌糖原减少,导致骨骼肌胰岛素抵抗(insulin resistance,IR)[4],而抑制 GSK-3β 可以在提高胰岛素敏感性和促进胰岛β细胞增殖这两个方面产生潜在的抗糖尿病效果[5]。
桑叶是桑科桑属植物桑(Morus alba L.)的树叶,历代中医药书中都有桑叶能够治疗消渴的记载。现代药理研究证明桑叶总黄酮对T2DM大鼠有降血糖及促进胰岛素分泌的作用[6]。此外,我们先前的研究发现,桑叶总黄酮可以增加T2DM大鼠肝脏中肝糖原含量,葡萄糖激酶的活性[7]。在此基础上,本文针对桑叶总黄酮对T2DM大鼠骨骼肌中肌糖原含量,HK活性及GSK-3β蛋白表达的影响进行了评价,以期进一步完善桑叶总黄酮的降血糖机制,为桑叶总黄酮治疗T2DM的临床应用提供药理学依据。
1 材料与方法
1.1 动物和饲料
SPF级wistar大鼠85只,雄性,体重200 g~250 g,四川大学华西实验动物中心提供,许可证号:scxk(川)2009-09。在室温 20℃~25℃、湿度(55±5)%、光照周期12 h/12 h的环境中饲养。普通饲料:购自四川大学华西实验动物中心;高脂饲料:按照普通饲料59.8%、白糖15%、猪油10%、食盐2%、胆固醇0.2%、酪蛋白7%、蛋黄粉5%配制[8]。
1.2 药品与试剂
桑叶总黄酮:由成都医学院药学院实验中心自行制备,测得样品中总黄酮含量约为55%[9];肌糖原试剂盒(批号:20140530)、考马斯亮蓝试剂盒(批号:20140603)、HK 测定试剂盒(批号:201404028):南京建成生物工程公司;盐酸二甲双胍片(批号:201406):鞍山九天制药有限公司;链脲佐菌素(streptozotocin,STZ):Sigma公司;一抗兔抗大鼠GSK-3β单克隆抗体:Cell signaling公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)内参抗体羊抗兔IgG、辣根过氧化物酶标记的羊抗兔IgG:武汉博士德公司;硝酸纤维膜:Millipore公司;ECL发光试剂:Pierce公司;实验所用其它化学试剂均为分析纯。
1.3 仪器
Forma 905-86℃超低温冰箱、Micro 21高速冷冻离心机、Varioskan Flash酶标仪:美国Thermo公司;CP225D精密分析天平:德国Sartorious公司;DN2000微量紫外可见分光光度计:美国NanoDrop公司;安稳血糖仪及其血糖试纸:长沙三诺生物公司。
1.4 方法
1.4.1 模型的建立
所有大鼠适应性喂养7天后,随机选取10只作为正常对照组,给予普通饲料,其余大鼠喂养高脂饲料,14周后,腹腔注射35 mg/kg·bw STZ,诱导T2DM模型。注射后第3天眼眶后静脉丛采血测空腹血糖,以空腹血糖>11.1 mmol/L作为造模成功标准。注射后继续高脂饲料喂养,2周后再测血糖,空腹血糖仍>11.1 mmol/L证明模型稳定,选入正式实验[10]。
1.4.2 动物分组
将造模成功的60只大鼠随机分为5组,即模型组,二甲双胍组(100 mg/kg·bw),桑叶总黄酮高、中、低剂量组(200、100、50 mg/kg·bw),每组各 12 只,灌胃给药。正常组及模型组按10 mL/kg·bw灌服生理盐水。给药周期为4周。在给药期间,正常对照组给予标准饲料,其余各组大鼠给予高脂饲料。
1.4.3 口服葡萄糖耐量实验
在给药第4周末(第28天),进行一次口服葡萄糖耐量实验(oral glucose tolerance test,OGTT),即大鼠空腹12 h后,用50%葡萄糖溶液2 g/kg灌胃,眼眶后静脉丛采血,检测给糖前即0 h和给糖后0.5、1、2 h的血糖,计算糖耐量曲线下面积(area under concentration curve,AUC),。
式中:G0为给糖前即0 h血糖,mmol/L;G0.5为给糖后0.5 h的血糖,mmol/L;G1为给糖后1 h的血糖,mmol/L;G2为给糖后2 h的血糖,mmol/L。
1.4.4 骨骼肌肌糖原和HK活性的测定
给药4周结束后,处死大鼠,取各组大鼠右后肢骨骼肌组织,用生理盐水漂洗后,滤纸吸干装于冻存管中-80℃冰箱保存。肌糖原测定时,取骨骼肌组织100 mg匀浆,按照试剂盒方法测定620 nm时各组大鼠肌糖原的含量。HK活性测定时,称取200 mg骨骼肌组织,加生理盐水制成10%的匀浆液,离心,取上清液按试剂盒所附方法进行实验。
1.4.5 骨骼肌组织GSK-3β蛋白含量测定
称取30 mg骨骼肌组织(剔除筋膜、脂肪等组织),以组织重量(g)∶裂解液体积(mL)=1∶10的比例加入裂解液,同时加入蛋白酶抑制剂、磷酸酶抑制剂、1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)各3 μL,电动匀浆器以20 000 r/min转速匀浆,上清液测定蛋白浓度,取20 ug煮沸变性5 min。然后经10%SDS-聚丙烯酰胺凝胶(SDS polyacrylamide gel electrophoresis,SDS-PAGE)电泳,电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,在 3%的牛血清白蛋白(albumin from bovine serum,BSA)溶液中4℃振摇封闭30 min,洗膜后加入兔抗大鼠GSK-3β单克隆抗体(1∶1500)4℃振摇过夜,再用辣根过氧化物酶标记二抗室温孵育1 h。洗膜后加ECL发光试剂,在ChemiDoc化学发光凝胶成像检测仪中进行光密度扫描。应用管家基因GAPDH作为蛋白上样量对照,其余组与其相比得到相对量。
2 统计学方法
应用SPSS 13.0统计软件进行统计分析,组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(least-significant difference,LSD),方差不齐采用 Dunnett’s T3法。计量资料用±s表示。以P<0.05为差异有统计学意义。
3 结果与分析
3.1 桑叶总黄酮对T2DM大鼠血糖和AUC值的影响
桑叶总黄酮对T2DM大鼠血糖和AUC值的影响结果见表1。与正常对照组相比,模型组大鼠各时间点的血糖值和AUC值均极显著上升(P均<0.01)。与模型组比较,不同剂量的桑叶总黄酮组的各个时点的血糖值均有所降低,其中以高剂量组降低极显著(P均<0.01)。桑叶总黄酮高、中、低组的AUC值较模型组均极显著降低(P均<0.01)。
表1 桑叶总黄酮对T2DM大鼠血糖和AUC值的影响(±s)Table 1 Effect of total flavonoids of mulberry leaves on blood glucose and AUC of T2DM rats(±s)

表1 桑叶总黄酮对T2DM大鼠血糖和AUC值的影响(±s)Table 1 Effect of total flavonoids of mulberry leaves on blood glucose and AUC of T2DM rats(±s)
注:与正常对照组相比,##P<0.01,极显著;与模型组比较,*P<0.05,显著,**P<0.01,极显著。
3.2 桑叶总黄酮对T2DM大鼠骨骼肌中肌糖原和HK活性的影响
桑叶总黄酮对T2DM大鼠骨骼肌中肌糖原和HK活性的影响结果见表2。
表2 桑叶总黄酮对T2DM大鼠骨骼肌肌糖原和HK活性的影响(±s)Table 2 Effect of total flavonoids of mulberry leaves on muscle glycogen and the activity of hexokinase in the skeletal muscle of T2DM rats(±s)

表2 桑叶总黄酮对T2DM大鼠骨骼肌肌糖原和HK活性的影响(±s)Table 2 Effect of total flavonoids of mulberry leaves on muscle glycogen and the activity of hexokinase in the skeletal muscle of T2DM rats(±s)
注:与正常对照组相比,##P<0.01,极显著;与模型组比较,*P<0.05,显著,**P<0.01,极显著。
经桑叶总黄酮干预治疗后,高剂量组肌糖原的含量较模型组明显增加(P<0.05),而高、中剂量组骨骼肌中HK的活性较模型组极显著增加(P均<0.01)。
3.3 桑叶总黄酮对T2DM大鼠骨骼肌中GSK-3β蛋白表达的影响
桑叶总黄酮对T2DM大鼠骨骼肌中GSK-3β蛋白表达的影响结果见图1,表3。

图1 桑叶总黄酮对T2DM大鼠骨骼肌中GSK-3β蛋白表达的影响Fig.1 Effect of total flavonoids of mulberry leaves on the expression of GSK-3β protein in the skeletal muscle
与正常对照组相比,模型组大鼠骨骼肌中GSK-3β蛋白表达极显著升高(P<0.01)。经桑叶总黄酮干预治疗后,高、中剂量组的GSK-3β蛋白表达较模型组显著降低(P<0.01,P<0.05)。
表3 桑叶总黄酮对T2DM大鼠骨骼肌中GSK-3β蛋白表达的影响(±s)Table 3 Effect of total flavonoids of mulberry leaves on the expression of GSK-3β protein in the skeletal muscle of T2DM rats(±s)
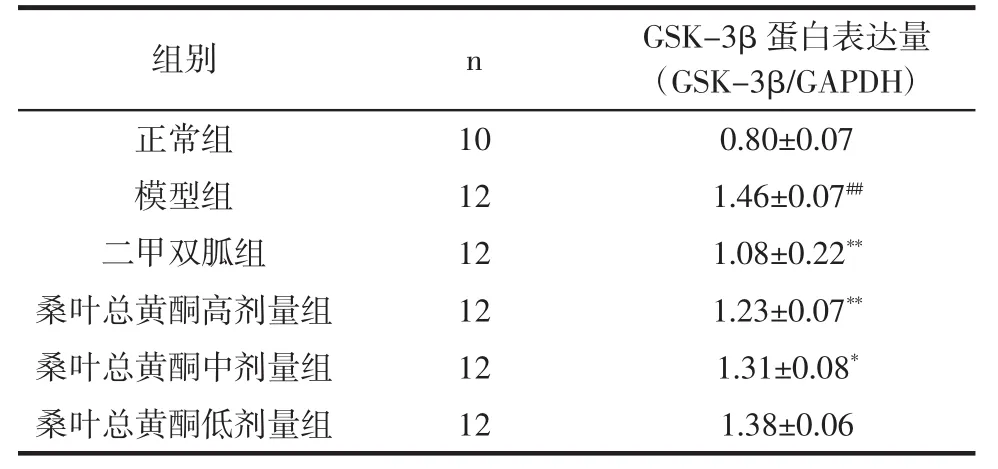
表3 桑叶总黄酮对T2DM大鼠骨骼肌中GSK-3β蛋白表达的影响(±s)Table 3 Effect of total flavonoids of mulberry leaves on the expression of GSK-3β protein in the skeletal muscle of T2DM rats(±s)
注:与正常对照组相比,##P<0.01,极显著;与模型组比较,*P<0.05,显著,**P<0.01,极显著。
4 讨论
目前有关研究显示,餐后,胰岛素介导的葡萄糖摄取的主要部位是在骨骼肌,85%的葡萄糖被骨骼肌利用,因此,骨骼肌在维持葡萄糖的代谢系统起着至关重要的作用[12]。T2DM患者体内存在的IR,进而导致骨骼肌中的葡萄糖稳态受损[13]。我们的研究显示,与模型组相比,桑叶总黄酮高剂量组对T2DM大鼠各个时点的血糖值均有所降低,较低的0.5 h血糖值说明桑叶总黄酮可以缓减血糖值的升高,较低的1 h血糖值说明桑叶总黄酮可以降低血糖峰值,较低的2 h血糖值说明桑叶总黄酮可以降低餐后2 h血糖值。总的来说,桑叶总黄酮可以改善T2DM大鼠的血糖升高,维持血糖的正常代谢。
在骨骼肌细胞中,葡萄糖在HK的作用下磷酸化为葡萄糖-6-磷酸(G-6-P),G-6-P在磷酸葡萄糖变位酶的作用下转变成1-磷酸葡萄糖,而后生成尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG),UDPG在糖原合酶GYS1的作用下生成肌糖原。T2DM患者骨骼肌中的糖原含量明显低于正常人群。目前研究表明,某些药物可通过增加糖尿病大鼠骨骼肌中HK活性促进肌糖原的合成贮存,减少血液中游离的葡萄糖,促使T2DM大鼠血糖降低[14-15]。我们的研究显示,桑叶总黄酮能增加T2DM大鼠骨骼肌中的HK活性,增加肌糖原含量,提示桑叶总黄酮降低血糖的机制可能与增加骨骼肌中糖的利用和贮存有关。
GSK-3是糖原合成的限速酶之一,调控细胞的葡萄糖转运及糖原合成。在胰岛素抵抗和T2DM患者骨骼肌中,过度表达的GSK-3可能导致胰岛素受体底物-1(insulin receptor substrate 1,IRS-1)磷酸化,减弱IRS-1信号的传导,从而导致骨骼肌细胞膜上的葡萄糖转运体-4(glucose transporters 4,GLUT-4)转位减少,葡萄糖转运减少。因此,使用一些高选择性抑制剂GSK-3可增加骨骼肌中葡萄糖的转运从而提高胰岛素的活性[16]。GSK-3β是GSK-3的亚型之一,在调节骨骼肌糖原合酶活性、肌糖原合成中起着关键作用[17]。有研究发现,糖原合酶 1(glycogen synthase 1,GYS1)的活性是被GSK-3β调节的,若GSK-3β被磷酸化,则GYS1失活[18]。在骨骼肌GSK-3β基因特异性敲除的动物模型中,糖耐量升高,空腹及餐后肌糖原含量显著升高,胰岛素敏感性降低[19-20]。因此,合适的GSK-3β抑制剂会在T2DM治疗中发挥很大的作用[21]。我们的研究显示,经桑叶总黄酮干预治疗后,大鼠骨骼肌中GSK-3β蛋白表达较模型组显著降低。说明桑叶总黄酮可能通过抑制骨骼肌中GSK-3β蛋白表达而治疗T2DM。
综上所述,我们的实验显示桑叶总黄酮可以增加T2DM大鼠骨骼肌HK的活性,降低GSK-3β蛋白的表达,从而增加大鼠骨骼肌中肌糖原含量而降低血糖。桑叶总黄酮作为一种天然产物,在改善T2DM患者血糖升高,维持血糖的正常代谢方面具有一定的应用开发潜力。
