苏云金芽孢杆菌发酵上清液抑菌谱及稳定性
2018-09-20贾淑颖郝再彬陈圣怡韩兵兵
贾淑颖, 郝再彬, 陈圣怡, 韩兵兵, 李 霞
(桂林理工大学 化学与生物工程学院,广西 桂林 541004)
苏云金芽孢杆菌 (Bacillus thuringiensis,简称Bt)是一种天然革兰氏阳性昆虫病原细菌,生长代谢过程中产生的晶体蛋白对多种害虫有特异毒杀作用,是目前最广泛的微生物杀虫剂[1]。Bt的抗菌防病机制是通过产生抗菌物质抑制病原生长或直接杀灭病原。Bt产生的拮抗物质主要有抗生素、细胞壁降解酶类、细菌素和其它抗菌蛋白及挥发性抗菌物质等,其中抗生素包括多肽抗生素、脂肽抗生素和次生代谢产生的其它抗菌活性物质等。近几年,国内研究多数是在杀虫方面,Bt以色列亚种开发的灭蚊制剂、防治储粮害虫的Bt杀虫剂已投放市场[2],对仓储烟草害虫、松材线虫病的研究也在进行[7-8]。也有研究表明,该抑菌物质对苹果轮纹菌(Dothiorella gregaria)、苹果褐斑病菌(Marssonin mali)、尖孢镰刀菌 (Fusarium oxysporum)、白菜黑斑菌(Alternaria brassicae)等植物病害微生物有明显的抑菌作用[3]。
作者选取Bt185和HD-1菌株对它们的发酵液抑菌谱和稳定性进行研究,为发酵液的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 苏云金芽孢杆菌(Bacillus thuringiensis)Bt185、HD-1 以 及 草 生 欧 文 氏 杆 菌LS005(Erwinia herbicol)供试菌:由中国农业科学院植物保护研究所提供;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌 (Bacillus subtilis)、蜡状芽孢杆菌(Bacillus cereus)、普通变形球菌(Proteus vulgaris Hauser)、谷氨酸棒状杆菌(Corynebacterium glutamicum)、乙型副伤寒杆菌 (Bacillus paratyphosus B)、绿脓杆菌(Bacillus aeruginosus):由桂林医学院提供。
1.1.2 试剂 石油醚、正丁醇、三氯甲烷、四氯化碳、乙酸乙酯、异戊醇、葡萄糖、NaCl、MnSO4·H2O、K2HPO4、MgSO4等试剂:均为分析纯;蛋白胨、酵母粉:英国OXOID公司;琼脂:北京索莱宝科技有限公司;牛肉膏:上海蓝季生物。
1.1.3 主要设备 RE-52A I型旋转蒸发仪:上海亚荣生化仪器厂;KQ-400型高功率数控声波清洗机:昆山市超声仪器有限公司;CL-5-B离心机:上海安亭科学仪器厂;LRH-150-Z振荡培养箱:珠江医疗器械。
1.1.4 培养基 1/2 LB固体培养基 (g/L):蛋白胨5,酵母粉2.5,氯化钠 5,琼脂粉15。发酵培养基(g/L):葡萄糖 20,蛋白胨 20,无水氯化钙 0.8,K2HPO41.3,MgSO40.2,MnSO4·H2O 0.8。调节 pH 至 7.0~7.2,封口灭菌备用。
抑菌培养基(g/L):牛肉膏3、蛋白胨10、氯化钠5、琼脂 15。
1.2 方法
1.2.1 发酵液预处理 将甘油管保存的Bt185、HD-1菌株分别接入灭好菌的1/2 LB液体培养基中(约 10 μL),30 ℃下培养 8~12 h(OD600>0.8),为种子液。
将上述种子液分别按体积分数5%接入灭好菌的发酵培养基中,30℃振荡发酵48~50 h。
发酵液4 500 r/min离心15 min,取上清液,浓缩10倍。
1.2.2 抗菌谱 采用牛津杯法测定发酵液对供试菌的抑菌活性。将供试菌种子液按5%的接种体积分数加入抑菌培养基中,将处理后的发酵液150 μL加入到牛津杯孔中,按供试菌的适宜温度放入相应温度的培养箱中培养12 h,测量抑菌圈直径。牛津杯:内径(6±0.1)mm、外径(8±0.1)mm、高(10±0.1)mm的圆筒形小管。
1.2.3 发酵液稳定性测定
1)发酵液热处理:取适量处理后的发酵液分成10等分,分别在4℃冰箱、室温约20℃(对照)、30、40、50、60、70、80、90、100 ℃温度梯度下恒温 2 h,分别测定抑菌圈(草生欧文氏杆菌)大小。
2)发酵液酸碱处理:取适量处理后的发酵液分成 9 等分,分别调 pH 3、4、5、6、自然 pH 约为 7(对照)、8、9、10、11,2 h 后调回自然 pH,分别测定抑菌圈(草生欧文氏杆菌)大小。
3)发酵液超声处理:取适量处理后的发酵液分成10等分,在温度40℃,功率360 W超声条件下,分别超声 0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 h,分别测定抑菌圈(草生欧文氏杆菌)大小。
4)发酵液紫外处理:取适量处理后的发酵液分成 10 等分,放在 20 W 紫外灯下 15、30、45、60、75、90、105、120、135、150 min,分别测定抑菌圈(草生欧文氏杆菌)大小。
1.2.4 有机试剂萃取 将发酵液浓缩液分成6等分(对照为原液),分别加入等量的萃取剂,反复振荡混合,于4℃冰箱静置分层或离心分层,分别测定水相、有机相、原有机试剂及原液的抑菌圈大小。以草生欧文氏杆菌为供试菌。
选用的萃取剂(极性大小顺序):异戊醇>三氯甲烷>乙酸乙酯>正丁醇>四氯化碳>石油醚。
2 结果与分析
2.1 抗菌谱的测定
通过比较发酵上清液对9种供试菌抑菌性发现,草生欧文氏杆菌抑菌最明显,其次是普通变形球菌、金黄色葡萄球菌和大肠杆菌,对比发酵液稳定性时,采用草生欧文氏杆菌,见表1。
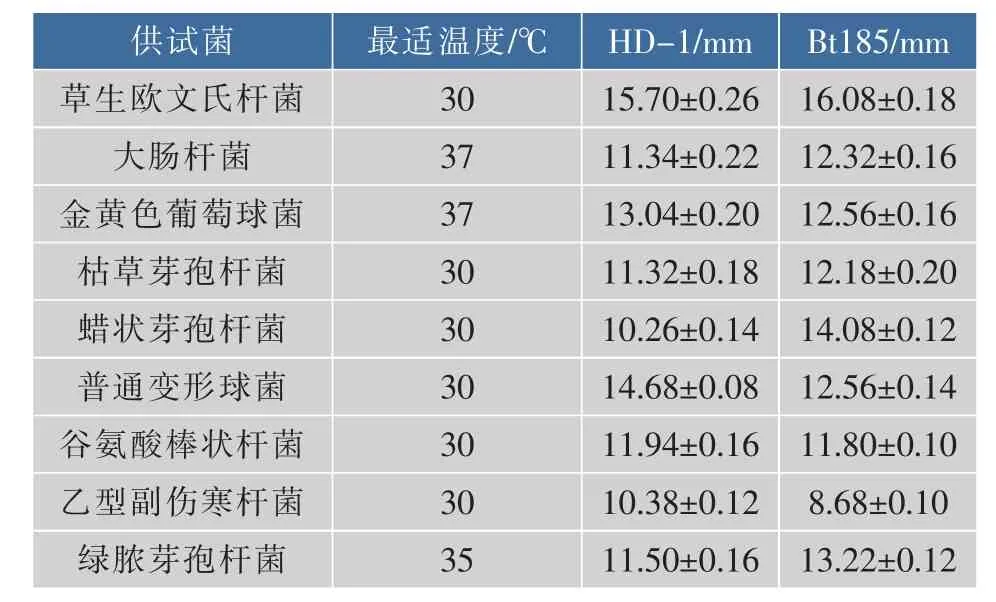
表1 供试菌的最适温度及发酵上清液对9种指示菌抑菌圈直径测定Table 1 Optimal temperature for test bacteria and the diameter of inhibition zone of 9 kinds of indicator bacteria concentration of fermentation broth
2.2 不同浓度发酵上清液的抑菌效果
由表2可看出:发酵液的浓度越高,抑菌能力越强。
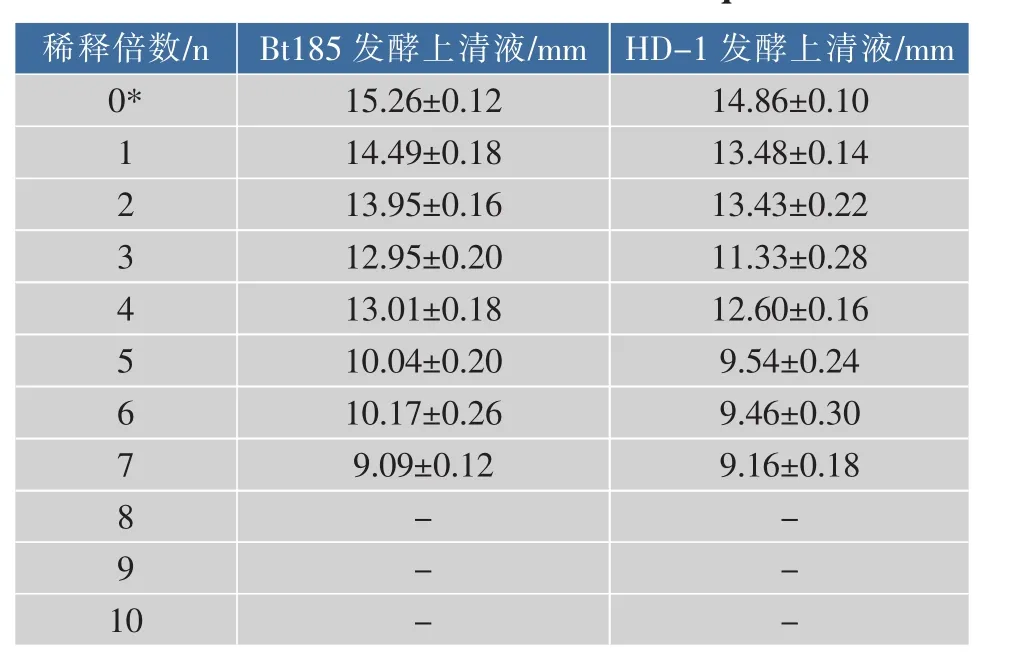
表2 不同浓度发酵液的抑菌圈直径Table 2 Diameter of inhibition zone ofdifferent concentration of fermentation liquid
2.3 发酵上清液稳定性
2.3.1 温度对发酵上清液稳定性的影响 由图1可知,Bt185和HD-1发酵上清液均具有较高的热稳定性,50℃以上,抑菌圈明显变小,即抑菌物质逐渐失活,80℃以上,几乎没有抑菌。以上实验结果说明,Bt185和HD-1发酵上清液在低于50℃时,热稳定性较好。

图1 发酵液温度稳定性Fig.1 Fermentation liquid temperature stability
2.3.2 pH对发酵上清液稳定性的影响 由图2可见,在酸性环境中,发酵上清液的抑菌活性较稳定;在碱性环境中,抑菌活性有明显下降,当发酵上清液pH=10时,几乎没有抑菌活性,将发酵上清液调回pH<9时,抑菌物质失活,没有抑菌性。由此可以得出在发酵上清液处理时,应该保持在pH 3~9的条件。

图2 发酵液酸碱稳定性Fig.2 Fermentation liquid acid-base stability
2.3.3 超声作用对发酵上清液的影响 由图3可见,在超声波不断刺激的条件下,Bt185菌株和HD-1菌株发酵上清液的抑菌活性下降,说明Bt185和HD-1发酵上清液在超声波的条件下稳定性较差,在连续超声3.5 h后,发酵上清液对草生欧文氏杆菌几乎没有抑制性。

图3 发酵液超声稳定性Fig.3 Fermentation liquid ultrasonic stability
2.3.4 紫外光照对发酵上清液稳定性的影响 由图4可见,Bt185和HD-1发酵上清液对紫外光具有较好的稳定性,经过紫外光连续照射150 min,发酵上清液仍有较高的抑菌活性。

图4 发酵液紫外光照射稳定性Fig.4 Fermentation liquid UV irradiation stability
2.4 有机试剂萃取
由表3可看出,Bt185发酵上清原液石油醚、正丁醇、乙酸乙酯、三氯甲烷的萃余相的抑制圈直径明显比萃取相都大,与原液相比就不是很明显。原液的抑菌圈直径比四氯化碳和异戊醇萃取相及萃余相都明显大。因此可得知Bt185发酵液的大多数抑菌活性物质为弱极性物质。

表3 发酵上清液萃取后各相的抑菌圈直径Table 3 Inhibition zone diameter of each phase after extraction of fermentation broth mm
HD-1发酵液原液的抑菌性明显比萃取相和萃余相的抑菌性大,其中石油醚、四氯化碳、正丁醇、三氯甲烷和异戊醇的萃余相的抑制圈直径比萃取相都大,而乙酸乙酯的萃取相的抑制圈明显比萃余相大。因此可得知HD-1发酵液的大多数抑菌活性物质为极性物质。
3 结语
通过本研究发现,Bt185、HD-1菌株发酵上清液抑菌活性均具有进一步研究开发的价值。发酵上清液对种供试细菌均有不同程度的抑制作用,对草生欧文氏杆菌的抑制作用最强。为了得到高浓度的抑菌活性物质,应该浓缩更高的倍数,然后进一步纯化得到纯品。
Bt185、HD-1菌株发酵液稳定性研究表明,避免高温处理;适宜的pH范围较广但不耐碱;连续超声的条件下,时间要控制在2 h内,抑菌物质才不易被破坏;紫外照射条件下影响不大,活性成分较为稳定。Bt185菌株发酵液的抑菌性物质为弱极性物质,可以随着萃取试剂萃取出来,而HD-1菌株发酵液的抑菌性物质为极性物质,不易萃取,下一步需验证不同菌株产生的抑菌物质是否为同一种结构。Bt185菌株的各项稳定性都要优于HD-1菌株,工业化生产中有一定的优势。
