胁迫温度下两株高致病性副溶血弧菌的生长差异比较分析
2018-09-20马冯莉张昭寰吴佳敏孙晓红潘迎捷
马冯莉 , 张昭寰 , 吴佳敏 , 孙晓红 ,2,3, 潘迎捷 ,2,3, 赵 勇 *,2,3
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
南美白对虾是南亚和东南亚地区最为重要的水产品,常因其汁鲜肉嫩、营养丰富、价格适中,成为消费者的水产品首选,其销售量占到全球虾产量的90%以上,与中国对虾、斑节对虾并列,被称为世界三大经济对虾之一[1]。然而,南美白对虾却携带很多致病菌,其中,副溶血性弧菌(Vibrio parahemolyticus,简称VP)被认为是首要致病菌,常引起伤口感染、败血症、腹泻、头痛和急性肠胃炎等疾病,在实际生活中,常常会因为不正当的加工操作、运输、消费等引起副溶血性弧菌在即食虾上滋长[2],这极大地危害了虾的质量和公共健康,因此控制对虾中的副溶血性弧菌对食用安全对虾具有重大意义。VP的主要致病因子为溶血毒素,目前发现的主要有耐热性溶血毒素(TDH);耐热性溶血毒素相关的溶血毒素(TRH)和不耐热溶血毒素(TLH)。而TDH是一种能消化血细胞细胞壁的酶,能在血琼脂培养基上产生一种β-型溶血环,被称为神奈川现象,呈现神奈川阳性 (Kanagawa phenmomenon positive,KP+),而无毒性的菌株则呈现神奈川阴性,流行病学调查研究也同样表明副溶血性弧菌的致病力与TDH有很高的相关性。因此,TDH被认为是该致病菌的主要毒力因子[3],研究携带有tdh致病基因的副溶血性弧菌的生长特性在风险评估具有重大意义。
预测微生物学最初由食品预测微生物学发展而来,主要是运用微生物学、工程数学以及统计学建立数学模型,利用所建立的模型,结合计算机以及配套软件预测以及描述微生物在不同环境条件下的生长、死亡情况,这些环境条件主要包括温度、培养基质、水分活度、pH值以及气体环境等等[4]。预测微生物学的主要目的是在不进行微生物检测的条件下快速预测产品货架期和安全性,其核心在于建立完善的数学模型。风险评估是食品安全控制的有效手段,而预测模型是进行精准评估的工具,目前,基于副溶血性弧菌的风险评估研究多集中于单一菌株在不同环境条件上建立的模型[5-6],很少有文献探讨研究关于不同来源的高致病性副溶血性弧菌的生长及其生长动力学参数是否存在差异。而作为水产品中最常见的一种致病性微生物,建立其完善的预测模型对于保障水产品质量、预测水产品货架期具有市场意义。世界卫生组织和联合国粮农组织在2011年发布了副溶血性弧菌在水产品中的风险评估报告,其中提到不同菌株的生长特性具有差异,即基于不同菌株建立的预测模型与风险评估的不确定性存在直接相关性,所以,建模时应当考虑菌株异质性[7]。
为了探讨胁迫温度下高致病性副溶血性弧菌的生长动力学参数差异,作者选用两株相同致病性菌株ATCC 33847和F 18,建立4~30℃温度条件下的生长模型和失活模型,运用多重数学评价指标确定最为适合副溶血性弧菌在南美白对虾上的生长模型,在获得模型参数基础上进一步分析高致病性副溶血性弧菌在即食虾上的生长特性,比较其生长动力学参数,为食品安全风险评估提供数据支撑。
1 材料与方法
1.1 实验仪器与材料
高精度恒温培养箱:日本Sanyan公司;BagMixer 400 VW型拍打式均质器:法国Interscience公司;离心机:德国 Eppendorf公司;ATCC 33847(tlh+/tdh+/trh-)、F 18(tlh+/tdh+/trh-):中国科学院微生物研究所购买,菌株储存于-80℃冰箱内,甘油保存;TCBS培养基、TSA培养基、胰蛋白胨大豆肉汤(TSB)培养基:北京陆桥技术有限责任公司。
1.2 无菌虾样的制备
南美白对虾购于上海农贸市场,置于均质袋中,贮藏于-80℃下。实验前将南美白对虾于4℃下解冻12 h,将解冻后的虾样品放入2.5 g/dL NaCl溶液中,煮沸20 min,置于生物安全柜中冷却,挑选质量为10 g左右的虾样本用于后续实验。另选取10只灭菌虾样,均质涂布于TSA培养基上,过夜培养,未发现有菌落生长,以证明虾样已去除本底微生物。
1.3 菌株悬浮液制备与接种
在净化工作台中分别取两种副溶血性弧菌各1 mL 接种于 9 mL TSB(3 g/dL NaCl)中,37 ℃下摇床培养10~12 h,然后再各取100 μL活化菌液分别接种至 9 mL TSB(3 g/dL NaCl)中,37 ℃下摇床培养10~12 h。 将培养完成的菌液离心 10 min(3 000 g,15℃),去上清液,用PBS缓冲溶液调节吸光度,对于培养温度分别为15、20、25、30℃的初始接种量采用3.6 lg cfu/g;培养温度为4、7、10℃的初始接种量采用大约在 5.0 lg cfu/mL,吸取6 mL菌液加到500 mL 3 g/dL NaCl溶液中制备菌株悬浮液,摇匀。
在生物安全柜中将挑选出的南美白对虾样本放入上述菌株悬浮液中,振荡40 min,使南美白对虾与悬浮液充分接触,进行接菌。接菌完成后,将虾样本放置在 4、7、10、15、20、25、30 ℃下进行恒温贮藏。
1.4 微生物计数
在无菌条件下,将接菌后的虾样放入含有0.85 g/dL灭菌生理盐水100 mL的无菌BagFilter均质袋中拍打3 min,用0.85 g/dL灭菌生理盐水进行梯度稀释,选用合适的稀释度,取100 μL的稀释液在TCBS琼脂板上进行涂布,将平板在37℃条件下培养24 h计算菌落数。每个取样点做两个平行,每个稀释梯度重复2次。
1.5 生长数据的拟合
1.5.1 一级模型拟合 在 10、15、20、25、30℃条件下,不同来源的副溶血性弧菌在即食南美白对虾上的生长数据用修正Gompertz模型[8,10](式1)、Baranyi模型[11](式 2)、Logistic 模型[11](式 3)拟合。 模型表达式如下:
1)修正Gompertz模型:

其中,N0:最初的细菌总数量,lg cfu/mL;Nt:时间为 t时的细菌总数量,lg cfu/mL;A:最大菌种量与初始菌种量之差,lg cfu/mL;λ:延滞期,h;μ:最大增长速率,lg(cfu/mL)/h。
2)修正 Baranyi模型:
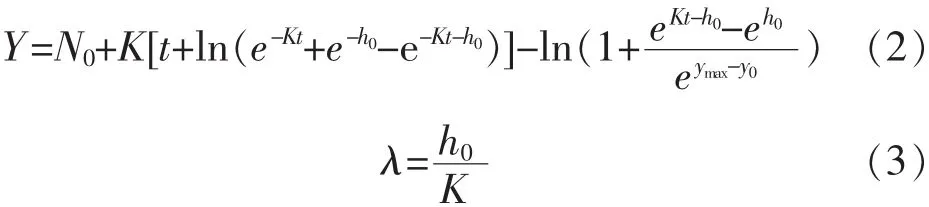
其中,N0:最初的细菌总数量,lg cfu/mL;Y:时间为 t时的细菌总数量,lg cfu/mL;h0:使模型拟合更加稳定的初始细菌量的转换值。
3)修正Logistic模型:
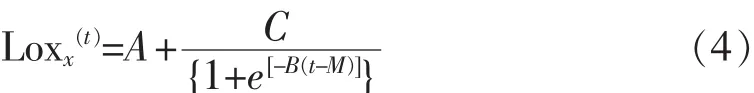
其中,x (t): 时间为 t时的细胞数量,lg cfu/mL;A:时间t降到0的渐近线数值;C:向上和向下渐近线所能得到的差值;M:绝对生长率最大的时间,h;B:当 t=M 时的相对生长率,lg(cfu/mL)/h。
1.5.2 失活模型 在4、7℃条件下,不同来源的副溶血性弧菌在即食南美白对虾上的失活情况用Log-linear模型[10](式 5)、Weibull模型[11](式 6)和Baranyi模型(式2)进行拟合。模型表达式如下:
1)Log-linear模型:

2)Weibull模型:

其中,N0:最初的细菌总数量,lg cfu/mL;Nt:时间为 t时的细菌总数量,lg cfu/mL;D:表示弧菌降低一个对数级所需要的时间,h;t:表示低温处理时间,h;n、b:曲线形状因子。
1.5.3 二级模型
1) Modified Ratkowsky(μmax-T) 模型
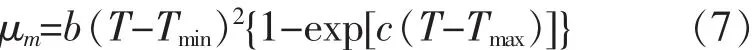
2) Non-linear Arrhenius(λ-T) 模型

其中,Tmin和Tmax分别是细菌生长/死亡的最小/最大温度理论值,℃;A,B,C,b 和 c:线性方程回归系数。
1.5.4 模型评价
1)相关系数R2

R2的值在0~1之间,且越靠近1即表明预测模型的参考价值越高[9]。
2)均方根误差RMSE[10]

均方根误差RMSE是说明模型预测值的离散程度的一种数值指标。
3)准确因子(Accuracy factor,Af)和偏差因子(bias factor,Bf)

Af=1说明预测值与实验观测值是相等的,Af值越大表明预测模型与观测值的平均精准度偏低;Bf主要用于判断预测模型的偏差度,Bf=1,说明所选用模型的拟合结果与实验观测值相同,所选用模型的拟合效果较好[10]。式9-12中,μobs代表实验观测值,μpred代表模型预测值,n代表观测值个数。
2 结果与分析
2.1 不同温度下副溶血性弧菌的生长差异分析
如图1所示,ATCC 33847和F 18在 20~30℃条件下属于生长状态,副溶血性弧菌的数量随着培养时间延长而增长,两株菌的生长类似,但在4~15℃,两株菌的生长呈现明显差异。从20℃到30℃,ATCC 33847和 F 18的最大生长量(Nmax)均为9 lg cfu/mL以上,两者的生长速率没有明显差异。高温条件下研究高致病性VP时,温度对其生长特性的影响比其他因素要大,所以VP的生长特性相似。
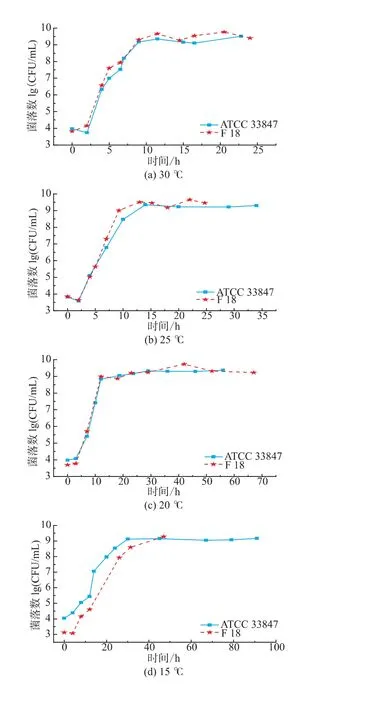
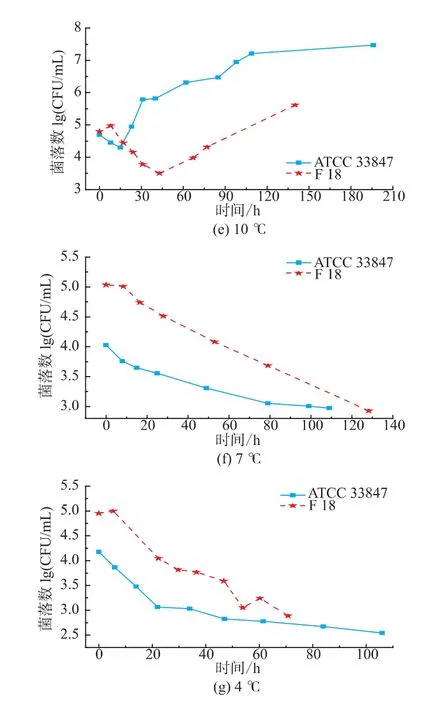
图1 ATCC 33847和F 18在4~30℃下的生长曲线Fig.1 Growth curves of ATCC 33847 and F 18 at 4~30 ℃
在15℃时,F 18的生长比ATCC 33847的缓慢,两株菌初现生长差异。在10℃条件下,ATCC 33847和F 18在即食南美白对虾上的生长特性呈现了明显的差异,ATCC 33847一直处于缓慢的生长期,Nmax约为7.4 lg cfu/mL,而F 18在前40小时处于死亡状态,菌落数随着时间的延长不断减少,但是在40 h之后,菌落数随着时间的延长而增长,在培养时间达到140 h时,菌落数大约为5.5 lg cfu/mL,超过了初始接种量4.75 lg cfu/mL,这表明,F 18在10℃时呈现了较明显的异质性,其原因有待于进一步研究。在4~7℃条件下,副溶血性弧菌的菌落数量都在逐步减少。在7℃时,ATCC 33847和F 18最少生长量(Nmin)均降到2.9 lg cfu/mL左右,但是在培养期间,两者的生长特性具有一定的差异。F 18的数量随着培养时间延长,呈现缓慢减少的趋势,但是ATCC 33847的数量下降比较快,且在培养前期(0~10 h),F 18的菌落数量基本保持不变,而ATCC 33847则下降了0.5 lg cfu/mL。在4℃,高致病性VP的生长特性相差较大,F 18菌落数减少速度在20~45 h时比较小,且随着培养时间延长,菌落数存在一个反复现象,而ATCC 33847则一直处于减少状态,在0~20 h期间菌落数急剧下降,之后呈现缓慢减少状态。
由本研究的生长特性可知,副溶血性弧菌在4~15℃条件下的生长存在较大的异质性,这表明与高温条件相比,胁迫温度下两株高致病性VP的生长特性受温度影响比较小,其他因素对其影响比温度大,如菌株来源不同,部分菌株会呈现较大的异质性。
2.2 不同温度条件下两株致病性副溶血性弧菌的一级模型比较
为了探讨高致病性VP在不同温度条件下的生长差异,采用修正Gompertz模型、修正Logistic模型和Baranyi模型三个一级模型来拟合两株致病性VP在10~30℃下的生长数据,使用Weibull模型、Baranyi模型和Log-linear模型三个一级模型来拟合两株致病性VP在4~7℃下的死亡数据,并得到了相关参数,结果见表1。
从25~30℃,ATCC 33847和F 18在即食南美白对虾上的生长数据均可以用所采用的三个模型进行拟合,且拟合效果良好,修正决定系数R2adj均在0.924以上。F 18在15℃和20℃条件下的生长数据无法用Logistic模型进行拟合,R2为0.800和0.223,而ATCC 33847在该温度的拟合效果良好。而且,在10℃条件下,所选用的三个模型均无法拟合F 18的生长数据,但是ATCC 33847的拟合效果良好。同样,Baranyi模型对ATCC 33847在4℃时的生长数据拟合效果较好,但是对F 18的拟合效果较差,R2分别为0.935和0.390。
在模型拟合中,参数RMSE的值越大表明模型的预测值的离散程度越大,Af值越大表明预测模型与观测值的平均精准度偏低。同样,Bf值偏离1越远,表明拟合结果与实验观测值相差越远,表明所选模型不佳。所以,综合表1中的拟合参数,通过比较 R2adj、RMSE、Af和 Bf值, 选择修正 Gompertz模型作为最适模型来拟合两株致病性副溶血性弧菌ATCC 33847和F 18在15~30℃条件下的生长数据以及10℃下ATCC 33847的生长数据,选用Baranyi模型来描述7℃条件下两株菌以及4℃条件下ATCC 33847的生长数据,但是F 18在10℃和4℃条件下的生长模型有待于进一步研究。在15~30℃时,唐等[12]考虑到初始菌量的拟合正确性,选择Baranyi模型为不同基因型VP在12℃和35℃时的最适模型,但也指出Modified Logistic和Gompertz的拟合度高于Baranyi模型。在本研究中,综合比较Modified Gompertz和Baranyi模型的拟合参数,作者选择Modified Gompertz为最适模型用来描述VP在15~30℃的生长行为,这表明预测模型在选择时具有一定的综合性。这两株致病菌生长数据的拟合效果同样表明,高温条件下,高致病性VP的生长异质性较小;而胁迫温度下高致病性VP的异质性较大,在最适模型的选择上存在一定的差异。即在研究致病性VP时不能笼统的选择模型,需要经过一定的比较、分析以及对模型进行一定的修正。
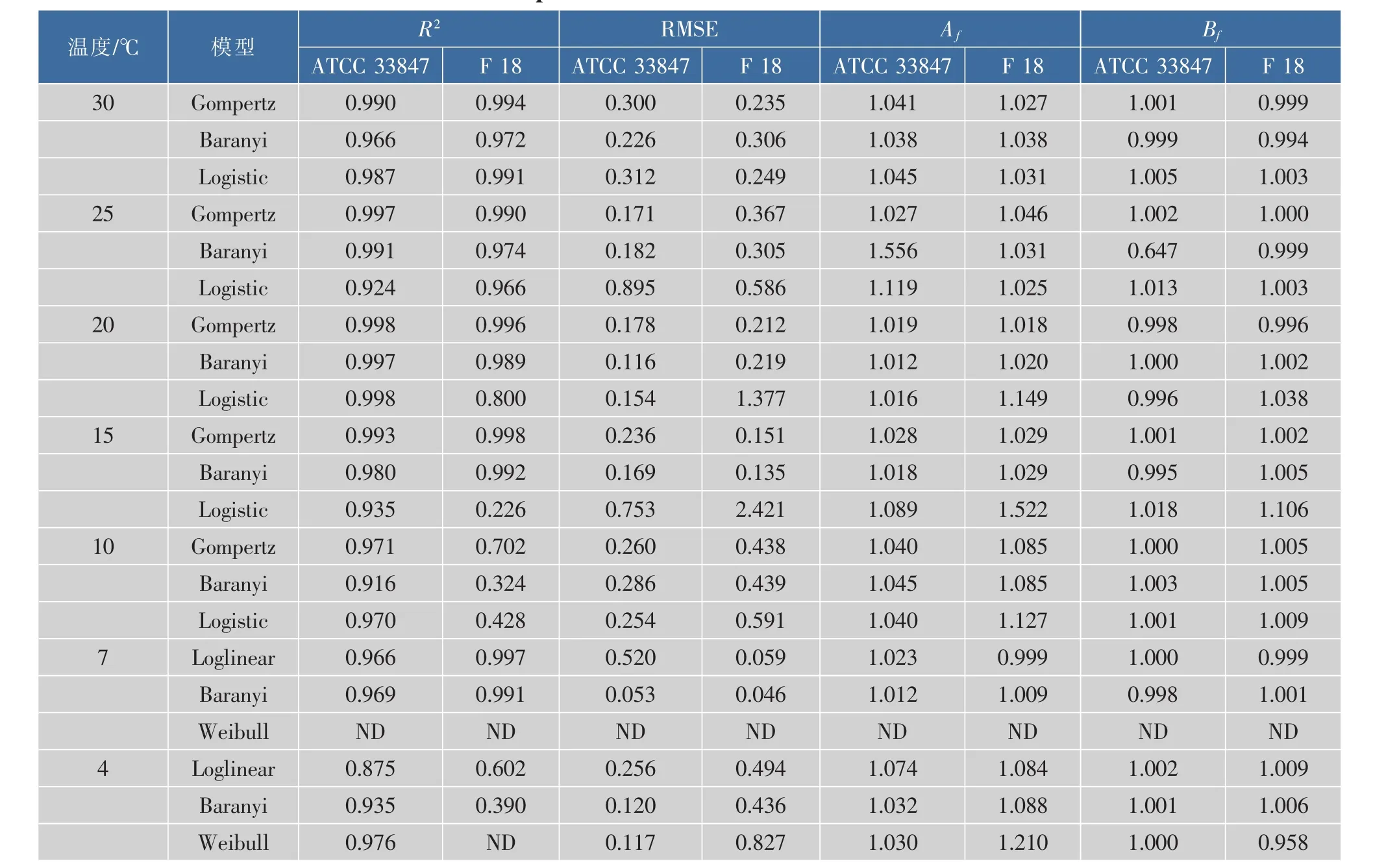
表1 ATCC 33847和F 18在4~30℃条件下的动力学生长参数Table 1 Growth parameters of ATCC 33847and F 18 at 4~30 ℃
2.3 不同温度条件下两株致病性副溶血性弧菌的二级模型建立及其与同类研究做比较
基于最适模型拟合得到动力学参数最大比生长速率(μmax)和延滞期(LT),根据公式 7-8 建立二级模型见图2。随着温度的升高,最大比生长速率(μmax)逐渐变大,延滞期(LT)逐渐减小。从 15 ℃升至30℃过程中,F 18的μmax始终大于ATCC 33847,两者的差值随着温度的升高而变大,在15℃时约为0.16 lg ((cfu/mL)/h),30 ℃时约为 0.7 lg((cfu/mL)/h);F 18的LT始终小于ACTT 33847,两者的差值随着温度的升高而减小,在15℃时约为7.3 h,最小差值约为2.4 h,见表2。这表明,在生长过程中,不同温度条件下,相同致病性VP的μmax以及LT存在一定的差异。

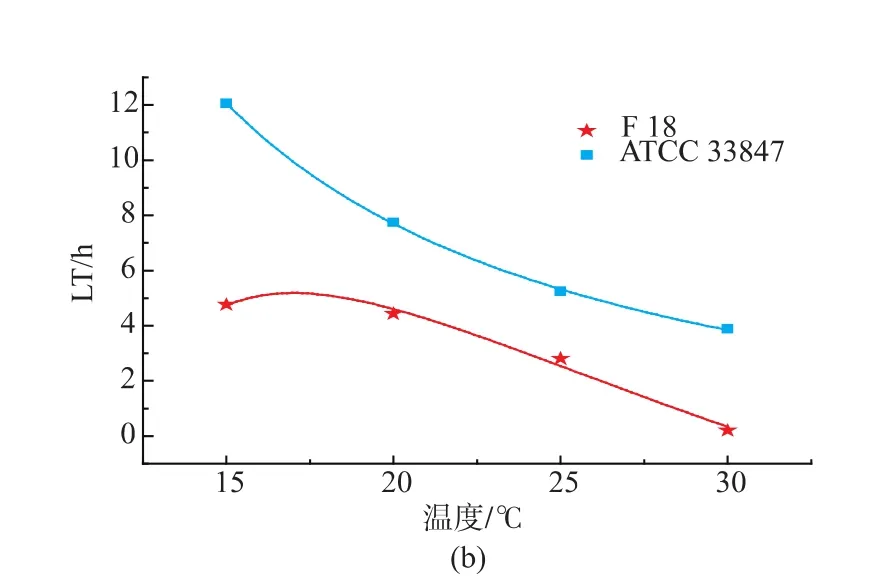
图2 ATCC 33847和F 18的最大比生长速率(μmax)和延滞期(LT)的二级模型Fig.2 Secondary model for the effect of temperature(℃)on the specific maximum growth rate (μmax) and lagtime(LT) of ATCC 33847 and F 18
将本研究中的副溶血性弧菌在10~30℃的最大比生长速率与同类文献建立二级模型作比较,参考文献见表3,结果见图3。可以看出,虽然携带相同的tdh致病基因,但是相较于其他三个菌株,只有ATCC 33847的生长数据可以在10℃被模型较好的拟合得到μmax值,其他三个菌株的生长数据均无法被拟合;在20~30℃,VPD43的μmax值始终保持最大,依次为 F 18,O3:K6,最小的为 ATCC 33847,而且差值随着温度的升高而变大,这表明VPD43在南美白对虾上的生长最快,而ATCC 33847最慢,即相同基因型的VP在相同基质上的生长速率存在显著性差异(P<0.05)。可能有很多原因引起这一现象,Sant等[13]在2012年研究沙门氏菌和单增李斯特菌在即食生菜上的生长表明,菌株之间的差异会引起生长差异。同样,Carlin等[14]在2013年研究芽孢杆菌7大亲缘菌体的生长时也发现了相同菌株存在生长差异。所以携带有相同致病基因的菌株在生长上存在异质性。
在VP微生物风险评估研究中建立预测微生物模型时,因选用的菌株来源不同,会使得VP的生长呈现较大的生长差异;不同研究中所选用的一级模型,同样会对最大生长量、初始接菌量、生长速率等参数造成一定的偏差。通过本研究可以看出,高温条件下,相同高致病性VP在即食虾上的生长特性具有相似性,但是生长参数存在差异(P<0.05);在胁迫温度下,相同致病性VP存在较大的生长特性差异,其生长参数存在显著性差异(P<0.05)。因此,在研究致病性VP的机理以及进行风险评估时,需要考虑菌株异质性所导致的影响,某一菌株所建立的模型应用于另一菌株时,需要进行修正或者直接建立新的模型,以便更准确的预测菌株生长的风险性。

表2 副溶血性弧菌在不同温度下的 μmax(lg(cfu/mL)/h)和 LT(h)值Table 2 μmax(Log10(cfu/mL)/h)and LT(h) values of Vibrio parahaemolyticus at different temperatures
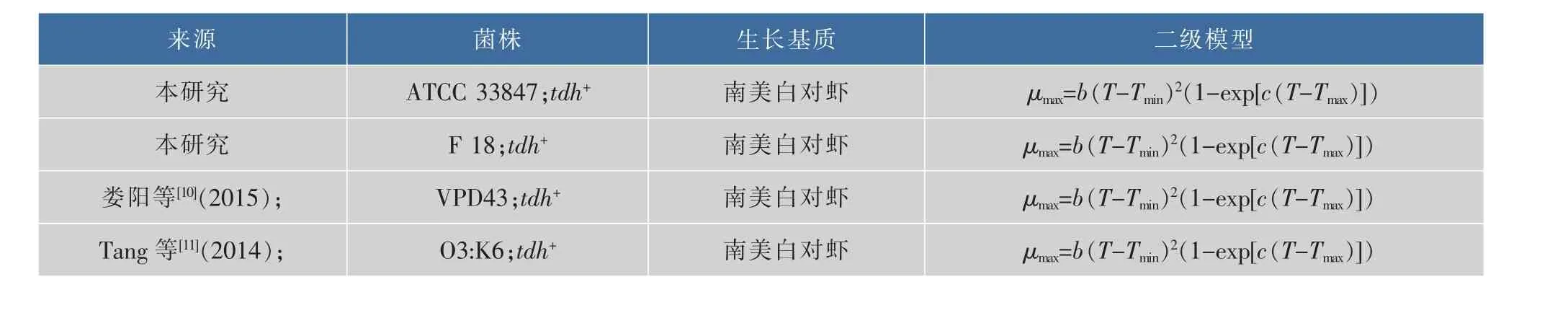
表3 本研究与同类研究副溶血性弧菌的生长差异比较Table 3 Comparison of growth parameters of V.parahaemolyticus in the present study and the similar researches

图3 本研究中致病性副溶血性弧菌在10~30℃的μmax与同类文献做比较Fig.3 A μmaxcomparison of published and observed V.parahaemolyticus from 10℃to 30℃
3 结 语
预测微生物学模型是食品安全领域中的一个重要研究主题,为了能方便、准确预测食品的货架期、控制食品的品质以及对食品进行准确的风险预警、风险评估,目前,国内外的学者针对不同条件不同致病微生物和腐败微生物开展了大量的研究工作,这些工作使得预测微生物学的数据基础得以逐步健全。如王璐华等[15]采用Gompertz和Linear方程拟合副溶血性弧菌在4~40℃条件下的生长曲线,结果采用Gompertz模型作为VP的最适模型;Ting等[16]研究了单增李斯特菌和背景微生物在甜瓜上的生长情况,结果表明3-parameter logistic model可以较好的拟合单增李斯特菌在背景微生物下的生长情况;贺群等[17]采用修正Gompertz模型、修正Logistic模型和Baranyi模型拟合面包虾中副溶血性弧菌在10~37℃条件下的生长情况,结果表明Gompertz模型拟合效果最佳。Yoon等采用修正Gompertz模型致病性和非致病性副溶血性弧菌拟合在肉汤和牡蛎匀浆中的生长动力学,并用Davey和平方根模型等二级模型拟合延滞期和最大比生长速率随温度的变化曲线,结果表明建立的模型可有效安全地预测副溶血性弧菌的生长。Tang等[10]比较了不同致病性的副溶血性弧菌在南美白对虾以及培养基上的生长差异,证明不同致病性的副溶血性弧菌的生长动力学参数存在一定的偏差。
由此可见,副溶血性弧菌的预测模型研究更多的集中在致病性、非致病性菌株在不同条件下、不同基质中的生长特性以及预测微生物模型的建立,这些研究为预测食品货架期、风险评估提供了一定的数据基础,但是因菌株异质性所带来的生长差异分析有待于研究完善。从本研究结果可知,4~15℃下,两株高致病性VP在即食南美白对虾中的生长特性及生长参数存在显著性差异(P<0.05);高温条件下,两株高致病性VP的生长参数存在差异(P<0.05);在拟合最适模型时,F 18在10℃时的生长数据用所选用的模型无法拟合,而ATCC 33847的生长数据拟合效果良好;建立二级模型时,F 18的最大比生长速率始终大于ATCC 33847,最大差值可达到 0.7 lg((cfu/mL)/h);F 18 的延滞期始终小于ATCC 33847,最大差值可达到7.3 h。而与其他文献相比较发现,携带有相同致病基因的VP的最大比生长速率以及延滞期值等动力学生长参数存在显著性差异(P<0.05),这证明相同致病性菌株的生长特性存在异质性,而这会对风险评估的准确性带来一定的影响。
在进行微生物风险评估时,现有的大多数研究所建立的预测模型并未根据菌株异质性对所选用的模型进行修正。而从模型的角度出发考虑,研究越贴近菌株的真实情况,所建立的预测模型更具有参考价值,以不切合现实情况或远离现实情况为基础所建立的模型存在很大的不确定性,不利于相关管理部门直接使用风险评估的结果对该食品做出管理措施,也不利于消费者的健康消费。所以,在研究副溶血性弧菌的或者其他水产品时,应将菌株异质性作为影响因素之一,在之后应详细研究不同来源、不同致病性、不同血清型的副溶血性弧菌的生长、死亡等生长特征,建立不同影响因素下或者混合副溶血性弧菌的预测模型,为风险评估提供更可靠、更全面的数据基础。
