鲍鱼褐藻胶裂解酶基因的原核表达及酶学性质
2018-09-20李云涛汪立平
张 齐 , 李云涛 , 汪立平 *
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306)
褐藻胶(Alginate)是由 β-1,4-D-甘露糖醛酸(M)和α-1,4-L-古罗糖醛酸 (G)两种单体通过1,4-糖苷键链接而成的线性多糖聚合物,主要来自于海带、马尾藻、巨藻等褐藻类植物[1]。近年来,褐藻胶的酶解产物褐藻胶寡糖因其能促进双歧杆菌的生长[2]、能促进植物根系生长[3]、抗氧化活性[4]、抗病原体[5]等生理活性而受到越来越多的关注。
褐藻胶裂解酶能通过β消去机制催化褐藻胶的降解成寡糖和不饱和的糖醛酸,其作用位点是1,4糖苷键[6]。褐藻胶裂解酶主要来源于海洋藻类、海洋软体动物和海洋微生物[7]。
褐藻胶裂解酶可直接将弹性的褐藻藻体转变为浆状,同时释放出降解的褐藻胶寡糖,而这种将褐藻变成高附加值原料的技术关键在于褐藻胶裂解酶。为了大规模的应用褐藻胶裂解酶来降解褐藻,需要提供大量低成本的酶。目前,相对于细菌来源的褐藻胶裂解酶,软体动物来源的褐藻胶裂解酶的研究较少;目前已经从角蝾螺Turbo cornutus[8]、滨螺Littorina sp.[9]、 黑斑海兔 Littorina brevicula[10]、皱纹盘鲍Haliotis discus hannai[11-12]等软体动物分离出褐藻胶裂解酶。虽然人们已经反复研究了软体动物来源的褐藻胶裂解酶的常规生化特性,但目前仅成功克隆了皱纹盘鲍Haliotis discus hannai[11]、短滨螺Aplysia kurodai[13]、黑斑海兔Littorina brevicula[14]少数种类软体动物褐藻胶裂解酶的基因。皱纹盘鲍重组蛋白为包涵体,复性后没有活性,短滨螺、黑斑海兔重组酶的比酶活分别为1 147.2 U/mg和2 100 U/mg;均具有多聚甘露糖醛酸底物特异性。
本研究中,以鲍鱼来源的一种适冷性和多聚甘露糖醛酸底物特异性的褐藻胶裂解酶为研究对象,参考皱纹盘鲍褐藻胶裂解酶的cDNA序列,通过RT-PCR克隆到编码鲍鱼褐藻胶裂解酶成熟肽的cDNA片段,将其连接至pET-28a(+)原核表达质粒在大肠杆菌中进行表达;纯化了重组蛋白,并对其酶学性质进行研究。
1 材料与方法
1.1 材料
1.1.1 质粒和菌种 大肠杆菌TOP10和BL21(DE3):购自北京天根生物科技公司;克隆载体pEASY-T3:购自全式金生物技术有限公司;表达载体pET-28a(+):作者所在实验室保存。
1.1.2 试剂 Total RNA Extractor(Trizol)试剂盒、氨苄青霉素、硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷 (IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)、甲叉双丙烯酰胺、Tris base、丙烯酰胺、考马斯亮蓝G250、还原型谷胱甘肽、氧化型谷胱甘肽、DNA相对分子质量标准品、蛋白质相对分子质量标准品:购自上海生工生物工程有限公司;限制性内切酶Bam HI和Nde I,T4 DNA连接酶:购自New England Biolabs;质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒、Taq PCR MasterMix:购自北京天根生化科技有限公司;TransScript First-Strand cDNA Synthesis SuperMix试剂盒:购自全式金生物有限公司;蛋白质纯化Ni-NTA Agarose:购自QIAGEN。引物合成由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 algl基因克隆 取适量新鲜肝胰腺组织,使用Total RNA Extractor试剂盒提取总RNA。提取的总RNA经琼脂糖凝胶电泳和OD260/280鉴定,紫外分光光度计法检测其浓度后贮于-80℃冰箱备用。用TransScript First-Strand cDNA Synthesis SuperMix试剂盒合成第一链cDNA。参考皱纹盘鲍褐藻胶裂解 酶 的 核 苷 酸 序 列 (GenBank:AB110094.1),用Primer premier 5.0软件设计正向引物AlgF(5'-GCTGCGGCA GAAAGTCGACCAG-3')和反向引物AlgR(5'-GATGTGGCGTGTACATG-3'),用以扩增鲍鱼褐藻胶裂解酶的全长cDNA。采用T-A克隆法,将扩增得到的cDNA连接到pEASY-T3载体,将连接物转化感受态大肠杆菌TOP10后,涂布于含氨苄青霉素和IPTG的抗性平板,37℃静置培养16~20 h。通过蓝白班筛选阳性转化子,对其进行DNA测序,测序正确的重组质粒命名为pEASYT3-algl。
1.2.2 pET-28a-algl表达载体构建 提取pEASYT3-algl质粒,以其为模板,设计分别添加Nde I和Bam HI酶切位点的正向引物ExF (5'-CGAACAATGTATTGTGACACATAAAG-3')和反向引物 ExR(5'-GATGTTGGATCCTACATG TGTACA-3')对编码algl成熟肽的cDNA片段进行PCR扩增。扩增的片段进行Nde I、Bam HI双酶切,经琼脂糖凝胶电泳割胶回收目的片段,将其与用同样酶处理过的表达载体pET-28a按15∶1连接,在T4 DNA连接酶作用下,16℃保温16 h,转化感受态细胞大肠杆菌TOP10,通过菌落PCR、双酶切和DNA测序对重组表达载体pET-28a-algl进行筛选。
1.2.3 algl基因的诱导表达 重组质粒pET-28aalgl提纯后转化大肠杆菌BL21(DE3)感受态细胞,将转化细胞接种于10 mL含50 ug/mL硫酸卡那霉素的LB液体培养基中,37℃、180 r/min过夜培养后,取1 mL转接入100 mL含50 ug/mL硫酸卡那霉素的LB培养基中,37℃、180 r/min培养至OD600约为0.8时,取1 mL菌液做未诱导对照;剩余培养液加入IPTG至1 mmol/L,28℃、180 r/min诱导表达6 h,菌液10 000 r/min离心10 min,4℃离心收集菌体,菌体重悬于10 mL裂解缓冲液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,20% 甘 油 ,1%Trition X-100),用超声波破碎菌体,破碎条件:破碎功率150 W,工作/间隙时间为4 s/8 s,时间15 min,冰浴。破碎液10 000 r/min、4℃离心10 min,分别收集上清液、沉淀进行SDS-PAGE分析。
1.2.4 包涵体蛋白纯化、复性 包涵体重悬于2 mL溶解缓冲液 (50 mmol/L Tris-HCl,pH 8.0,8 mol/L尿素,12 mmol/L 2-巯基乙醇),室温下不停搅拌1 h。13 000 r/min、离心15 min,4℃离心收集上清液,去除沉淀。
先用4 mL平衡Ni-NTA resin,缓慢倒入2 mL包涵体溶解液,使蛋白质与Ni-NTA树脂充分结合(4 ℃,150 r/min,1 h),随后用 5 mL 漂洗缓冲液(50 mmol/L Tris-HCl,pH 8.0,8 mol/L 尿素 ,10 mmol/L咪唑)漂洗两次来洗掉未结合成分,最后用1 mL洗脱缓冲液 (50 mmol/L Tris-HCl,pH 8.0,8 mol/L 尿素,250 mmol/L咪唑)将重组蛋白Algl洗脱下来。
通过Ni-NTA纯化得到的重组蛋白Algl逐滴滴加到10 mL复性缓冲液(50 mmol/L Tris-HCl,pH 8.0,5 mmol/L还原型谷胱甘肽,1 mmol/L氧化型谷胱甘肽)中至蛋白质终质量浓度20 μg/mL,4℃下不停的搅拌24 h。将蛋白质溶液放入处理好的透析袋中,两端用细线系好,将透析袋放入装有50mmol/L Tris-HCl(pH 8.0)的烧杯,4 ℃搅拌透析 24 h。透析后的蛋白质溶液即为复性的重组蛋白Algl溶液,用于酶活测定及酶学性质研究。
1.2.5 酶活力测定 褐藻胶裂解酶酶活力测定参照Preiss方法[15],将0.1 mL酶液加入2.9 mL体积分数 0.1%褐藻酸钠 (50 mmol/L Tris-HCl,pH 8.0)中混合,在35℃下保温20 min后测量反应前后在235 nm处的吸光度值。在235 nm处反应液吸光度值每分钟增加0.01定义为一个酶活单位(U)。
1.2.6 温度、pH对褐藻胶裂解酶活性及稳定性的影响 重组蛋白最适催化温度和温度稳定性测定,将0.1 mL酶液添加到2.9 mL体积分数0.1%海藻酸钠溶液(50 mmol/L Tris-HCl,pH 8.0)中,在 20~70℃水浴条件下反应20 min后测定酶活,将最高酶活力设为100%;将酶液放置在不同的温度下保温1 h后按1.2.5测定残余酶活力,将初始酶活力设为100%。
重组蛋白最适催化pH值和pH稳定性测定,将0.1 mL酶液添加到2.9 mL不同pH的0.1%海藻酸钠溶液(50 mmol/L Tris-HCl,pH 3.0~10.6)中,在 35℃保温20 min后测定酶活,将最高酶活力设为100%;将酶液添加到不同pH的缓冲液中冰浴1 h后按1.2.5测定酶的残余活力,将初始的酶活力设为100%。
1.2.7 EDTA、金属离子对酶活的影响 将金属离子 化 合 物 KCl、NaCl、CaCl2、MnCl2、MgCl2、CuCl2、FeCl3、ZnCl2和 EDTA、SDS 分别加入 Tris-HCl(50mmol/L,pH 8.0)中配制成1 mmol/L的溶液,以添加相同体积水作为对照组,调节pH至8.0,测定不同反应体系下的酶活力。
1.2.8 褐藻胶裂解酶底物特异性以及动力学测定多聚古洛糖醛酸(polyG)、多聚甘露糖醛酸(polyM)、不规则杂合片段(pMG)的制备参照Gacesa[16]的方法。将海藻酸钠、多聚古洛糖醛酸(polyG)、多聚甘露糖醛酸(polyM)、不规则杂合片段(pMG)四种底物加入Tris-HCl(50 mmol/L,pH 8.0)配成0.1%的反应液,按1.2.4方法测定不同时间的吸光度值。
重组酶动力学分析,通过测定酶在Tris-HCl缓冲液 (pH 8.0)中不同底物质量浓度 [S](0.625~5.0 mg/mL)下的反应速度V来确定酶催化的最大速度Vmax和米氏参数Km。取2.9 mL不同浓度的海藻酸钠溶液加入0.1 mL酶液,总反应体系3 mL,于35℃保温20 min,再测定反应液在235 nm处的吸光度值。根据双倒数作图法(Lineweaver-Burk),将反应速度的倒数1/V对底物浓度的倒数1/[S]作图,通过计算横截距和纵截距求出米氏常数Km和Vmax。
2 结果与分析
2.1 algl基因的克隆
以鲍鱼肝胰腺第一链cDN为模板,用一对根据皱纹盘鲍褐藻胶裂解酶基因的核苷酸序列设计的特异性引物AlgF、AlgR,通过PCR扩增得到algl的cDNA,见图1。将其与pEASY-T3载体连接,转化大肠杆菌TOP10感受态细胞,对蓝白斑筛选得到的阳性克隆子pEASY-T3-algl进行DNA测序。
测序结果表明,该片段全长822 bp,编码273个氨基酸algl基因GenBank登录号为:KP406582。

图1 鲍鱼肝胰腺总RNA和algl基因PCR扩增Fig.1 Total RNA of abalone hepatopancreas and PCR amplification of algl gene
2.2 重组表达质粒的构建
以重组质粒pEASY-T3-algl为模板,以ExF、ExR为引物,通过PCR扩增得到编码Algl成熟肽片段,将Algl成熟肽片段和pET-28a经Nde I和Bam HI双酶切及纯化回收后,通过T4 DNA连接酶连接后得到重组表达载体pET-28a-algl。通过菌落PCR琼脂糖凝胶电泳检测发现,在约 1 060 bp处有清晰条带,见图2(a),与理论相符;进一步对该载体采用Nde I和Bam HI双酶切处理,经1 g/dL琼脂糖凝胶电泳检测,该载体经双酶切后存在两条谱带,其中一条约为780 bp的谱带属于目的片段,见图2(b);最后通过DNA测序,结果显示目的基因没有突变并且读码框正确。

图2 重组表达载体pET-28a-algl的菌落PCR双酶切鉴定Fig.2 Identification of the recombinant expression vector pET-28a-algl by PCR and restriction enzyme digestion
2.3 重组蛋白的诱导表达 、鉴定及包涵体的纯化
含重组表达质粒pET-28a-algl的大肠杆菌BL21(DE3)在 28 ℃、1 mmol/L IPTG 诱导培养 6 h后,成功表达了重组蛋白Algl(图3,泳道2)。细胞经超声波破碎后,通过SDS-PAGE发现,该蛋白质以包涵体形式存在(图3,泳道4)。包涵体蛋白质溶解,变性条件下经Ni-NTA琼脂糖凝胶柱亲和层析纯化后,复性、透析得到重组褐藻胶裂解酶(图3,泳道5)。由图3可以看出,重组蛋白Algl相对分子质量大约32 000,与预期的融合蛋白的相对分子质量一致。纯化后的重组蛋白Algl测定酶活为15.6 U/mL,比酶活为644.6 U/mg。
2.4 最适反应温度及温度稳定性
酶最适的反应温度通过测定其在不同温度下酶活力确定。由图4知,酶的最适反应温度35℃,其酶活为15.6 U/mL。在30~40℃范围内有较高的催化活性,当温度降低到20℃或升高到50℃时,酶活力都迅速下降。酶的温度稳定性见图4。酶在40℃及以下较稳定,40℃处理1 h后残留酶活力为初始值的59.7%;而当温度高于40℃时,残留酶活力下降很快,在60℃下处理1 h,酶几乎失活;表明该褐藻胶裂解酶Algl的温度稳定性有待进一步提高。

图3 Alyl的SDS-PAGEFig.3 SDS-PAGE of Alyl
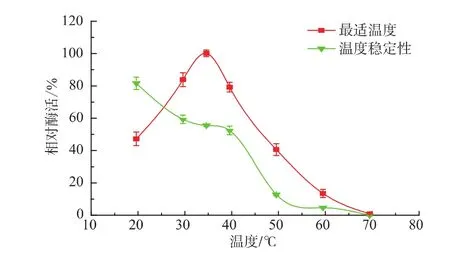
图4 Alyl最适反应温度及温度稳定性Fig.4 Optimal temperature and thermostability of Alyl
2.5 最适反应pH及pH稳定性
酶最适反应的pH通过测定其在不同pH下酶活力确定,结果见图5。最适酶反应pH条件为8.0,其酶活为15.6 U/mL。当pH为7.0时,酶活力为峰值的61.9%,而当pH升高到9.0时,酶活力仅为峰值的32.1%。当褐藻胶裂解酶在pH 6.0~9.0的范围内处理1 h后,残留酶活力能达到60%以上,pH值再降低或升高时残余酶活力较低,当pH降到4.0或升高到10.0时,残留酶活力几乎为零。此酶是一个嗜碱酶。
2.6 EDTA、金属离子对酶活力影响
在酶的反应底物中加入1 mmol/L的EDTA、SDS和不同的金属离子化合物,测定其酶活;以不加任何离子时的酶活力15.6 U/mL为100%。根据表1,K+、Na+、Ca2+、Mn2+对酶活有激活作用,K+对酶活的刺激作用最大,可使酶活提高19%;而Mg2+、Cu2+、Fe3+、Zn2+对酶活有抑制作用,Zn2+的抑制作用在金属离子中最强。 EDTA、SDS对酶活的抑制相对于金属离子的作用更明显。

图5 Algl的最适反应pH及pH稳定性Fig.5 Optimal pH and atability of Algl

表1 金属离子对酶活的影响Table 1 Effect of metal cations on AlgL activity
2.7 底物特异性
四种底物用来研究褐藻胶裂解酶的底物特异性,结果见图6。发现酶与多聚甘露糖醛酸的反应液在波长235 nm处的吸光度变化值最高,海藻酸钠、不规则杂合片段吸光度值变化依次减小,而在多聚古洛糖醛酸中吸光度没有发生变化。表明褐藻胶裂解酶Algl具有多聚甘露糖醛酸底物特异性,不能降解多聚古洛糖醛酸。

图6 酶的底物特异性Fig.6 Substrate specificity of AlgL
2.8 酶催化动力学
以不同质量浓度的海藻酸钠为底物,测定重组酶的酶活。根据双倒数作图法,将酶活力的倒数1/V对底物浓度的倒数1/[S]作图,得到一条直线,结果见图7。通过计算直线与纵轴的截距得到最大反应速度Vmax=19.08 U/mL,直线与横轴的截距得到米氏常数Km=1.71 mg/mL。

图7 Algl水解褐藻胶的Lineweaver-Burke双倒数图Fig.7 Lineweaver-Burke plots of the alginate degradation by the Algl
3 结语
从鲍鱼肝胰腺中提取RNA,通过RT-PCR得到褐藻胶裂解酶(algl)的cDNA,将其构建到pET-28a(+)上并在大肠杆菌BL21菌株中进行高效诱导表达,将菌体超声波破碎后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,该蛋白质以包涵体的形式表达。包涵体的形成主要是蛋白质合成速度过快,没有足够的时间进行折叠;对含二硫键较多的重组蛋白质而言,细胞质内的还原环境抑制二硫键的形成;重组蛋白质在大肠杆菌中表达时,缺乏一些蛋白质折叠过程中所需要的酶和辅助因子,如折叠酶和分子伴侣等,是包涵体形成的又一原因[17]。
包涵体在变性条件下用Ni-NTA琼脂糖凝胶柱亲和层析纯化,将纯化后的重组蛋白质复性,继而对其进行活性检测和酶学特性研究。纯化后的Algl测定其酶活为15.6 U/mL,比酶活为644.6 U/mg,低于报道中短滨螺(1 147.2 U/mg)、黑斑海兔(2 100 U/mg)比酶活。在pH 8.0时酶活力达到最大值,属于嗜碱性酶;底物特异性分析表明,褐藻胶裂解酶Algl具有多聚甘露糖醛酸底物特异性,不能降解多聚古洛糖醛酸;据报道,短滨螺和黑斑海兔来源的褐藻胶裂解酶同样只具有多聚甘露糖醛酸底物特异性[12-13],所以Algl与其他软体动物来源的褐藻胶裂解酶同属于多糖裂解酶家族14(PL14)。Algl最适温度35℃,且在20~30℃处有60%以上的酶活性保留,则该酶具有适冷性,热不稳定性;而报道中短滨螺和黑斑海兔来源的褐藻胶裂解酶最适温度分别为55℃和50℃[12-13]。重组酶Algl的这种适冷性和热不稳定性可以很好的用于工业生产,低温反应的酶可以降低因加热而产生的生产成本,热不稳定性对于工业生产是很有利的,只需要适当的提高温度就可以很容易和选择性的灭活。
