超声造影诊断微小原发性肝癌患者临床价值研究
2018-09-20郭振宁
郭振宁
原发性肝癌(primary liver cancer,PLC)具有较高的发病率和死亡率。临床上,将癌结节数量≤2个、最大直径或相邻癌结节直径之和≤2 cm、起病隐匿、无明显症状和体征的早期肝癌定义为微小PLC[1]。目前,公认为应首选超声监测PLC的发生,但由于PLC的超声图像与肝硬化结节或良性肿瘤等可出现重叠,其诊断效能受到限制。超声造影是通过使用造影剂增强后散射回声,以提高超声分辨率、特异性和敏感性的技术,又称声学造影[2]。近年来,随着超声仪器的更新和新型超声造影剂的出现,超声造影对脑、心、肝、肾等实质器官的血流多普勒信号和超声影像明显增强,且能更好地反映病变组织与正常组织的血流灌注差异[3]。我们采用超声造影监测了156例PLC高危人群,对早期发现微小PLC起到了重要作用,现报道如下。
1 资料与方法
1.1 一般资料 2016年1月~2016年12月于我院彩超室行长期肝脏超声造影监测的PLC高危人群156例,男84例,女72例;年龄17~79岁,平均年龄(49.65±2.15)岁。纳入标准:对符合《病毒性肝炎防治方案》[4]中关于慢性肝炎诊断标准的患者行超声筛查,高危人群被定义为:有PLC家族史、HCV或HBV携带的慢性肝炎患者、肝硬化伴肝内未定性占位性病变或者影像学检查肝内未发现占位性病变但新近有血清PLC标志物Glypican-3或甲胎蛋白(alpha fetoprotein,AFP)升高的慢性肝病患者。对常规超声检查发现肝占位病变的患者行超声造影检查。根据中华医学会外科学分会肝脏外科学组2012年制定的《肝细胞癌诊断与治疗路线图》[5]中的标准,将直径≤2 cm的肝癌病灶称为微小PLC。本研究经过我院医学伦理委员会批准,所有患者均自愿参加研究并签署知情同意书。
1.2 超声造影 在造影前,对患者行肝脏超声常规检查,记录病灶位置、数量、大小和特征。使用东芝TOSHIBA UIIO 780A彩超诊断仪及其配套探头对所有患者行超声造影检查,频率设置为3~5 MHz。将Sono Vue造影剂(意大利)2.4 ml,溶解于0.9%NaCl溶液5 ml中,经肘浅静脉,快速(3 s内)完成注射。将气体六氟化硫(sulphur hexafluoride microbubbles for injection)59 mg 注入 0.9%NaCl溶液5 ml,pH为4.6~7.6,形成平均直径为2.5μm的气体微泡后,经外周静脉注入1.5~2.0 ml。采用超声造影成像技术(contrast turned imaging,CNTI),以动态视频的形式定时观察及储存病灶区域造影的回声强度变化。在有目标病灶的造影检查时,首先通过灰阶及彩色多普勒超声观察病灶形态、大小、边界、血流信号和回声等情况。进入造影状态后,全程定时观察病灶的造影增强和消退方式。对无明确病灶目标的超声造影检查,首先通过灰阶及彩色多普勒超声检查观察全肝情况,再观察左右肝叶超声造影表现,最后不断转动探头以观察动脉期、门脉期和延迟期是否有造影剂填充异常区域。当发现低回声区时,在明确目标部位后再行超声造影观察。在造影过程中,确保患者的呼吸平稳且探头保持固定。对屏气困难的高龄患者,采用造影吸氧检查,以确保能捕捉到微小病灶的定时图像。造影获得有诊断意义的时像后,对全肝进行一次快速扫查,以便发现造影剂退出后呈弱回声的新病灶,对显像不充分区域的微小病灶进行全时相观察,在造影结束后6~10 min重复检查。在超声造影后,由多名有良好工作经验的病理科医师查看各时段录像,进行造影筛查,作出诊断。每3个月进行1次超声造影检查,在超声造影后15 d内行CT、MRI检查,必要时行组织穿刺病理学检查,以对微小PLC进行诊断。
1.3 观察指标和评定标准 根据肝内结节血流动力学特点,鉴别肿瘤为良性还是恶性,其特征为:①典型的恶性增强模式,即“快进快出”型,动脉期病灶回声快速增强(造影剂注射后25 s内),静脉期和延迟期呈低回声消退,诊断为恶性;②不典型的恶性增强模式为“快进同出”型,即动脉期病灶回声快速增强、门脉期和延迟期无明显减退,诊断为可疑恶性;③良性结节:即“慢进同出”型,病灶回声较肝实质期增强慢,门脉期和延迟期则与肝实质期同步减退。
1.4 统计学分析 应用SPSS 19.0进行统计学处理,计量资料以±s表示,采用t检验,计数资料采用x2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 诊断情况 在156例PLC高危人群中,常规超声检查诊断恶性占位29例,可疑恶性14例;经超声造影检查,诊断恶性占位32例,可疑恶性9例。经CT、MRI和手术后或穿刺活检组织病理学检查,诊断为肝细胞癌(HCC)32例,可疑恶性9例。在32例HCC患者中,男17例,女15例;年龄20~69岁,平均年龄(48.56±2.05)岁。病灶直径 0.8~2 cm,平均(1.62±0.12)cm。
2.1 不同大小病灶增强造影模式比较 见表1。
表1 不同大小病灶造影表现(%,±s)

表1 不同大小病灶造影表现(%,±s)
病灶(cm) 例数 动脉期增强时间(s) 消退期时间(s) 造影增强模式快进快出 快进同出≤1 16 15.22±3.11 235.15±150.11 6(37.5) 10(62.5)1~2 16 17.60±3.12 85.60±15.44 7(43.8) 9(56.3)t/x2 2.1610 3.9642 0.1296 P 0.0388 0.0004 0.7189
2.3 常规二维超声和超声造影表现 见图1、图2、图3。

图1 乙型肝炎肝硬化患者常规二维超声表现 提示肝右叶低回声占位,内部回声欠均匀,边界欠清晰
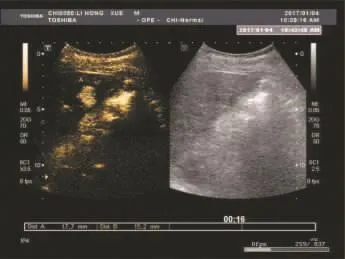
图2 微小PLC患者超声造影表现 造影后动脉期病灶快速强化

图3 微小PLC患者超声造影表现 造影后延迟期病灶快速廓清,呈低回声,符合肝癌“快进快出”表现
3 讨论
微小PLC的高危诱发因素为:①感染HBV。相关研究数据显示[6],HBV感染与微小PLC间的相关度高达80.9%。国内外多项流行病学调查结果也证明[7],微小PLC的多发区往往恰好是HBV感染高流行区,而通过接种疫苗预防乙型肝炎后,微小PLC的发病率也随之下降;②黄曲霉毒素摄入。黄曲霉会损害正常细胞的结构、功能,并抑制人体免疫系统发挥作用,该毒素是豆类、谷类食物在炎热环境下霉变产生的[8];③饮水污染。饮水中含有氯仿、二溴乙烯、苯并芘等致癌物质是患微小PLC的主要原因。在各种水源中,深井水的患癌率最低,塘水和宅沟水的患癌率较高;④熬夜、劳累过度。由于肝代谢时间为晚间10:00~11:00,经常性的熬夜会造成肝代谢紊乱,再加上现代人普遍在白天从事繁重的工作,造成劳累过度,加剧肝脏代谢负担,从而诱发微小PLC[9]。
较常用的检查方法有AFP检测、CT扫描和超声检查。对于高危PLC人群,定期进行AFP检查,发现其水平不断升高时,需警惕微小PLC的发生。CT扫描作为目前诊断和鉴别诊断PLC的首选影像学方法,具有较高的微小PLC检出率。超声检查多用于普查中,检查费用便宜,无创伤,有经验的医师甚至可检出1 cm以下的的微小PLC,而超声造影具有高分辨率和高灵敏度,能排除多样性肝硬化结节等造成的诊断干扰,尤其对于微小PLC的诊断,其正确率更高于CT检查[10-12]。在诊断方面,应综合考虑临床和病理学因素,包括患者的临床表现和CT、MRI等检查,以作出微小PLC的综合判定[13]。
本组确诊微小HCC患者32例,13例超声造影显示动脉早期瘤体完全增强,而门脉期和延迟期表现为低回声,呈现典型的“快进快出”增强模式,19例造影剂超过6 min未廓清,呈“快进同出”型。在PLC的发生发展中,通常由不典型门静脉及肝动脉双重供血渐渐转化成动脉供血为主,同时伴随肝内一系列的血流动力学变化[14]。超声造影的工作原理是使用造影剂增强背向血液散射,以清楚显示血流状态。因为相对于软组织,血细胞的散射回声强度更低,其超声影像显示为“无回声”[15]。在纯超声检查时,往往会因为分辨力的限制,造成微血管无法显示。血液中的造影剂不容易产生伪像,更能清楚显示病灶不同时相的血流灌注特征,从而提高PLC的发现率[16]。在无明确病灶目标的超声造影检查时,一定要不断转动探头,观察动脉期、门脉期和延迟期是否有造影剂填充异常区域或常规超声未能查出的微小病灶。若发现低回声区有异常,则需在明确目标部位后再注射造影剂行超声造影,观察目标区超声造影的增强方式,以判定占位的良恶性。在本组发现的32例微小HCC中,有5例是在无明确病灶目标的超声造影检查中发现的,经门脉期和延迟期扫查发现异常低回音区,再行超声造影观察后确定为微小PLC,其中有3例患者AFP升高,但常规超声未查出病灶,有2例是由于“快进同出”型漏诊,即灰阶超声未查出病灶,动脉期未锁定观察目标,而门脉期和延迟期未观察到低回声消退现象[17-21]。
有研究表明[22-27],相比CT和常规超声检查,超声造影在发现小病灶的肝肿瘤方面更具明显的优势。由于超声检查为实时动态显示,对人体无电磁辐射,可重复多次检查以提高对结节良恶性的鉴别诊断。微泡造影剂安全性高,对人体无害。
