旱盐双重胁迫对乌拉尔甘草幼苗生理生化特性的影响
2018-09-19耿广琴谢晓蓉
耿广琴, 谢晓蓉
(甘肃中医药大学基础医学院,兰州 甘肃 730000)
甘草(Glycyrrhizauralensis)属豆科多年生草本植物,是临床上常用的一种中草药,性平,味甘,归十二经。甘草主要分布在我国西北干旱、半干旱地区,具有耐寒、耐旱、耐盐碱,生长期较长,地面覆盖度高,地上茎叶养分含量高等特性。因此,甘草也是中国西北干旱、半干旱荒漠化地区进行盐碱地改良和防风固沙的重要的植物资源之一。
由于气候干燥、蒸发量大、降水稀少,地下水中的盐分随着蒸发不断向地表迁移聚集,并且随着干旱的频繁发生、化肥的使用和灌溉,西北地区土壤盐碱化日趋严重。目前,中国盐渍土总面积约为3 460万hm2,西部盐渍土面积占全国的69.03%。干旱和土壤盐渍化已成为制约西北地区农业生产和生态环境的严重问题。在西北干旱地区,甘草生长期间往往同时受干旱和盐胁迫的影响。目前,关于甘草对逆境胁迫的生理生化响应已有报道[1-3],但主要为单一因素的盐分胁迫或干旱胁迫[4-5],而旱盐双重胁迫下甘草生理生化响应研究较少。为此,本研究以一年生甘草为材料,通过研究在旱盐双重胁迫下甘草叶片渗透调节物质含量和抗氧化功能的变化,进而揭示甘草忍耐旱盐双重胁迫的生理防御及适应机理,为其在干旱地区盐渍土壤中的栽培提供科学依据。
1 材料与方法
1.1 材料和处理
2015年4月中旬于甘肃省酒泉市金塔县生地湾采集一年生甘草苗,经甘肃中医药大学杜弢教授鉴定为乌拉尔甘草。
在兰州市园林科学研究所温室内开展盆栽试验。选取生长状况一致的一年生甘草苗,根长修剪为20 cm,移栽于高30 cm、内径23 cm的花盆内,盆下垫塑料托盘,基质为砂质壤土,pH 8.1,盐分含量15.2 g·kg-1,全氮含量18 mg·kg-1,有效磷含量62.82 mg·kg-1。使用前用蒸馏水淋洗除盐,淋洗后土壤含盐量低于0.02%,晒干备用。每盆栽植6株,每处理12盆。培养期间每隔7 d浇清水2 L,以保持土壤湿度。待幼苗生长1个月后,于5月中旬,进行旱盐双重胁迫处理。
试验设置水分胁迫梯度和盐分胁迫梯度,通过控制浇水时间、浇水次数及浇水量,使试验同期达到相应的胁迫处理水平。干旱胁迫处理参照Hsiao[6]旱生植物水分梯度划分设计,使水分同期达到以下3个梯度:土壤含水量为田间最大持水量的55%~60% (A1,轻度胁迫)、40%~45%(A2,中度胁迫)、20%~25%(A3,重度胁迫)。盐分胁迫处理采用NaCl,设200 mmol·L-1(B,轻度胁迫)、400 mmol·L-1(C,中度胁迫)和600 mmol·L-1(D,重度胁迫)3个水平,根据研究报道甘草可以忍耐含盐量0.3%~0.6%的盐化条件,在含盐量1%~2%的盐土上生长不良[7],本试验将轻度胁迫设为200 mmol·L-1NaCl。试验开始前按照设定盐分胁迫梯度,用去离子水溶解外源NaCl,为避免盐激,各处理组NaCl总质量均分为10次,连续10 d溶于相应当天所需加入的清水中,均匀施于花盆中,直到达到各胁迫的预定浓度。试验开始后不再施加NaCl,每天下午对花盆称重,补充当天失去的水分,使各处理土壤保持设定的含水量。9个旱盐双重胁迫处理为轻度、中度、重度干旱胁迫与200、400和600 mmol·L-1NaCl的随机组合(表1),以土壤含水量为田间最大持水量的75%~80%作为对照(CK,土壤含盐量低于0.02%)。在开始胁迫后,每隔25 d测定一次各项指标,共测定3次,胁迫75 d。

表1 胁迫试验处理Table 1 The design of the experiment to evaluate stress
1.2 指标测定与方法
1.2.1植株生长指标测定 每个处理随机取两盆采挖12株甘草,用卷尺测量株高。将甘草用清水洗净,吸水纸吸干水分,测量地上部分、地下部分的鲜重。然后105 ℃杀青,置于烘箱55 ℃烘干,测定地上部分与地下部分的干重。
1.2.2生化指标测定 采集甘草幼苗自上而下第3~5枝复叶的新鲜叶,每株采取3~4枚鲜叶用于相关指标测定。茚三酮显色法测定叶片脯氨酸含量[8];蒽酮比色法测定叶片可溶性糖含量[9];考马斯亮蓝G-250染色法测定可溶性蛋白质含量;NBT光化还原法测定SOD活性[10];硫代巴比妥酸显色法测定MDA含量[11]。
酶解法获得的甘草叶片原生质体,经20%蔗糖漂浮后,用台盼蓝染色法测定细胞死亡率,细胞活力大于95%可继续下一步试验。原生质体DNA损伤检测采用单细胞凝胶电泳法[12]。选择尾长(tail length,TL)、尾矩(tail moment,TM)、Olive尾矩(Olive tail moment,OTM)为DNA损伤指标。
1.3 数据统计
用SPSS 13.0软件对试验数据进行统计分析,试验数据以平均值±标准误表示,采用Duncan法进行多重比较(P<0.05)。
2 结果与分析
2.1 旱盐双重胁迫下甘草生长指标的变化
经过处理25、50和75 d,在旱盐双重胁迫下,乌拉尔甘草株高,地上鲜、干重和根鲜、干重各项指标与对照相比,均有所减少(表2、3、4)。其中75 d时,重度干旱胁迫下,200、400和600 mmol·L-1NaCl时,甘草株高分别为对照的63%、61%、39%,地上鲜重、干重分别均为对照的69%、70%、45%,根鲜重、干重分别均为对照的73%、71%、39%。轻度、中度干旱胁迫下,400和600 mmol·L-1NaCl处理,甘草株高,地上鲜、干重和根鲜、干重随着盐胁迫浓度的增加而逐步下降,且各处理与对照间差异显著(P<0.05);重度干旱胁迫下,随着盐分含量增加,甘草株高,地上鲜、干重和根鲜、干重也下降,但A3B和A3C之间无显著差异(P>0.05)。同等盐分胁迫下,随干旱胁迫增强,乌拉尔甘草株高,地上鲜、干重和根鲜、干重逐步下降。其中在200 mmol·L-1NaCl时,轻度、中度干旱和盐分双重胁迫下,乌拉尔甘草株高,地上鲜、干重和根鲜、干重与对照组相比,无显著差异(P>0.05);在400 mmol·L-1NaCl时,轻度与中度干旱处理之间无显著差异(P>0.05);在600 mmol·L-1NaCl时,各处理组显著降低(P<0.05)。

表2 旱盐双重胁迫对乌拉尔甘草株高的影响Table 2 Effect of drought and salt stress on the height of Glycyrrhiza uralensis
同列不同小写字母表示不同处理间显著差异(P<0.05),A1B,A2B,…,A3D同表1,下同。
Different lowercase letters within the same column indicate significant difference between different treatments at the 0.05 level. A1B…A3D were same as Table 1; similarly for the following figures.

表3 旱盐双重胁迫下乌拉尔甘草地上部分生长量的变化Table 3 The changes in the shoot biomass of Glycyrrhiza uralensis under drought and salt stress
2.2 旱盐双重胁迫下甘草叶片有机渗透调节物质含量的变化
旱盐双重胁迫处理下,甘草叶片脯氨酸含量和可溶性糖含量均高于对照(表5)。在旱盐双重胁迫下,随胁迫时间延长,甘草叶片脯氨酸含量和可溶性糖含量变化趋势不同,A2D处理组呈先上升后下降趋势,A3D处理组持续下降,其余各处理组均表现出逐渐上升的趋势。25 d时,脯氨酸含量在重度干旱和重度盐胁迫A3D处理组达到最大值;在75 d时,可溶性糖含量在重度干旱和中度盐胁迫A3C处理组达到最大值。轻度、中度干旱胁迫中,随盐分含量增加,甘草幼苗脯氨酸含量和可溶性糖含量明显升高,差异显著(P<0.05);重度干旱胁迫中,随着盐分含量增加,除75 d 时可溶性糖含量先升后降外,其余各处理组甘草幼苗脯氨酸含量和可溶性糖含量均呈上升趋势,各处理组间总体上差异不显著(P>0.05)。在同等盐分胁迫下,其中轻度、中度盐分处理中,随干旱胁迫增加,甘草幼苗脯氨酸含量和可溶性糖含量呈增长趋势,但A1B与A2B、A1C与A2C间甘草幼苗脯氨酸含量和可溶性糖含量无显著差异(P>0.05);重度盐分处理中,随干旱胁迫增加,脯氨酸含量和可溶性糖含量变化没有明显的规律性。

表4 旱盐双重胁迫下乌拉尔甘草地下部分生物量变化Table 4 The changes in the root biomass of Glycyrrhiza uralensis under drought and salt stress
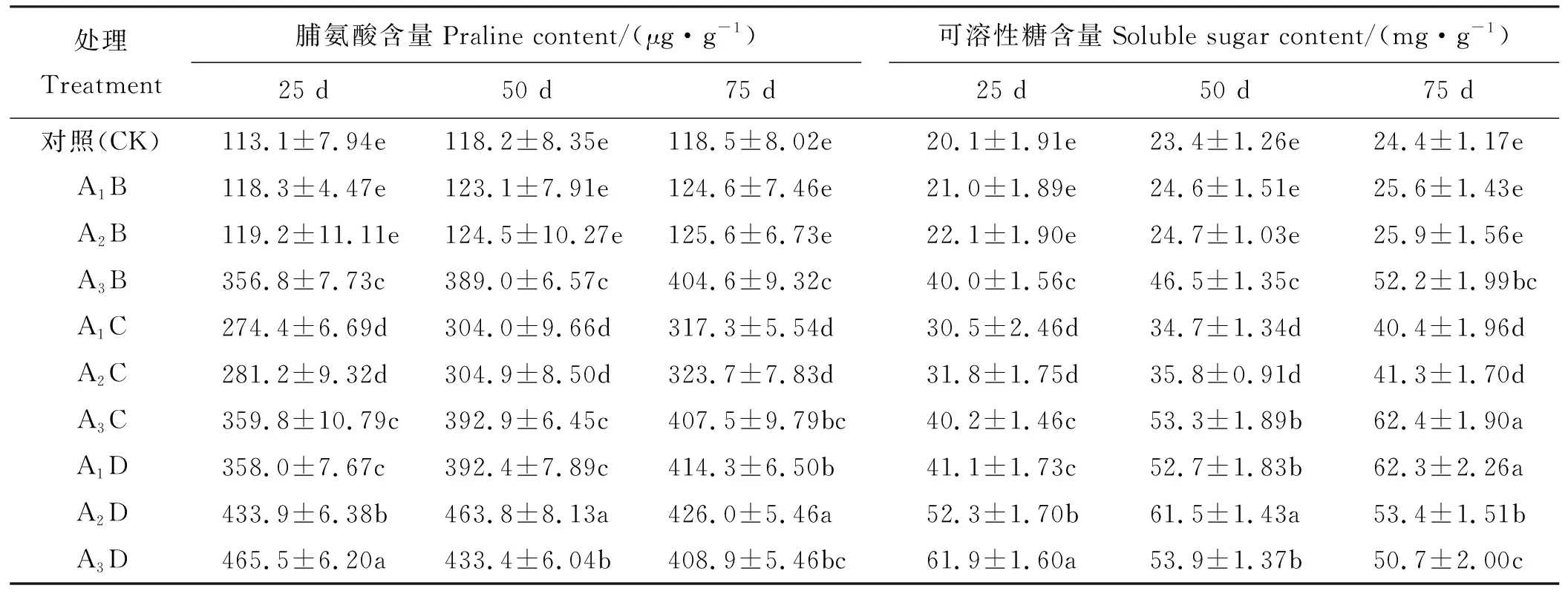
表5 旱盐双重胁迫下乌拉尔甘草脯氨酸和可溶性糖含量的变化Table 5 The changes in the content of proline and soluble sugar in Glycyrrhiza uralensis under drought and salt stress
2.3 旱盐双重胁迫下甘草叶片SOD活性、MDA含量的变化
旱盐双重胁迫处理下,甘草叶片SOD活力和MDA含量均高于对照(表6)。在旱盐双重胁迫下,随胁迫时间延长,在A2B、A3B、A1C、A2C处理组,乌拉尔甘草叶片SOD活力呈上升趋势,在A3C、A1D、A2D处理组呈先上升后下降趋势,在A3D处理组中呈下降趋势,MDA含量随胁迫时间延长则持续呈上升趋势。50 d时,SOD活力在中度干旱和重度盐胁迫时达到最大值; 75 d时,MDA含量在重度干旱和重度盐胁迫时达到最大值。在同等干旱胁迫下,轻度和中度干旱胁迫中,随着盐分浓度上升,甘草幼苗叶片SOD活力与MDA含量持续上升,差异显著(P<0.05);而重度干旱处理中,甘草幼苗叶片SOD活力变化趋势不统一, 25 d时SOD活力在A3B与A3C之间无显著差异(P>0.05);在50、75 d时在A3C与A3D之间无显著差异。MDA含量则持续上升,但在A3B与A3C之间无显著差异(P>0.05)。轻度、中度盐分处理中,随干旱胁迫增加,甘草SOD活力与MDA含量呈增长趋势,但A1B与A2B、A1C与A2C之间无显著差异(P>0.05);重度盐分处理中,随干旱胁迫增加,SOD活力变化没有明显的规律性,MDA含量则持续上升,差异显著(P<0.05)。
2.4 旱盐双重胁迫下甘草原生质体DNA损伤的变化
旱盐双重胁迫处理下,甘草原生质体DNA尾长、尾矩、Olive尾矩均高于对照(表7)。在旱盐双重胁迫下,随胁迫时间延长,除A1B处理组DNA尾矩外,其余各处理组乌拉尔甘草原生质体DNA尾长、尾矩、Olive尾矩均呈增长趋势。75 d、重度干旱、600 mmol·L-1NaCl时DNA尾长、Olive尾矩达到最大值。轻度、中度干旱胁迫下,随盐分含量增加,甘草幼苗原生质体DNA尾长、尾矩、Olive尾矩明显升高,差异显著(P<0.05);重度干旱胁迫下,随着盐分含量增加,A3B、A3C、A3D各组甘草幼苗原生质体DNA尾长、尾矩、Olive尾矩也呈上升趋势,但A3B、A3C处理组之间差异不显著(P>0.05),显著低于A3D (P<0.05)。同等盐分含量处理中,随干旱胁迫增加,甘草幼苗原生质体DNA尾长、尾矩、Olive尾矩持续增加,其中A1B和A2B、A1C和A2C处理组之间甘草幼苗原生质体DNA尾长、尾矩、Olive尾矩变化无显著差异(P>0.05),其余各处理组均差异显著(P<0.05)。

表6 旱盐双重胁迫下乌拉尔甘草地下SOD活性和MDA含量的变化Table 6 The changes in SOD activity and MDA content in Glycyrrhiza uralensis under drought and salt stress

表7 旱盐双重胁迫下对乌拉尔甘草原生质体DNA损伤的变化Table 7 The changes in protoplast DNA in Glycyrrhiza uralensis under drought and salt stress
3 讨论与结论
植物生存的环境经常受到复杂多变的逆境胁迫[13-14]。在各种非生物胁迫逆境中,干旱胁迫、盐胁迫对植物的影响尤为突出[15-16]。西北干旱半干旱地区,降水量小,蒸发量大,溶解在水中的盐分容易在土壤表层积聚,植物往往受干旱和盐渍的共同胁迫。因此探讨西北地区植物在干旱和盐双重胁迫下的适应性具有较强的实用性。
植物在受到环境胁迫时,可以通过改变植株形态,并产生相应的生理响应来适应环境胁迫[17-18]。生长抑制是植物对环境胁迫最敏感的生理响应[19]。生物量的测定结果表明,旱盐双重胁迫下,乌拉尔甘草株高,地上鲜、干重,地下鲜、干重均下降,说明旱盐双重胁迫对乌拉尔甘草的正常生长产生了抑制作用。同等盐分胁迫下,在200 mmol·L-1NaCl时,轻度、中度干旱,乌拉尔甘草生长量与对照相比无显著差异,表明甘草具有一定适应旱盐土壤环境的能力。在盐分因子小于400 mmol·L-1NaCl时,轻度与中度干旱处理之间乌拉尔甘草生长量无显著差异,说明适度盐分胁迫在一定程度上增强了甘草抗旱能力。
植物体内两种重要的有机渗透调节物质为脯氨酸和可溶性糖。逆境胁迫时,植物可通过增加脯氨酸和可溶性糖的含量,提高细胞液浓度,降低其渗透势,来适应胁迫环境[20]。本研究结果表明,旱盐双重胁迫处理下,甘草叶片脯氨酸含量和可溶性糖含量均高于对照。在旱盐双重胁迫下,随胁迫时间延长,除A2D处理组乌拉尔甘草叶片脯氨酸含量和可溶性糖含量先上升后下降,A3D处理组持续下降外,其余各处理组均上升,表明在小于400 mmol·L-1NaCl时,甘草可以通过增加脯氨酸和可溶性糖的积累,来降低细胞渗透势,从而抵御旱盐逆境。但乌拉尔甘草对旱盐双重胁迫的生理调节存在一定的阈值。当大于400 mmol·L-1NaCl时,脯氨酸和可溶性糖的积累便会降低,甘草的渗透调节能力减弱,细胞处于失水状态,甘草的正常生长受到了影响。虽然,甘草幼苗受到脯氨酸和可溶性糖的共同渗透调节作用,但二者最大值出现的时间、胁迫程度并不同步,说明在旱盐双重胁迫中,二者的调节作用有差异性。二者在旱盐胁迫中对甘草幼苗的渗透调节的协同性以及作用差异性还有待进一步开展研究探讨。
植物在逆境胁迫下,产生大量的自由基,对植物细胞膜造成过氧化损伤[21],过量的自由基还导致植物体内的蛋白质、DNA受到严重损伤[22]。在逆境胁迫条件下,植物则会激活抗氧化酶系统,清除或降低自由基的产生,缓解自由基积累对植物造成的伤害[23]。旱盐双重胁迫处理下,甘草叶片SOD活力和MDA含量,原生质体DNA尾长、尾矩、Olive尾矩均高于对照。旱盐双重胁迫处理下,随胁迫时间延长,在A2B、A3B、A1C、A2C处理组,乌拉尔甘草叶片SOD活力上升,在A3C、A1D、A2D处理组先上升后下降,而在A3D处理组中下降。但在旱盐双重胁迫下,MDA含量随胁迫时间延长持续上升,同时乌拉尔甘草原生质体DNA尾长、尾矩、Olive尾矩也均增加,表明在小于400 mmol·L-1NaCl时,轻度、中度干旱胁迫下,乌拉尔甘草能够通过提高自身SOD活性来清除细胞内多余的自由基,此时MDA含量虽然增加,但增幅不大,因此对膜系统的毒害较小。但在大于400 mmol·L-1NaCl或重度干旱胁迫时,SOD活性增加的速度低于自由基产生的速度,抗氧化酶不足以清除体内的自由基,MDA含量增幅加快而大量积累,此时对膜系统的破坏程度加重,甘草幼苗的生长受到了严重影响。说明在旱盐双重胁迫下,甘草可以通过提高抗氧化酶活性来抵抗旱盐胁迫造成的伤害,但同时也说明抗氧化酶的调节能力是有一定限度的。
轻度、中度干旱胁迫下,随盐分含量增加,甘草生长量明显降低,脯氨酸含量和可溶性糖含量、叶片SOD活力与MDA含量,以及原生质体DNA尾长、尾矩、Olive尾矩显著升高,表明轻度、中度干旱胁迫下,相对于干旱,盐分是影响甘草生长量的主导因子。重度干旱胁迫下,随着盐分含量增加,上述指标变化趋势不规律,可能是在重度干旱胁迫下,甘草生理生化代谢已经紊乱。
综上所述,乌拉尔甘草具有适应一定程度的旱盐胁迫能力,其适宜的胁迫条件为盐分因子小于400 mmol·L-1NaCl,中度干旱胁迫(田间最大持水量的40%~45%)。在其受到旱盐双重胁迫时,脯氨酸和可溶性糖可降低细胞的渗透势,来缓解旱盐双重胁迫造成的生理代谢不平衡;还可以通过改善或提高抗氧化能力,来缓解氧化与抗氧化失衡以减轻旱盐胁迫对其生长发育的影响。
环境胁迫对植物的影响复杂多样,本研究只是探讨了旱盐双重胁迫对甘草幼苗阶段生理生化特性的影响,不能反映整个生育期相关生理生化指标变化情况,而在环境胁迫下植物体内的反应是复杂多变的,其相关规律还有待进一步研究。
