草鱼肌肉中呋喃唑酮代谢物AOZ检测能力 验证样品的制备研究
2018-09-18田娟娟甘金华李晋成
田娟娟,甘金华,彭 婕,李晋成,刘 欢
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院,北京 100141; 3.农业部水产品质量安全控制重点实验室,北京 100141; 4.中国水产科学研究院长江水产研究所,武汉 430223)
呋喃唑酮(Furazolidone,FZD)属于硝基呋喃类抗菌剂的范畴,在水产养殖中曾被广泛应用于治疗鱼类疾病或细菌引起的其它疾病[1]。FZD的代谢产物 3-氨基-2-恶唑烷酮 (3-amino-2-oxazolidinone,AOZ)半衰期较长,具有致畸胎和致突变的副作用,且能诱发癌症[2-4]。美国、欧盟等其他国家和地区均禁止FZD作为兽药使用[2,5,6]。我国农业部公告规定禁止在食用动物上使用FZD等硝基呋喃类药物(193号令[7]),但实际养殖、运输、暂存等生产和流通过程中,仍有大量违规使用FZD的行为。AOZ等硝基呋喃类药物代谢物仍然是水产品质量安全的重点监管对象,从近年来国家认监委、农业部等部门组织开展的水产品药物残留检测能力验证看,AOZ等硝基呋喃类代谢物是每年必考的指标之一。
能力验证是评估实验室检测能力的重要手段和途径,而能力验证样品的成功研制保证了该项目的顺利进行。能力验证样品制备一般有两种方法,自然机体污染法和空白基质加标法。前者是是将药物直接饲喂或药浴动物,得到含有药物的阳性样品,后者是将药物标准溶液添加至空白样品中[8]。两种方法得到的样品在检测难易程度上存在很大差别,前者目标检测物是与动物体内的蛋白相结合,存在“内化”的情况,后者是目标检测物仅附着在考核样品表层。自然机体污染法制备的能力验证样品更接近于真实样品,更能反映出检测人员的监测水平。采用自然机体污染法制备样品时,样品中目标物残留浓度要在适当水平,如果目标物残留浓度过高,分析时易污染仪器设备,可能达不到区分各实验室检测能力的目的;如果目标物残留浓度过低,分析变异系数大,增加实验室操作难度,不易出现具有统计学意义的结果[9]。有研究表明,在以活体动物为基础的能力验证样品制备上,影响因素很多,包括给药方式、给药浓度、水温、养殖时间等养殖条件、养殖品种、规格等因素[10-12],但是关于如何控制上述因素以实现能力验证考核样品需要的药物残留浓度还鲜有报道。因此,本文研究了水温、药浴时间等因素对草鱼肌肉中呋喃唑酮代谢物残留浓度的影响,并以肌肉基质中残留浓度为8 μg/kg和25 μg/kg为目标,确定草鱼基质中呋喃唑酮代谢物残留检测能力验证样品的养殖试验条件,为后续水产品中呋喃唑酮代谢物AOZ残留检测能力验证样品的制备提供参考。
1 材料与方法
1.1 材料与试剂
草鱼(购于湖北省武汉市洪山区茅店社区万达菜市场,不同批次),随机取样,经HPLC-MS检测,未检出呋喃唑酮代谢物;活跃状态良好,规格大小均一(900~1 100g/尾)。给药前暂养于消毒后的水箱中,水温(25±1)℃,不间断增氧,不投饵,每天换1次水,暂养1~2 d,剔除不健康、受伤的草鱼(有明显伤痕)后用于实验。
呋喃唑酮原料药(梯希爱(上海)化成工业发展有限公司,纯度>98%,实际纯度97.74%);AOZ标准物质(德国Dr.Ehrenstorfer公司,纯度99%);AOZ-D4同位素内标(德国Dr.Ehrenstorfer公司,纯度99%);乙腈(色谱纯,美国J.T.Baker公司);甲醇(色谱纯,美国J.T.Baker公司);乙酸乙酯(色谱纯,美国J.T.Baker公司);醋酸铵(分析纯,美国J.T.Baker公司);二甲亚枫(Tedia 公司);2-硝基苯甲醛(EU);K2HPO4(分析纯,国药集团化学试剂有限公司,纯度≥99%);盐酸(优级纯,信仰市化学试剂厂)。
1.2 仪器与设备
高效液相色谱-串联质谱仪(Thermo公司);分析天平(Mettler Toledo);旋涡混合器(北方同正,型号HQ-60-Ⅱ);高速冷冻离心机(上海安亭科学仪器厂,GL-20B);氮吹仪(上海川翔生物科技有限公司,KD200);飞利浦搅拌器;药浴池为方形玻璃水族箱,规格尺寸分别为长135.7 cm×宽57 cm×高54 cm;长69 cm×宽57 cm×高54 cm;
1.3 实验方法
1.3.1 养殖条件的确定
1.3.1.1 药浴时间的确定
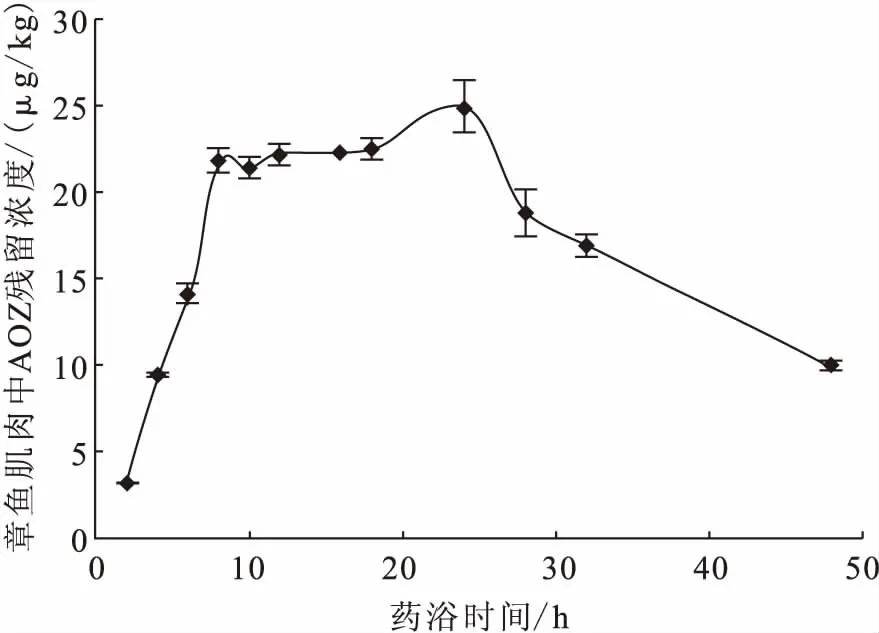
药浴初始浓度为97.98 μg/L,药浴池中水温保持在(25±1)℃,一次放入草鱼35尾,以空气泵持续增氧,连续药浴24 h后100 %换水。样品采集点分别为药后2、4、8、10、12、16、18、24、28、32、48 h,每个时间点随机取草鱼3尾,3尾作为一个样品。每个时间捕捞的草鱼立即处死,去皮,取其背部肌肉,捣碎匀浆,装入PE自封袋中,于-20 ℃冷冻保存,以备检测分析AOZ残留量,同一样品平行测定3次,取其平均值作为各时间点肌肉中AOZ的残留浓度。
1.3.1.2 药浴温度的确定
两组试验水温分别保持在(25±1)℃和(20±1)℃,高温组和低温组各放草鱼35尾,以空气泵持续增氧,连续药浴24 h后100 %换水。呋喃唑酮药浴初始浓度、采样点等操作均与样品中AOZ含量的检测“1.3.1.1 ”保持一致。
1.3.2 草鱼肌肉中AOZ含量(y)与药浴初始浓度(x)相关性研究及验证
1.3.2.1y与x关系的建立
呋喃唑酮初始药浴浓度为97.87 μg/L,药浴池中水温保持在25 ℃左右,以空气泵持续增氧,一次放入5尾。达到最佳药浴时间后,立即捕捞处死,去皮,取其背部肌肉,捣碎匀浆,装入PE自封袋中,于-20 ℃冷冻保存,以备检测分析AOZ残留量,同一样品平行测定3次,取其平均值作为该时间点肌肉中AOZ的残留浓度。根据得出的药浴最佳时间时对应草鱼体内AOZ含量y值,已知初始药浴浓度x=97.87 μg/L,建立y=kx的线性关系。
1.3.2.2y与x关系的验证
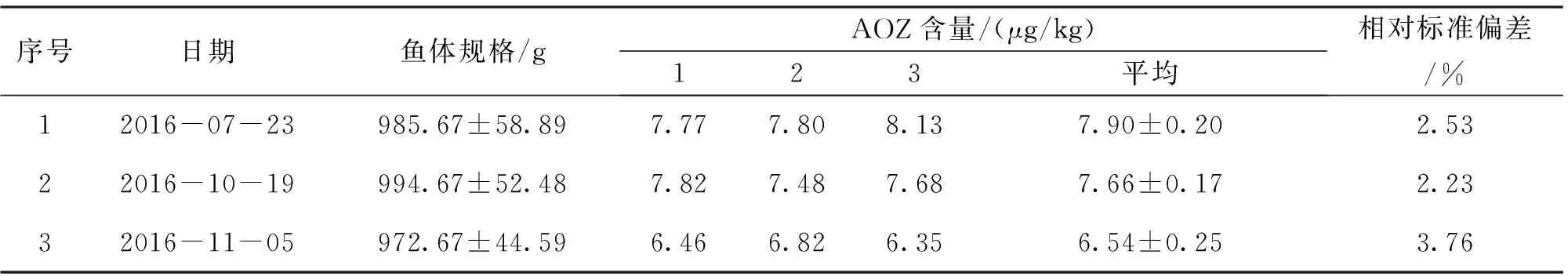
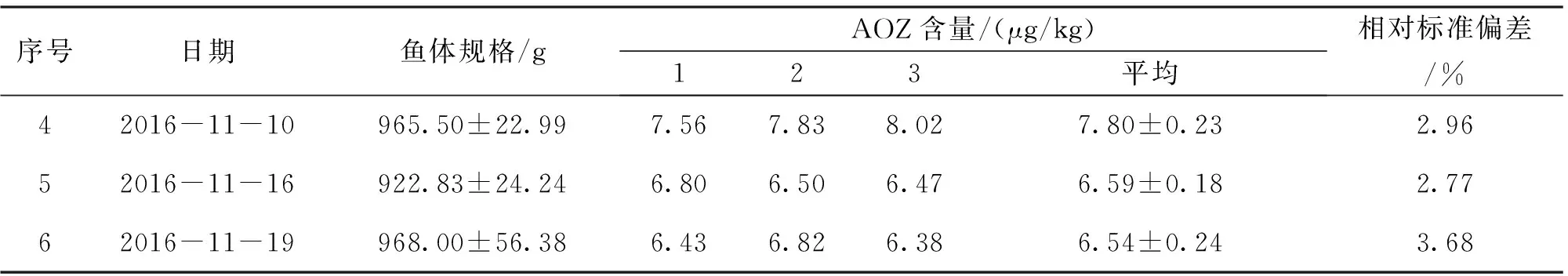
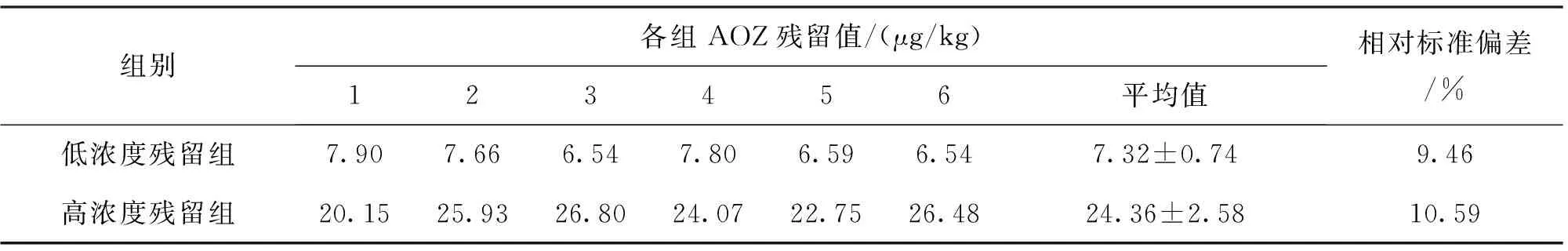
根据上述建立的关系式y=kx,即可算出预期得到药后草鱼肌肉中AOZ含量8 μg/kg和25 μg/kg分别对应的呋喃唑酮初始药浴浓度分别为36.29 μg/L和113.54 μg/L,药浴池中水温保持在25 ℃左右,药浴时间10 h,以空气泵持续增氧,每个药浴池每次放入8~9条规格统一的草鱼。随机采集两个水族箱中药浴时间为最佳时间10 h的草鱼各6尾,立即处死,去皮,取其背部肌肉,捣碎匀浆,装入PE自封袋中,于-20 ℃冷冻保存,以备检测分析AOZ残留量,同一样品平行测定3次,取其平均值作为该时间点肌肉中AOZ的残留浓度。高浓度组和低浓度组残留分别经过6个批次的平行实验,验证上述建立的关系式y=kx的正确性。
1.3.3 能力验证样品的制备
根据上述条件建立的养殖实验条件,制备草鱼肌肉中AOZ含量约为10.0 μg/kg的能力验证样品,药浴浓度为45 μg/L,药浴时间10 h,药浴温度25 ℃。从市场直接购买的活草鱼,暂养1~2 d后,剔除受伤不健康的草鱼,随机取样检测确定为阴性样品后,按照上述条件建立的养殖实验条件进行药浴、捕杀,取其背部肌肉部分,充分混合均匀,制成鱼糜。然后对制得的鱼糜进行分装,每份样品约10.0 g,共140份,-20 ℃冷冻保存,以备进一步做均匀性和稳定性检验。
1.3.4 均匀性和稳定性检验
样品均匀性和稳定性按照“能力验证样品均匀性和稳定性评价指南(CNAS-GL03)”要求进行。
1.3.4.1 均匀性检验
从制备的能力验证样品中各随机抽取10份样品进行均匀性检测,每份样品重复测定2次,分析样品中AOZ的含量。检测结果用单因素方差分析(Anova)来判断样品的均匀性。
1.3.4.2 稳定性检验
本实验对能力验证样品进行了短期稳定性和长期稳定性检测。评估稳定性研究的数据的第一步是检查数据中是否有任何观察到的趋势。对于微小的不稳定性问题,由于内在动力学机理未知,因此线性拟合是一个合适的模型,稳定性研究的基本模型可表示为[13]:
y=β0+β1x+ε
式中:β0和β1—回归系数;ε—随机误差分量;x—时间;y—样品中AOZ含量。
斜率的估计值b1可按下式计算:
截距的估计值b0可按下式计算:
直线的标准偏差S:
斜率的标准偏差S(b1):
在置信水平为95%时,如果│b1│ 1.3.4.2.1 短期稳定性 短期稳定性进行30 d,按照先密后疏的原则,选取0、3、7、15、30 d 5个时间点进行测定。每次测定随机抽取3份样品,平行测定2次,进行样品的短期稳定性分析。 1.3.4.2.2 长期稳定性 样品长期存放在-20 ℃冰箱中保存,长期稳定性为期6个月,每个月测定1次。稳定性每次测定随机抽取3份样品,平行测定2次,进行样品的短期稳定性分析。 样品中AOZ残留量分析方法按照农业部783号公告-1-2006《水产品中硝基呋喃类代谢物残留量的测定液相色谱-串联质谱法》进行[14]。 分析草鱼肌肉中AOZ残留量与药浴初始浓度的相关性。采用软件SPSS 20.0对实验数据进行单因素方差分析(Anova,P<0.05)。 标准曲线范围为0.5~100 ng/mL,高浓度样品选取0.5、1、5、10、20、50、100 ng/mL 7个浓度梯度;低浓度样品选取0.5、1、2、5、10、20 ng/mL 6个浓度梯度制备标准曲线,得到的线性方程分别为y=0.222 6x+0.035 6,y=0.223 8x- 0.047 8,相关系数r2均大于0.999。每次检测均设草鱼空白及质控样品,AOZ在空白草鱼基质中的回收率均为80%~110%,在方法规定的70%~110%范围,说明了检测结果的可靠性。 2.1.1 药浴时间的确定 草鱼肌肉中AOZ残留量每个采样点平均值随药浴时间变化趋势如图1所示。 图1 不同药浴时间下草鱼肌肉中呋喃唑酮代谢物 AOZ含量的变化Fig.1 Changes of the content of furazolidone metabolites AOZ in the muscle of grass carp under different bath time 图1 中可知,在给药后0~8 h是药物吸收的过程,草鱼肌肉中AOZ残留随着时间的延长而迅速升高,8~18 h药物吸收和消除达到一个动态平衡的过程,残留浓度变化趋势相对平缓,之后18~24 h药物残留浓度又进一步升高,24 h时残留量达到峰值,24 h后全部换水后,药物残留进入消除阶段,随着时间的推移AOZ残留浓度逐渐降低。 2.1.2 药浴温度对草鱼肌肉中AOZ残留的影响 通过在20 ℃和25 ℃两种不同水温条件下进行药浴实验,检测不同药浴时间下呋喃唑酮在草鱼肌肉中的残留量见图2。由图2可知,20 ℃条件下草鱼肌肉中AOZ的含量明显低于25 ℃条件下肌肉中AOZ含量,2~8 h 25 ℃条件下草鱼对药物的吸收速率明显高于20 ℃条件下的吸收速率,在25 ℃的条件下,8 h后药物吸收和消除达到动态平衡,24 h达到峰值,峰值浓度为(24.98±1.54)μg/kg。在20 ℃条件下,需10 h后药物吸收和消除才达到动态平衡,24 h并未出现峰值(24 h后100%换水),说明在高温鱼体代谢药物富集作用更快,低温条件下较慢,低温条件下达到峰值需要更长的时间。 图2 不同温度下草鱼肌肉中呋喃唑酮代谢物AOZ残留量Fig.2 Residual amount of furazolidone metabolite AOZ in muscle of grass carp at different temperatures 根据实验药浴初始浓度x=97.87 μg/L,10 h后捕杀,经检测草鱼肌肉中AOZ含量y=21.57 μg/kg,确定y与x的关系为y=0.22x。对线性方程y=0.22x进行6~7个批次的平行验证,检测结果见表1和表2。 表1 低浓度各批次草鱼肌肉中AOZ残留测定数据(n=3)Tab.1 Each batch of low concentrations of residual measurement data(n=3) 续表1 表2 高浓度各批次草鱼规格与肌肉中AOZ残留测定数据(n=3)Tab.2 Each batch of high concentrations of residual measurement data(n=3) 表3 批间差异计算结果(n=6)Tab.3 Interval difference calculation results(n=6) 由表1、2可知,在严格控制鱼体规格、药浴时间、水温的条件下,实际检测草鱼肌肉中AOZ低浓度残留和高浓度残留浓度值与预期得到的值存在一定偏差,但是差别不大。根据表中计算的RSD值反应样品的批间、批内差异性知批内相对标准偏差小于10%,批间相对标准偏差小于15%(表3),说明样品批间和批内差异性较小,从而验证关系式y=0.22x的可行性。 2.4.1 均匀性检测结果 样品的均匀性采用单因子方差统计分析进行评定,样品均匀性检测数据和统计分析见表4、5。 根据方差分析的原理,通过对组间与组内的均方(MS)比值F与统计检验临界值Fcrit比较,如果F值小于Fcrit,则认为各组测量值之间无系统性差异。由表5方差分析结果表明,F值均小于临界值Fcrit(9,10)=3.02,P>0.05,表明样品间不存在显著性差异,即样品是均匀性的。 表4 AOZ能力验证样品的均匀性检测数据(n=2)Tab.4 Homogeneity of AOZ proficiency testing samples detected data (n=2) 表5 样品均匀性检验单因子方差分析结果Tab.5 Result of one-way analysis of variance for AOZ homogeneity 2.4.2 稳定性检测结果 2.3.2.1 短期稳定性 表6是短期稳定测得肌肉中AOZ含量的数据及平均值,将相关数据带入上述公式计算得到b1、b0、S、S(b1),线性拟合具体分析结果见表7。查表t0.95,3=3.182,│b1│=0.014 4,t0.95,3·S(b1)=0.040 9,故│b1│ 表7 AOZ能力验证样品短期稳定数据稳定性分析结果Tab.7 The result analysis of short-term stability of AOZ proficiency sample 2.3.2.2 长期稳定性 表8 AOZ能力验证样品长期稳定性检验结果(n=6)Tab.8 Long-term stability test results of AOZ proficiency testing samples(n=6) 表9 AOZ能力验证样品长期稳定性结果分析Tab.9 The result analysis of long-term stability of AOZ proficiency sample 表8 是AOZ能力验证样品长期稳定检测数据及平均值,将相关数据带入上述公式计算得到b1、b0、S、S(b1),线性拟合具体分析结果见表 9。由表 9 可知,│b1│=0.040 3,t0.95,3·S(b1)=0.380 8,故│b1│ 由图1可知,随着药浴时间的延长,AOZ残留量逐渐升高,24 h出现峰值,8~18 h出现残留变化相对平缓的阶段,考虑到尽量减少药浴时间与实验结果的稳定性,最终确定选择药浴时间10 h。并且该曲线的变化趋势与余孔捷等[15]报道的喹诺酮类多残留自然基体标准样品制备中药浴时间确定的趋势图也是一致的。 通过研究不同温度对草鱼肌肉中AOZ残留影响,结果表明,20 ℃条件下,AOZ在草鱼肌肉中富集分布较慢,25 ℃条件下富集分布较快。该结论与Grasset J等[16]研究不同温度条件下(9、20、28 ℃)金属(镉、镍)在黄鲈肾脏中富集的浓度随温度的升高而升高以及与Björklund等[17]报道的不同温度5、10、16 ℃下土霉素在虹鳟血清中达到峰值的时间分别为24、12和1 h的结论都是一致的。Roberts等[18]认为通常水温每升高1 ℃,鱼类的代谢和消除速度将提高10%。Clarke等[19]人研究发现,热带(30 ℃)生活的鱼类代谢率大约是极地(0 ℃)生活鱼类的6倍。Whitney等[20]研究温度(23 ℃、30 ℃)对鲨鱼代谢率的影响结论也证明了鱼体代谢速率随温度的升高而加快。以上研究均表明,温度对水生动物的代谢有很大影响,水温是给药时应当考虑的一个重要因素。本研究想达到预期残留的浓度,20 ℃的水温条件下需要的药浴时间更长,综合考虑,最后确定最佳药浴温度为25 ℃。 对低浓度组数据运用SPPS 20.0统计软件进行单样本t检验(参考值为8 μg/kg)得到t值为2.419,P=0.052>0.05,表明在ɑ=0.05显著水平时,低浓度组数据不存在显著性差异;对高浓度组数据进行单样本t检验(参考值为25 μg/kg)得到t值为0.604,P=0.572>0.05,表明在ɑ=0.05显著水平时,高浓度组数据不存在显著性差异。经t检验,高、低浓度残留组两组数据均不存在显著性差异,说明实际得到的数据与预期设定数值8 μg/kg、25 μg/kg不存在显著性差异,进而说明了关系式y=0.22x的可行性。 能力验证样品的一致性对进行能力验证至关重要。在实施能力验证计划时,组织方应确保能力验证中出现的不满意结果不归咎于样品之间或样品本身的变异性。因此,对于能力验证样品的检测特性量,特别是以活体动物制备的能力验证样品,必须进行均匀性检验和稳定性检验[21]。由上述分析结果可知,制备样品内和样品间的均匀性无显著性差异,在6个月内稳定性合格,满足能力验证的要求。 本文以草鱼为基质,研究了能力验证样品制备中温度、时间与草鱼肌肉中最终药物残留的浓度关系,结果显示在鱼体规格900~1100 g之间,水温25 ℃,药浴10 h的条件下初始药浴浓度x与草鱼肌肉中AOZ残留浓度y之间的关系为y=0.22x,并且经过多次验证,也证明了此关系式的正确性。并且运用建立起的关系式y=0.22x,制备出残留量为10 μg/kg左右的能力验证样品,并对样品的均匀性和稳定性进行评价,经检测样品均匀性和稳定性良好,符合能力验证样品的要求。1.4 AOZ残留量检测方法
1.5 数据分析统计
2 结果与分析
2.1 标准样品曲线及回收率
2.2 养殖条件的确定

2.3 y与x的相关性及验证

2.4 均匀性和稳定性检测结果分析





3 讨论
3.1 药浴时间对草鱼肌肉中AOZ残留的影响
3.2 温度对草鱼肌肉中AOZ残留的影响
3.3 y与x相关性验证
3.4 均匀性与稳定性
4 结论
