雌、孕激素对人子宫内膜腺癌Ishikawa细胞系中TMEM16A的表达调节
2018-09-17杨一凡谢青贞
杨一凡,谢青贞
(武汉大学人民医院生殖医学中心,湖北省辅助生殖与胚胎发育医学临床研究中心,武汉 430060)
跨膜蛋白16A(TMEM16)属于“未知功能的跨膜蛋白16”一族,因其家族为阴离子通道(anion)并预测有8个跨膜区片段(octa),故其又称为anoctamin 1(ANO1)。TMEM16A的基因定位于人类染色11q13区域,此区域的很多基因在上皮类癌症如乳腺癌、肺癌和口腔上皮癌中高表达,因此在被确认为钙激活氯离子通道(CaCCs)的分子基础之前,TMEM16A主要在肿瘤的发生、发展等相关研究中被大家熟知[1-2]。2008年CELL、SCIENCE和NATURE三个顶级期刊同时确定了TMEM16A为CaCCs的分子基础,自此其作为CaCCs分子基础的相关研究得以展开[3-5]。现已知TMEM16A在唾液腺、气管、血管平滑肌、胃肠道等多种器官和组织中广泛表达,并在多种生理反应过程中起着重要的作用[6-9]。在生殖道中,TMEM16A被发现在小鼠利用特异性氯通道抑制剂能明显减弱小鼠子宫平滑肌的自发性收缩;在小鼠卵巢颗粒细胞的质膜上同样发现了TMEM16A的存在,通过激活MEK/ERK途径从而下调芳香化酶的表达进而抑制雌激素的合成[10];TMEM16A还可能参与了输卵管对精子、卵母细胞和受精卵的运输过程[11]。虽然TMEM16A在以上生殖道组织和器官中被证实表达并发挥一定的生理功能,但在正常人子宫内膜上的表达及其相关功能研究却鲜有报道。目前仅有我们前期的研究结果显示TMEM16A在人正常月经周期子宫内膜增殖期和分泌期呈差异性表达[12],提示其可能受雌、孕激素的调节,参与子宫内膜容受性的建立。本研究拟通过体外实验探讨雌、孕激素在子宫内膜腺癌Ishikawa细胞系中对TMEM16A的表达调节。
材料和方法
一、主要材料和试剂
人子宫内膜腺癌Ishikawa细胞系由华南农业大学杨增明教授馈赠。无酚红RPMI-1640培养基(Hyclone,美国)、胎牛血清(Gibco,美国)、Q-PCR逆转录试剂盒(Takara Bio,日本)、SYBR Premix Ex Taq试剂盒(Takara Bio,日本)、兔抗人多克隆TMEM16A一抗(Abcam ab72984,英国)和山羊抗兔二抗(ASPEN AS1107,武汉)、BCA蛋白浓度测定试剂盒(碧云天生物,上海)、5×蛋白上缓冲液(赛维尔生物,武汉)、内参β-actin(赛维尔生物,武汉)、雌二醇(E2,Sigma,美国)、孕酮(P4,Sigma,美国)。
二、实验方法
1.子宫内膜腺癌Ishikawa细胞系培养和分组:子宫内膜腺癌Ishikawa细胞系为贴壁细胞,细胞复苏后置于10%胎牛血清的无酚红RPMI-1640培养基中,37℃、5%CO2培养。稳定传代,将细胞按2×106个/孔的密度均匀种在6孔板上,培养24 h,用含0.5%炭吸附胎牛血清的无酚红RPMI-1640饥饿处理,24 h后根据实验目的和实验方法对细胞进行分组和相应处理。
2.免疫荧光(Immunofluorescence)检测TMEM16A在子宫内膜腺癌Ishikawa细胞系中的定位:将细胞按2×105个/cm2的密度种在有无菌盖玻片的6孔板中,置于10%胎牛血清的无酚红RPMI-1640培养基中,37℃、5% CO2培养。待细胞融合度达到40%~50%后,用预温的PBS洗涤盖玻片3次,每次5 min。用4%多聚甲醛室温固定30 min,其后,小心取出盖玻片,放入封闭液,37℃,60 min。轻轻甩掉封闭液,在玻片上滴加用PBS配好的兔抗人多克隆抗体TMEM16A一抗(1∶200),玻片平放于湿盒内4℃孵育过夜。玻片置于PBS中在摇床上晃动洗涤3次,每次5 min。玻片稍微甩干后加入山羊抗兔二抗(1∶200),避光室温孵育60 min。将玻片置于PBS中在摇床上晃动洗涤3次,每次5 min,稍甩干后滴加DAPI染色,避光室温孵育10 min。荧光封片液封片后置于倒置显微镜下观察并采集图片。
3.实时荧光定量(Q-PCR)检测各组TMEM16A mRNA在人子宫内膜腺癌Ishikawa细胞系中的表达:细胞饥饿处理24 h后,将细胞分为E2组、P4组、E2+P4组和空白对照组。E2组加入10-8mol/L E2;P4组加入10-6mol/L P4;E2+P4组加入10-8mol/L E2和10-6mol/L P4;空白对照组加入0.1%二甲基亚砜(DMSO)。各组分别培养48 h后,吸去培养基,PBS洗涤3次,按Trizol试剂说明提取各组细胞的总RNAs,测定各组总RNAs浓度和OD值,若OD值在1.8~2.2之间,取1 μg各组总RNA,按照逆转录说明书,利用逆转录试剂盒去除基因组DNA,总体系为10 μl。随后对总RNAs进行逆转录反应,反应体系为20 μl,逆转录后的cDNA进行Q-PCR检测,实验独立重复3次。Q-PCR所用引物见表1。
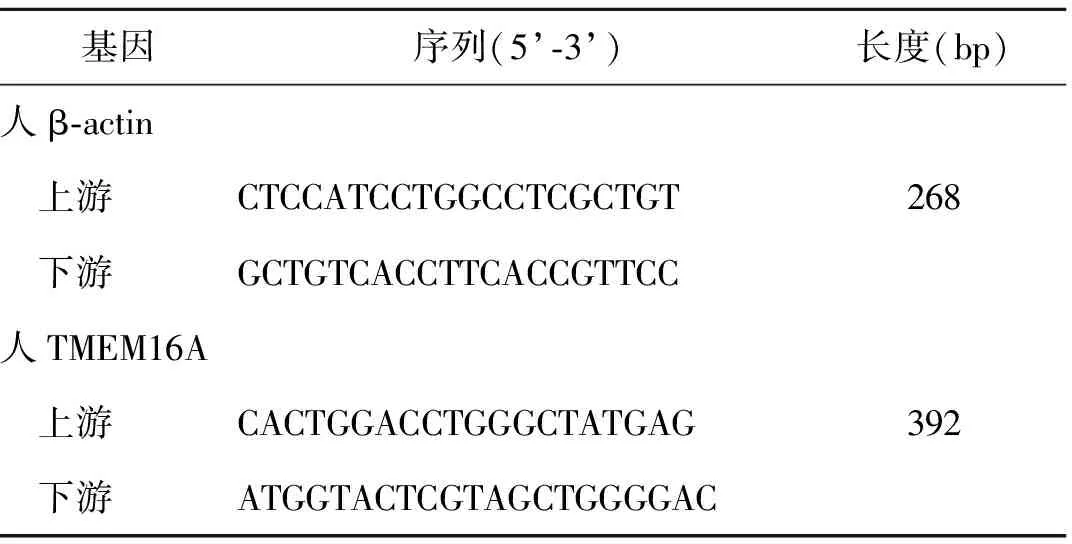
表1 Q-PCR所用引物
4.Western blotting检测各组TMEM16A蛋白质在人子宫内膜腺癌Ishikawa细胞系中的表达:细胞饥饿处理24 h后,将细胞分为E2组、P4组、E2+P4组和空白对照组。E2组加入10-8mol/L E2;P4组加入10-6mol/L P4;E2+P4组加入10-8mol/L E2和10-6mol/L P4;空白对照组加入0.1% DMSO。各组分别培养48 h,用TBS缓冲液润洗贴壁细胞2~3次,最后一次尽量吸干残留液。加入80 μl的细胞总蛋白提取试剂于6孔板内裂解3~5 min。用细胞刮刀将细胞刮下,收集到1.5 ml离心管中。冰浴30 min,4℃13 000g离心5 min,收集上清,即为总蛋白溶液。采用BCA蛋白浓度测定试剂盒检测样品的蛋白浓度,加入适量5×蛋白上缓冲液后煮沸8 min使蛋白变性,使用12% SDS-PAGE凝胶电泳分离蛋白样本,然后将凝胶上分离的蛋白电转至PVDF膜上,5%脱脂奶粉封闭1 h,分别滴加兔抗人TMEM16A多克隆抗体一抗(1∶1 000),内参β-actin(1∶1 000),均4℃孵育过夜。PBS漂洗3遍后,二抗室温孵育1 h(1∶5 000),再次用PBS漂洗3遍,使用Odyssey红外荧光扫描成像系统扫膜并分析条带。实验独立重复3次。
三、数据统计学分析
采用SPSS 23.0软件,计量资料多组比较采用单因素方差分析(One-way ANOVA),两组计量资料比较采用非配对t检验,P<0.05表示差异具有统计学意义。
结 果
一、TMEM16A蛋白质在子宫内膜腺癌Ishikawa细胞系中的定位
免疫荧光结果显示Ishikawa细胞的细胞核被DAPI染成蓝色(图1A);TMEM16A蛋白质在Ishikawa细胞的细胞膜、细胞质及细胞核上均有表达,且主要集中在细胞膜上(图1B)。
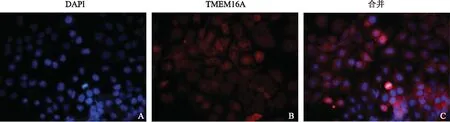
A:DAPI染色的细胞核(×200);B:TMEM16A染色(×200);C:细胞核和TMEM16A合并(×200)图1 TMEM16A蛋白质在子宫内膜腺癌Ishikawa细胞系中的荧光染色结果
二、E2、P4对人子宫内膜腺癌Ishikawa细胞系中TMEM16A mRNA表达的影响
Q-PCR结果显示了E2和P4对人子宫内膜腺癌Ishikawa细胞系中TMEM16A mRNA表达的影响(图2)。与空白对照组相比,不论是E2组、P4组或E2+P4组均可显著提高Ishikawa细胞系中TMEM16A mRNA的表达水平(P<0.01)。其中,E2+P4组TMEM16A mRNA的表达水平较E2组和P4组显著升高(P<0.01);P4组TMEM16A mRNA的水平较E2组显著升高(P<0.01)。
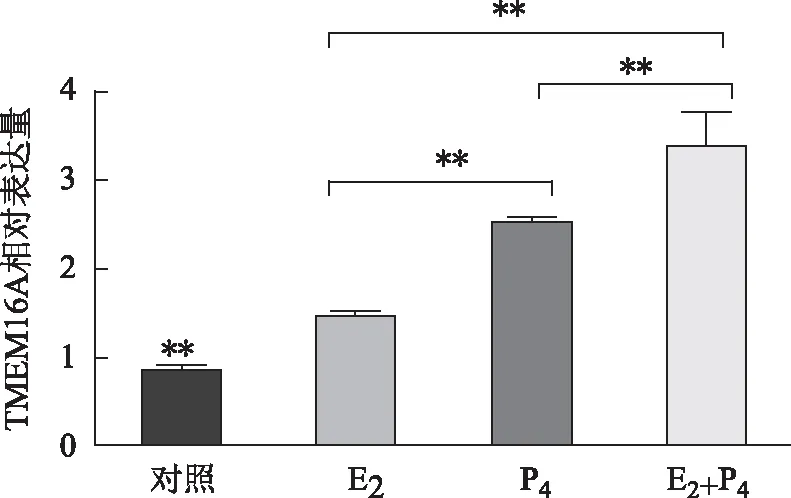
图2 各组TMEM16A mRNA在子宫内膜腺癌Ishikawa细胞系中的表达水平,**P<0.01
三、E2、P4对人子宫内膜腺癌Ishikawa细胞系中TMEM16A 蛋白质表达的影响
Western blotting结果显示了E2和P4对人子宫内膜腺癌Ishikawa细胞系中TMEM16A 蛋白质表达的影响(图3)。与空白对照组相比,E2组、P4组或E2+P4组均可显著提高Ishikawa细胞中TMEM16A蛋白的表达水平(P均<0.05)。其中,E2+P4组TMEM16A 蛋白的表达水平较E2组和P4组均显著升高(P均<0.05)。P4组TMEM16A 蛋白水平较E2组高(P<0.05)。

图3 各组TMEM16A 蛋白质在子宫内膜腺癌Ishikawa细胞系中的表达及水平比较,*P<0.05,**P<0.01
讨 论
Ishikawa细胞系是高分化的人子宫内膜腺癌细胞,因其具有E2、P4受体以及正常子宫内膜上皮细胞的相关特性而被用于子宫内膜上皮细胞功能的相关研究[13-14]。TMEM16A现已被证实存在于多种组织和器官中,但在子宫内膜中的表达和相关功能尚不明确。目前,仅有我们前期的研究结果显示TMEM16A在人正常月经周期不同时期的子宫内膜中存在表达差异,并可能受E2、P4的调节。
为了进一步确定TMEM16A在子宫内膜细胞中的表达以及受E2、P4的调节作用,我们在体外培养的Ishikawa细胞系中,首先利用免疫荧光确定了TMEM16A在Ishikawa细胞系上存在表达,且主要定位于细胞膜上。
子宫内膜受卵巢甾体激素E2和P4的影响而发生周期性的变化。在E2、P4的作用下,包括信号转导分子、粘附分子、各种细胞因子和生长因子等在内的许多分子在不同时期的子宫内膜中呈时空特异性表达。E2、P4对细胞功能的调节主要通过以下两条途径,即经典的基因组学途径和非基因组学途径。基因组学途径又称慢作用途径,E2、P4通过与胞内的受体结合后进入细胞核,与特定的DNA序列结合后,上调或下调相关基因的表达;非基因组学途径下,雌、孕激素可与细胞膜上相应的受体结合,激活细胞内的Ca2+作为第二信使,完成信号传递,使E2、P4在短期内产生效应[15]。另有研究证明,E2、P4还可以通过非基因组学效应激活细胞内Ca2+的释放[16-17]。当胞浆内的Ca2+达到一定的浓度时,TMEM16A作为CaCCs的分子基础,与Ca2+结合激活CaCCs,从而氯离子通道开放。但TMEM16A与Ca2+的相关结合位点及激活的相关机制仍不明确。基于以上的研究发现,我们推测当E2、P4与子宫内膜细胞上的相应受体相结合时,可以激活胞浆内Ca2+的释放,Ca2+又作为第二信使参与E2、P4对细胞的调节。
为了确定E2和P4对Ishikawa细胞系中TMEM16A的表达具有调节作用,我们在体外培养Ishikawa细胞系中分别用E2、P4和E2+P4进行干预处理48 h,其后,通过Q-PCR技术和Western blotting技术检测Ishikawa细胞系中TMEM16A mRNA和蛋白的表达情况。实验结果显示,与空白对照组相比,不论是E2、P4单独处理或E2+P4联合处理均可显著提高Ishikawa细胞系中TMEM16A mRNA的表达(P均<0.05)。E2+P4组TMEM16A的表达最高,与E2或P4单独处理相比有显著性差异(P均<0.01),并且P4组TMEM16A的表达高于E2组(P<0.01)。Western boltting结果显示TMEM16A蛋白质的变化趋势与mRNA的变化趋势基本一致。以上结果说明在Ishikawa细胞系中TMEM16A的表达水平受到E2和P4的调节,两种激素同时作用时表达水平最高,提示P4的调节作用有可能大于E2,但仍需进一步研究确定。
当子宫内膜处于分泌中、晚期时(月经第20~24天),E2和P4的分泌达到高峰,此时子宫内膜容受性最高,只在这个特定的时期,活化的胚胎才能在子宫内膜上进行定位、粘附和侵入,顺利完成着床,这个特定的时期成为“窗口期”。“窗口期”在E2和P4的协同调控下,生长因子、粘附分子等诸多因子被激活并相互对话,包括白血病抑制因子(LIF)和整合素av β3等子宫内膜容受性标志性分子在此阶段呈高表达状态。
综上,本研究结果提示TMEM16A可能作为胚胎着床的关键信号分子之一参与子宫内膜容受性的建立,也有可能是雌、孕激素通过非基因组学途径刺激胞内Ca2+的释放,导致TMEM16A的激活,这仍需进一步研究。
