结直肠癌及腺瘤患者CD4+、CD8+和CD28+T淋巴细胞的亚群变化及临床意义
2018-09-15邱思芳汪煜鹏牟兰兰
张 泉,邱思芳,赵 逵,朱 蓉,汪煜鹏,张 海,牟兰兰
遵义医学院附属医院消化内科,贵州遵义 563000
结直肠癌(colorectal cancer,CRC)是一种严重影响患者生活质量的疾病[1],其发病年轻化,发病率、死亡率飙升等现状给社会带来巨大负担,不断威胁着公众的健康。近年来,有研究发现[2-3],CRC的发生与肿瘤微环境(tumor microenvironment,TME),尤其是T淋巴细胞功能耗竭与肿瘤的免疫逃逸有关。由于正常的免疫功能与T细胞有重要联系,故本研究主要探讨CRC及其癌前病变腺瘤(colorectal adenomas)中T细胞亚群的变化及其临床意义。
1 资料和方法
1.1 研究对象
100例CRC(癌症组)、46例结直肠腺瘤(腺瘤组)患者均经遵义医学院附属医院2016年1月—2017年12月术后病理确诊,CRC男性51例,女性49例,年龄25~87岁,平均(57.09±11.38)岁。纳入者均为术后病理学确诊为CRC、结直肠腺瘤者。合并其他恶性肿瘤、合并多原发肿瘤、腺癌合并腺瘤者、人类免疫缺陷病毒(HIV)感染者、患有免疫性疾病或风湿性疾病、有服用免疫抑制剂和激素类药物者、有严重感染及急慢性炎性反应疾病及因其他疾病进行放化疗者均被排除。
1.2 主要试剂与仪器
CD4、CD8和CD28抗体均购自基因科技(上海)股份有限公司,双色CD4PE/CD8FITC、双色CD8FITC/CD28PE等流式细胞术检测用抗体购自美国BD公司,其他试剂及仪器包括红细胞裂解液、OLYMPUS倒置显微镜、FACS Clibur流式细胞仪等。
1.3 方法与步骤
1.3.1 免疫组织化学检测
采用免疫组织化学S-P法。将石蜡块切片至3 μm厚,切片脱蜡,3%H2O2温育10 min,PBS液漂洗,pH为6.0柠檬酸溶液修复3 min,PBS液5 min×3次,加一抗后4 ℃冰箱过夜,复温,PBS液10 min×3次,添加二抗于37 ℃温育30 min,PBS液10 min×3次,DAB显色,苏木精复染,1%盐酸乙醇溶液分化,脱水、干燥及封片,镜检。用PBS代替一抗作阴性对照。每张切片先用低倍镜找到相关组织,再用高倍镜随机选择5个视野,根据组织细胞的染色强度和细胞数来综合评分[4]:
① 染色强度评分为0分:无染色;1分:轻度染色;2分:中度染色;3分:深度染色。② 阳性细胞数评分0分0~5%;1分:6%~25%;2分:26%~50%;3分:51%~75%;4分:>75%。最终结果为两者相乘得分为0分:阴性(记为0分);1~2分:弱阳性(记为1分);3~4分:中等阳性(记为2分);5~9分:强阳性(记为3分)。结果判读:0~1分为阴性表达,2~3分为阳性表达。结果判定:CD4+和CD8+T淋巴细胞主要定位于细胞膜,CD28+T淋巴细胞主要定位于细胞膜和细胞质,分布在单直管状腺腔之间,CD4+和CD28+T淋巴细胞呈黄色或褐黄颗粒,CD8+T淋巴细胞呈棕黄色颗粒。
1.3.2 流式细胞术检测步骤
所有标本均为空腹下,用含EDTAK2的一次性真空管采集受检者肘静脉血,4 h内上机。手术后标本为患者手术后接受化疗前标本。将100 μL抗凝血分别加入3个1.5 mL EP管中,一管加入CD4与CD8抗体各20 μL,另一管加入CD8和CD28抗体各20 μL,另一管为阴性对照,室温避光温育30 min,后加入红细胞裂解液450 μL,振荡,室温避光温育10 min,离心(1 500 r/ min,10 min),弃上清液,再加入红细胞裂解液300 μL,振荡混匀,室温避光温育5 min,离心(1 500 r/min,5 min),弃上清液,加入300 μL PBS缓冲液,上机检测。
1.4 统计学处理
2 结 果
2.1 健康人、腺瘤和CRC组织中CD4+、CD8+及CD28+T细胞阳性率的比较
对照组、腺瘤组和癌症组中CD4+T细胞表达率分别为90.00%、43.75%及32.65%,三者比较差异有统计学意义(P<0.05)。3组中CD8+T细胞表达率分别是30.00%、56.25%及75.51%,3组比较差异有统计学意义(P<0.05)。3组中CD28+T细胞表达率分别为42.86%、30.00%及20.00%,三者比较差异有统计学意义(P<0.05,表1和图1~4)。
2.2 CD4+、CD8+、CD28+T淋巴细胞阳性率与CRC临床病理参数比较
结果显示,CD4+、CD8+T淋巴细胞表达与肿瘤的分期、淋巴结及远处转移有关(P <0.05)。CD28+T淋巴与肿瘤的部位、分期及远处转移有关(P<0.05,表2)。
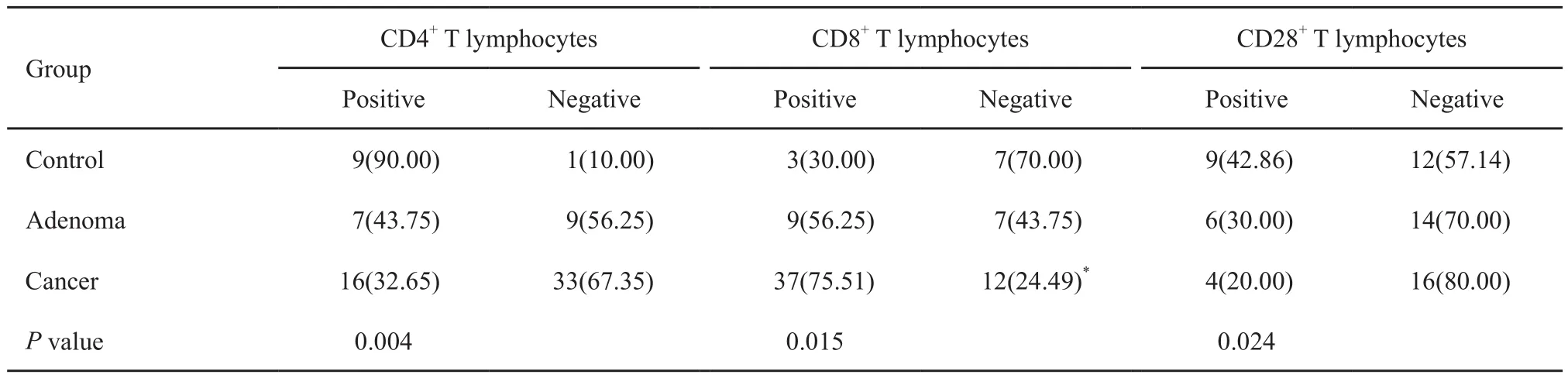
表 1 3组中CD4+、CD8+和CD28+T淋巴细胞的阳性率比较Tab. 1 Comparison of expression levels of CD4+, CD8+, and CD28+ T lymphocytes among three groups[n (%)]
图 1 CD4+、CD8+及CD28+T淋巴细胞在正常结直肠组织中的阴性对照Fig. 1 Negative control of CD4+, CD8+, CD28+T lymphocytes in normal colorectal tissue
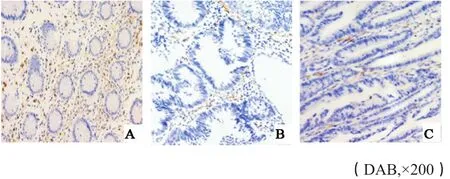
图 2 CD4+T淋巴细胞在对照组、腺瘤组织及腺癌组织中的染色情况Fig. 2 Staining of CD4+ T lymphocytes in control, adenoma and adenocarcinoma
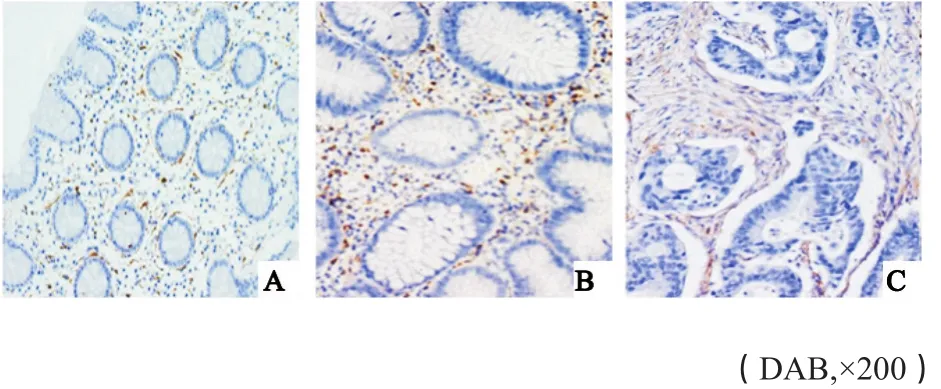
图 3 CD8+T淋巴细胞在对照组、腺瘤组织及腺癌组织中的染色情况Fig. 3 Staining of CD8+ T lymphocytes in control, adenoma, andadenocarcinoma
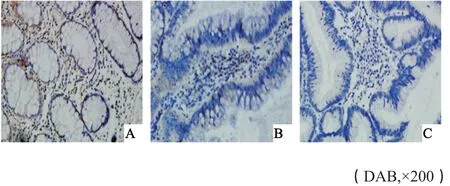
图 4 CD28+T淋巴细胞在对照组、腺瘤组织及腺癌组织中的染色情况Fig. 4 Staining of CD28+ T lymphocytes in control, adenoma andadenocarcinoma
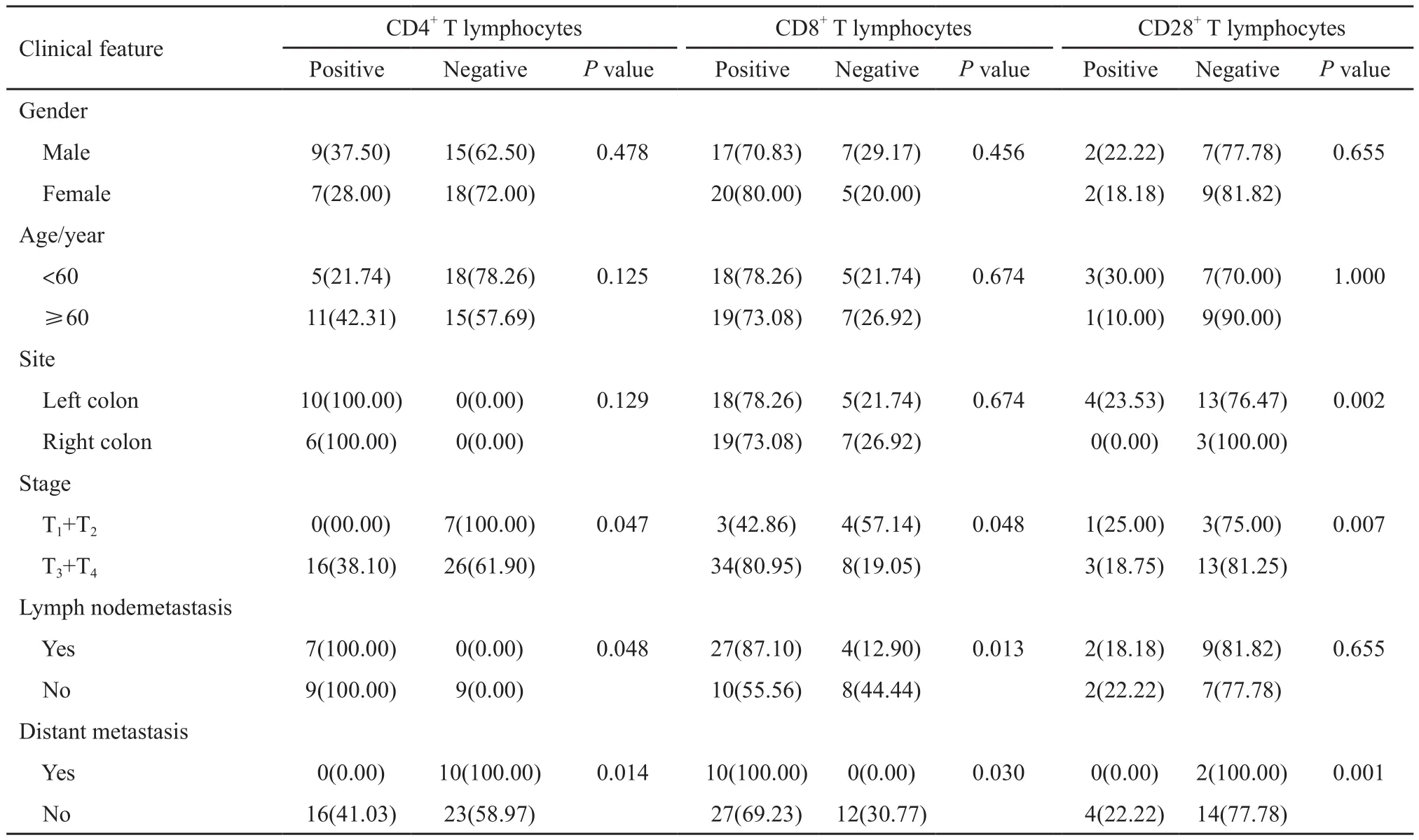
表 2 CRC患者不同临床资料中3种T淋巴细胞阳性率的比较Tab. 2 Comparison of positive rates of the three subsets of T lymphocytes in diあerent clinical data of CRC patients[n (%)]
2.3 T细胞亚群在对照组、腺瘤组、癌症组及癌术后患者外周血的测定情况
4组人外周血T细胞亚群细胞数测定的比较差异有统计学意义(P<0.05),且从对照组、腺瘤组及癌症组中出现CD4+、CD4+/CD8+T淋巴细胞比值、CD28+、CD8+CD28+及CD8-CD28+T细胞呈逐渐降低的趋势,而CD8+、CD8+CD28-T细胞呈逐渐升高的趋势(表3)。
2.4 T细胞亚群和CRC临床病理参数比较
外周血中除CD4+T淋巴细胞与淋巴结转移、CD8+CD28-与性别有关(P<0.05)外,余CD4+、CD8+、CD4+/CD8+、CD28+、CD8+CD28+、CD8+CD28-及CD8-CD28+T淋巴细胞与CRC的临床病理参数性别(CD8+CD28-T淋巴细胞除外)、年龄、部位、分期及分化程度和淋巴结转移(CD4+T淋巴细胞除外)均无关(P>0.05,表4)。
表 3 T细胞亚型在4组患者外周血中含量的比较Tab. 3 Comparison of T cell subsets in peripheral blood of four groups (%,±s)
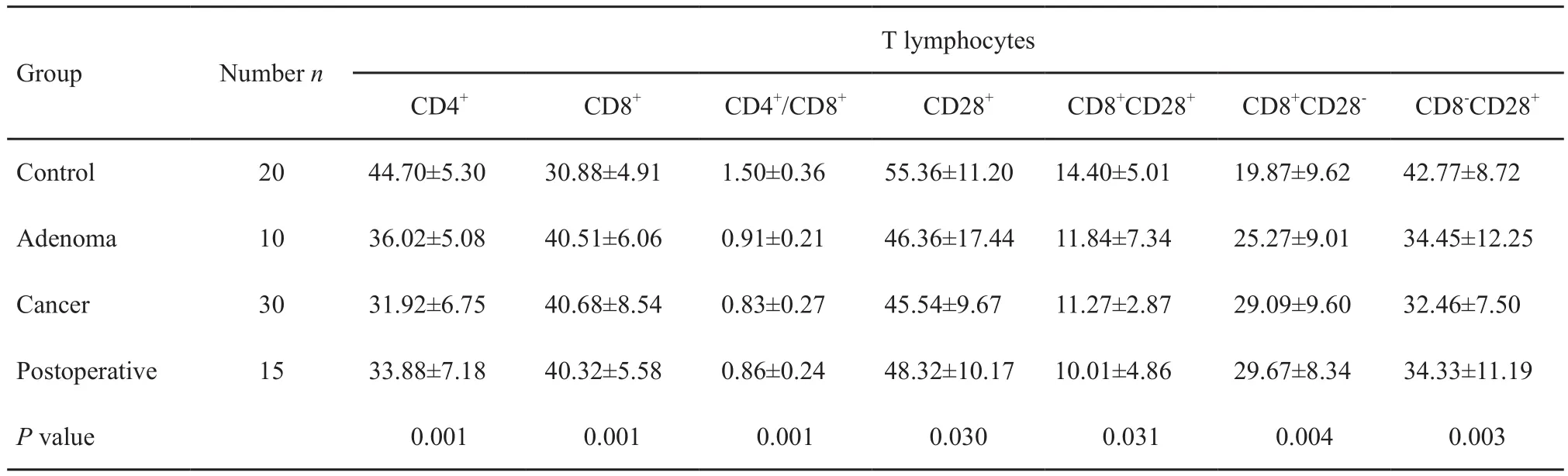
表 3 T细胞亚型在4组患者外周血中含量的比较Tab. 3 Comparison of T cell subsets in peripheral blood of four groups (%,±s)
Group Number n T lymphocytes CD4+ CD8+ CD4+/CD8+ CD28+ CD8+CD28+ CD8+CD28- CD8-CD28+Control 20 44.70±5.30 30.88±4.91 1.50±0.36 55.36±11.20 14.40±5.01 19.87±9.62 42.77±8.72 Adenoma 10 36.02±5.08 40.51±6.06 0.91±0.21 46.36±17.44 11.84±7.34 25.27±9.01 34.45±12.25 Cancer 30 31.92±6.75 40.68±8.54 0.83±0.27 45.54±9.67 11.27±2.87 29.09±9.60 32.46±7.50 Postoperative 15 33.88±7.18 40.32±5.58 0.86±0.24 48.32±10.17 10.01±4.86 29.67±8.34 34.33±11.19 P value 0.001 0.001 0.001 0.030 0.031 0.004 0.003
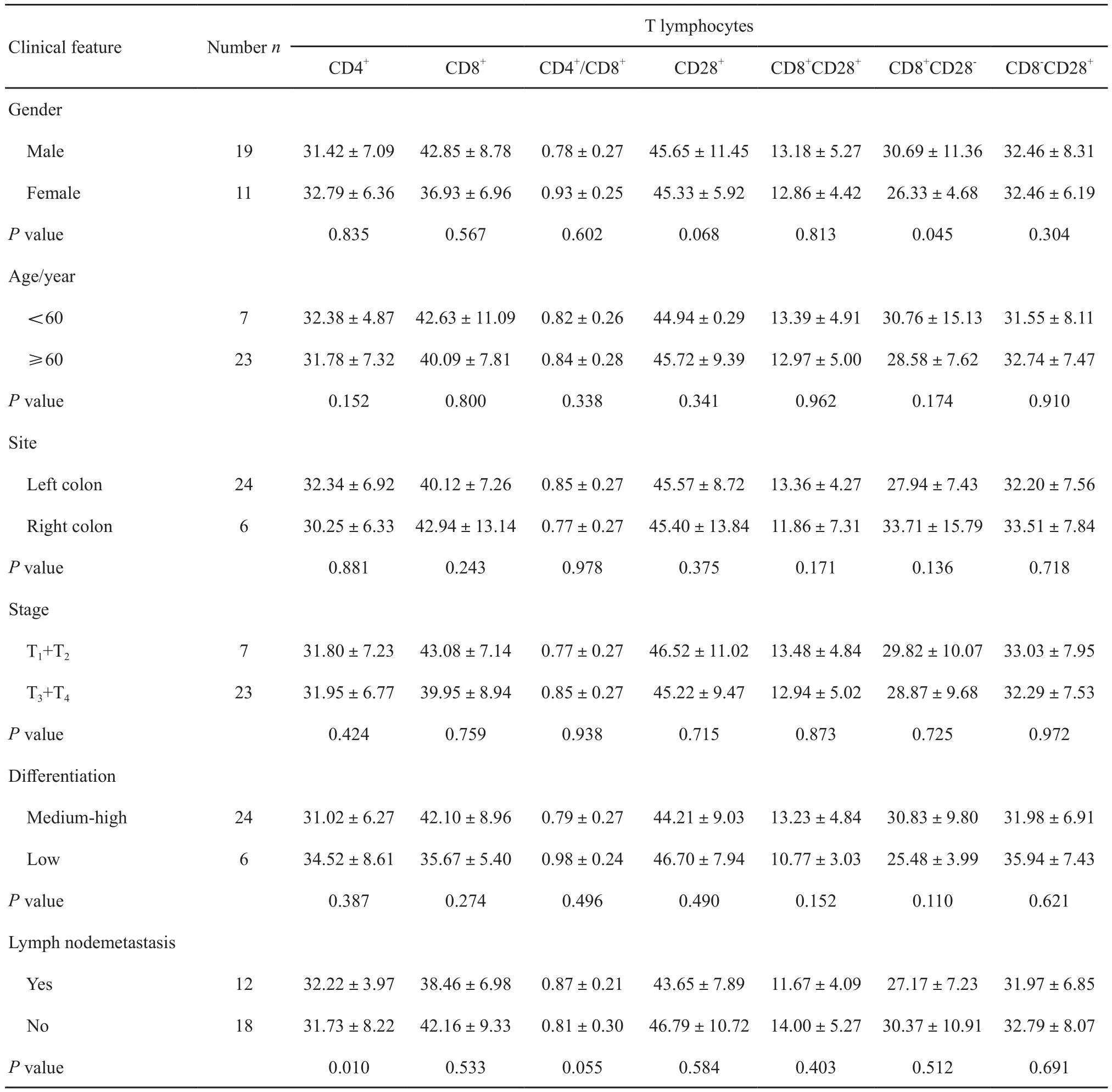
表 4 不同临床资料中结直肠癌患者外周血T淋巴细胞亚型含量的比较Tab. 4 Comparison of T lymphocyte subsets in peripheral blood of patients with colorectal cancer in diあerent clinical data
3 讨 论
TME被认为是肿瘤“温育床”[5],T细胞亚群是其关键的成员。当肿瘤逃避初始免疫监测,其可直接抑制T细胞浸润、活化和效应功能,从而使人体产生免疫耐受,最终导致无效的免疫应答和肿瘤进展[6]。T细胞依据表面抗原差异可包括CD4+和CD8+T细胞[7],两者数量平衡的稳态使机体有稳定的正常免疫功能,且二者比值是评估免疫功能的重要指标[8]。CD4+、CD8+T细胞对细胞内病原体感染的细胞识别和清除是重要的[9],且CD8+T细胞是抗肿瘤免疫应答的关键参与者。CD8+T细胞根据是否表达CD28,可分细胞毒T细胞(cytotoxic T lymphocyte,Tc,即CTL)和CD8+CD28-调节性T细胞(regulatory T lymphocyte,Ts,即Treg),前者是重要的杀伤效应细胞,后者是具有正/负调节功能的免疫细胞。CD8+CD28+与肿瘤接触后,释放穿孔素等毒性物质,溶解靶细胞且可增强机体抗病毒感染和对肿瘤的杀伤功能,承担免疫防御和免疫监视的功能[10-11]。
既往研究发现[12],CRC外周血中CD4+、CD4+/CD8+T淋巴细胞比值下降,CD8+T淋巴细胞含量升高。也有文献报道,在TME内功能有效的CD8+T细胞是减少的[13]。然而,最新研究认为[14],CRC外周血和组织中的CD8+T细胞的数量与健康人是相当的。本次实验结果表明,较健康人比,结直肠腺瘤和癌患者外周血和组织中CD4+T细胞数量逐渐降低,CD8+T细胞则逐渐增加。但我们认为,根据肿瘤免疫逃逸机制,CRC及腺瘤增加的CD8+T细胞是无功效的,有功效的CD8+T细胞实际上是降低的。在CRC及腺瘤中,CD4+T细胞减少是由于CRC细胞通过Fas/Fas L途径抑制宿主的免疫[15]。而肿瘤细胞产生降解色氨酸和精氨酸的酶和免疫细胞争夺营养和氧气,产生高浓度的乳酸盐等使CD8+T细胞在肿瘤微环境影响下逐渐失去功能[16]。此外,肿瘤组织中CD8+T细胞的存在可以避免远处转移的发生。故在对结肠癌等肿瘤治疗时,肿瘤中高CD8+T细胞浸润常作为预后良好的指标[17]。
文献报道[18],在胃癌外周血中CD8+CD28+T细胞数量是降低的,且较CD8-CD28+而言,CD8+CD28+更能反映患者的免疫状态[7]。王桂玲[19]发现胃癌患者肿瘤组织CD8-CD28+、CD8+CD28+较切缘组织明显降低。刘晓光等[11]发现,较健康人相比,CRC患者CD8+CD28-增高、CD8-CD28+降低。本次报道发现,腺瘤组和癌组患者外周血中的CD28+、CD8+CD28+、CD8-CD28+较健康人明显降低,CD8+CD28-较健康人逐渐升高。既往有研究发现[20],流式细胞术检测CD28+、CD8+CD28+T细胞的阳性率与CRC的Dukes分期、淋巴结转移等临床病理参数等是有相关性的。但是,本次研究中尚未发现CD28+、CD8+CD28+T细胞与CRC临床病理参数相关,这可能与本次研究样本偏小,采集血液时间、检测时间及所检测患者机体内环境等有关,需进一步加大研究样本及深入研究。
CRC外周血中CD28+T细胞数量降低,可能原因为CRC中肿瘤细胞抗原性弱对免疫因子的低表达。CD8+CD28+降低主要是由于TME的变化引起。CD8+CD28+杀伤肿瘤细胞过程如下[21]:① CD8+CD28+T细胞受体识别肿瘤细胞上的特异性抗原,且在Th细胞的帮助下活化,进一步杀伤肿瘤细胞;② 活化的CD8+CD28+释放穿孔素,分泌IFN且高表达FasL,使靶细胞溶解,从而杀伤肿瘤细胞。CD8+CD28-在癌及癌前病变中增加,这可能是由于在持续的抗原刺激下发生激活循环,且每次重复刺激CD28表达增殖在CD8+T细胞表面上,后逐渐不可逆地下调T细胞,最终导致CD8+CD28-T细胞的积累[22]。
本次实验中,我们发现在结直肠腺瘤中,T细胞亚群的变化均是介于CRC和健康人之间,推测在癌前病变中已有TME的变化,但是尚未引起足够重视,若能进一步深入研究,临床诊疗中在癌前病变时已发现TME的变化并进行干预,对于CRC的诊治及疗效可能有重大意义。
综上,TME的T细胞亚群在恶性肿瘤形成过程中起重要作用。有学者提出[23-24]CRC中T细胞亚群在肿瘤细胞和基质细胞中表现出不同侵袭行为。在肿瘤形成后,随着肿瘤细胞的不断出现,机体的免疫系统与其进行博弈,不断纠正,以适应并达到机体稳态。关于T细胞与结直肠疾病发生的联系与规律,需进一步探索与干预。
