Notch1 siRNA影响Notch-Wnt信号通路对人成骨肉瘤细胞增殖的抑制作用
2018-09-15郝俊龙王亚鹏王拴科
郝俊龙,杨 凯,王亚鹏,王 旭,齐 进,王拴科,汪 静
兰州大学第二医院骨肿瘤科,甘肃 兰州 730030
骨肉瘤是最常见的原发恶性骨肿瘤,其发病率约占所有骨骼系统肿瘤的15%,高致残率和高复发率是骨肉瘤发病的临床特点[1-2]。由于大剂量化疗药物的不良反应、耐药性、早期肺部转移及局部病变复发等众多问题,骨肉瘤患者生存率没有获得进一步提高[3]。因此,寻找一种疗效好、可行性大及不良反应小的临床治疗骨肉瘤的新方法是目前研究的热点。
迄今为止,骨肉瘤发生的分子机制仍不清楚。有研究报道,RIPK4蛋白与肿瘤的发生、发展、侵袭及转移有着密不可分的关系[4-5]。另外有相关文献报道,骨肉瘤的发生、发展与Notch1信号通路过度活化有密切联系[6]。Notch通路在骨肉瘤的发生、增殖、转移、凋亡、耐药及预后等诸多方面均有不同程度的影响,甚至在某些方面Notch通路还起着主导作用。另外,Wnt信号通路则是调控细胞增殖分化的重要信号通路,在骨组织生长发育中同样发挥着关键作用。已有研究证实,Wnt信号通路与Notch通路之间有着紧密的联系[7]。然而,揭示Wnt-Notch信号通路相互作用在成骨细胞生物学行为中的功能的研究不多。
本课题将明确Notch1蛋白对骨肉瘤增殖的影响并初步探讨其通过调节Notch及Wnt信号通路发挥抗肿瘤作用的可能机制,为临床治疗骨肉瘤提供新的理论依据和治疗思路,为临床提高治疗骨肉瘤的治愈率做出贡献。
1 资料和方法
1.1 临床资料
收集兰州大学第二医院病理科2014年—2016年的骨肉瘤标本19例,其中男性13例,女性6例,年龄6~72岁,中位年龄19岁。手术过程中切取新鲜骨肉瘤组织及相应的癌旁组织,收集后置于-80 ℃低温冰箱保存。全部标本均由两位高年资病理医师经病理诊断证实,所有病例的临床资料完整,术前均未接受放化疗。本研究获得兰州大学第二医院和甘肃省肿瘤医院伦理委员会的批准,所有患者均知情同意。
1.2 细胞及主要试剂
人骨肉瘤细胞株MG-63与U-2 OS购自江苏凯基生物技术股份有限公司;细胞培养基DMEM、胎牛血清购自美国Hyclone公司;Notch1 siRNA、control siRNA及siRNA转染试剂购自美国Santa Cruz公司;RNAiso Plus、prime Script RT Master Mix及SYBR Premix Ex TapTMⅡ购自日本TaKaRa公司;RIPK4兔抗人多克隆抗体、兔抗人Notch1、Hes1、DLL1、β-catenin及Cyclin D1单克隆抗体购自英国Abcam公司。
1.3 方法
1.3.1 免疫组织化学染色
按照ⅤP-9003免疫组织化学试剂盒说明书进行严格操作。将临床肿瘤组织切片进行抗原修复后,加入Notch1一抗,置于冰箱4 ℃过夜。加入二抗后水浴20 min,PBS冲洗。在显微镜下显色后用苏木精复染、分化、脱水、透明后用中性树胶封片,在显微镜下观察,细胞膜及细胞质呈棕黄色或棕色着色为阳性细胞。阳性判定以阳性细胞数及染色强度综合判定[8]。阳性细胞数:≤5%计0分,6%~25%计1分,26%~50%计2分,≥51%计3分;染色强度不着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。每张切片随机观察5个400倍视野,两者相加,≤3分为阴性,>3分为阳性。
1.3.2 靶向Notch1 siRNA转染人骨肉瘤MG-63、U-2 OS细胞
当人骨肉瘤MG-63、U-2 OS细胞进入对数生长期后,以1×105的密度接种到6孔板中,置于培养箱内温育24 h,观察其融合达到70%~80%。按照转染试剂说明书提供的方法,将2 μg/mL携带绿色荧光的control siRNA加入上述6孔细胞培养板中。细胞培养6 h后,更换成完全培养液;继续培养细胞48 h,在荧光显微镜下计数含有绿色荧光的MG-63、U2-OS细胞数。
转染48 h后,荧光显微镜下检测绿色荧光表达,选取3个视野,观察拍照,分别计数每个视野中总细胞的数量和荧光细胞的数量,计算转染效率(转染效率=荧光细胞总数/总细胞数×100%)。
1.3.3 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测Notch1 siRNA转染对MG-63、U-2 OS细胞增殖的影响
将处于对数生长期的人骨肉瘤细胞制成悬液后,接种到96孔板中,密度为5 000个/孔,每孔加入100 μL的PBS。细胞在各自条件下培养24、48和72 h。培养结束后,待培养细胞铺满孔底,给每孔加入0.5%MTT 20 μL,继续培养4 h,然后倾去培养基,并用PBS漂洗,重复3次,每孔加入二甲基亚砜(dimethylsulfoxide,DMSO)150 μL。将孔板放在摇床上振摇10 min,用酶联检测仪在490 nm的波长下测定每个孔的吸光度(D)值。同时一定要设置调零孔和对照孔。以时间为横轴,D值为纵轴绘制细胞生长曲线。
1.3.4 流式细胞术检测Notch1 siRNA转染对MG-63、U-2 OS细胞凋亡的影响
按照FITC Annexin Ⅴ凋亡检测试剂盒Ⅰ(购自美国BD公司)检测方法进行。用胰酶将处于生长对数期的细胞消化,并收集细胞,1 000 r/min离心5 min,弃去上清液。使用4 ℃冰箱中冷藏的PBS漂洗细胞3次,再用1×结合缓冲液制成1×106个/mL的细胞悬液。往Falcon试管中加入100 μL细胞悬液。接着加入5 μL FITC AnnexinⅤ,轻轻混匀,室温(20~25 ℃)条件下,避光反应15 min。再加入10 μL的PI染料,振荡混匀,室温避光处静置15 min。最后分别在各组管中加入1×结合缓冲液400 μL。1 h内利用流式细胞仪检测细胞凋亡。
1.3.5 实时荧光定量聚合酶链反应(real-time fl uorescent quantitative polymerase chain reaction,RTFQ-PCR)检测骨肉瘤组织中Notch1 mRNA及Notch1 siRNA转染MG-63、U-2 OS细胞后Notch1-Wnt通路相关蛋白mRNA水平
按照试剂盒说明书用RNAiso Plus细胞裂解液提取骨肉瘤组织及Notch1 siRNA转染骨肉瘤细胞中总RNA,进行反转录合成cDNA。将cDNA产物进行RTFQ-PCR循环。RIPK4、Notch1、Hes1及DLL1的PCR引物由日本TaKaRa公司设计合成并纯化(表1)。
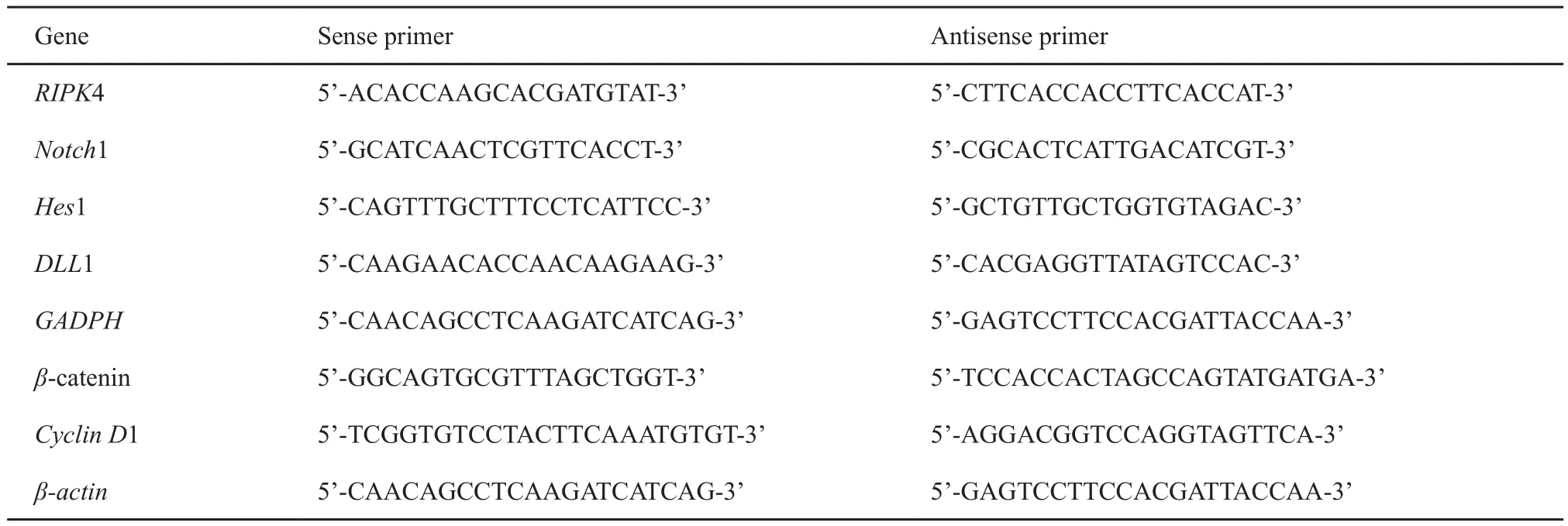
表 1 PCR引物Tab. 1 PCR primer
进行RTFQ-PCR后,开始琼脂糖凝胶电泳。应用凝胶成像软件测定RIPK4、Notch1、Hes1、DLL1、β-catenin及Cyclin D1的表达。计算mRNA的相对表达量,以GADPH、β-actin为内参照校正每个样本的循环阈值CT得到△CT,实验组目的基因相对表达量以2-△△CT计算表示,本实验重复3次。
1.3.6 蛋白质印迹法(Western bolt)检测骨肉瘤组织中Notch1 mRNA及Notch1 siRNA转染MG-63、U-2 OS细胞后Notch1-Wnt通路相关蛋白表达
MG-63、U-2 OS细胞被Notch1 siRNA转染后,按照试剂盒说明书提取骨肉瘤组织及细胞株总蛋白及骨肉瘤组织中总蛋白并测定其浓度。加以5×SDS上样缓冲液后放入沸水中使其变性。取预染蛋白Marker(购自北京中杉金桥生物技术有限公司)5 μL和40 μg蛋白样品上样后电泳(电压120 Ⅴ,1 h)。电泳结束后转印至PⅤDF膜(300 mA,1 h),常温下用5%脱脂奶粉封闭1 h,加入一抗RIPK4(1∶1 000)、Hes1(1∶1 000)、DLL1(1∶1 000)、Notch1(Abcam 1∶1 000)、β-catenin(1∶1 000)、Cyclin D1(1∶1 000)和GAPDH(1∶2 000)、β-actin1∶2 000),4 ℃温育过夜,加入相应的二抗(1∶5000)室温温育1 h。ECL化学发光法显色,结果经自动电泳凝胶成像分析仪采集,通过Quanyity one采图分析软件得出每个条带的平均D值(每个目的条带与相应的β-actin平均D值的比值)。
1.4 统计学处理
实验采用SPSS 18.0统计软件进行数据处理。单一对照组与多实验组的比较运用Dunnett-t检验,实验数据运用±s表示,一组对比其间内容比较采用LSD-t法,接着用方差分析测试结果,摒弃差值较大的一组数值,取均值为计算数据。P<0.05为差异有统计学意义。
2 结 果
2.1 骨肉瘤组织中Notch1呈阳性表达
Notch1蛋白及其Notch1 mRNA在癌旁组织与骨肉瘤组织中的免疫组织化学染色结果显示,Notch1蛋白阳性表达定位于细胞质,呈浅棕黄色至深棕黄色颗粒状,且19例骨肉瘤中Notch1阳性表达14例(73.7%)。RTFQ-PCR及Western blot检测结果表明,与癌旁组织相比,骨肉瘤组织中Notch1 mRNA表达及蛋白表达水平均显著增加(图1)。
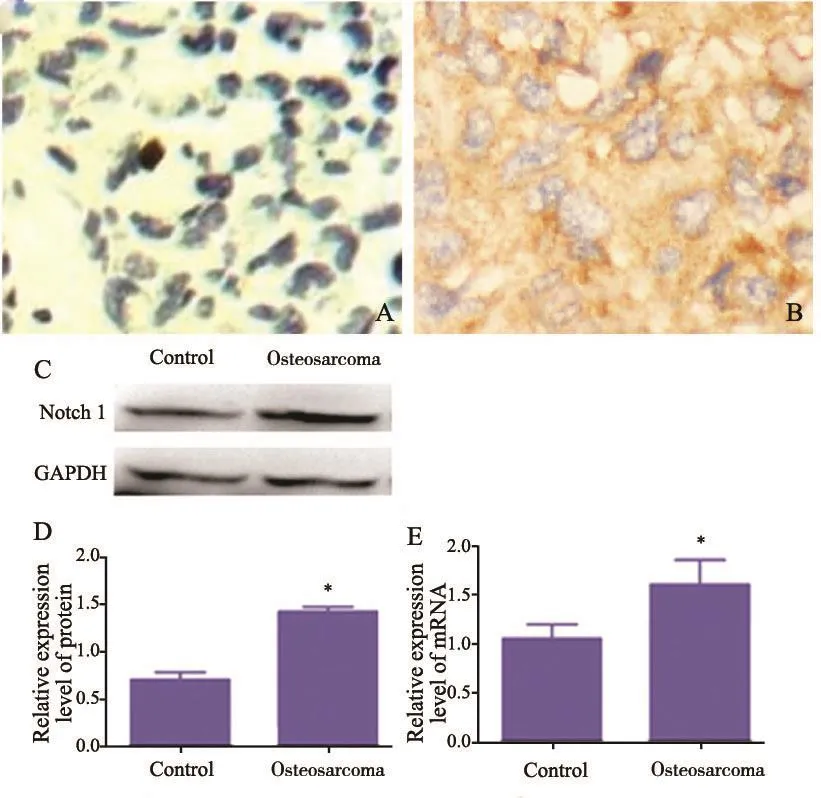
图 1 骨肉瘤组织中Notch1蛋白水平及mRNA的表达Fig. 1 Protein level and mRNA expressions of Notch1 in osteosarcoma specimens
2.2 靶向沉默Notch1基因及沉默效果检测
将Notch1 siRNA转染进入MG-63、U-2 OS骨肉瘤细胞,待转染48 h后,用普通显微镜及荧光显微镜观察(图2),然后对带有荧光的骨肉瘤细胞分别进行计数。Notch1 siRNA-NC转染MG-63和U-2 OS骨肉瘤细胞的转染效率分别为88%和83%。Notch1 siRNA转染MG-63和U-2 OS骨肉瘤细胞的转染效率分别为78%和80%,转染获得成功。
2.3 Notch1 siRNA转染后骨肉瘤细胞增殖能力降低
Notch1 siRNA转入MG-63、U-2OS细胞48 h后,骨肉瘤细胞增殖能力均有所降低。与control siRNA组和空白组相比,差异有统计学意义(P<0.05,图3)。
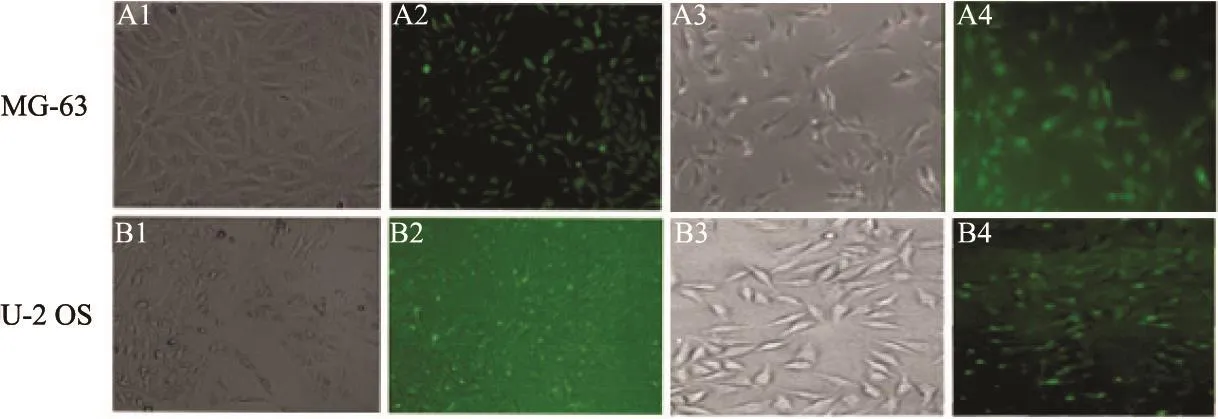
图 2 观察control siRNA转染48 h时人成骨肉瘤MG-63、U-2 OS细胞中绿色荧光的表达情况Fig. 2 The green fl uorescence in osteosarcoma MG-63 and U-2 OS cells after they were transfected with control siRNA or Notch1 siRNA for 48 h
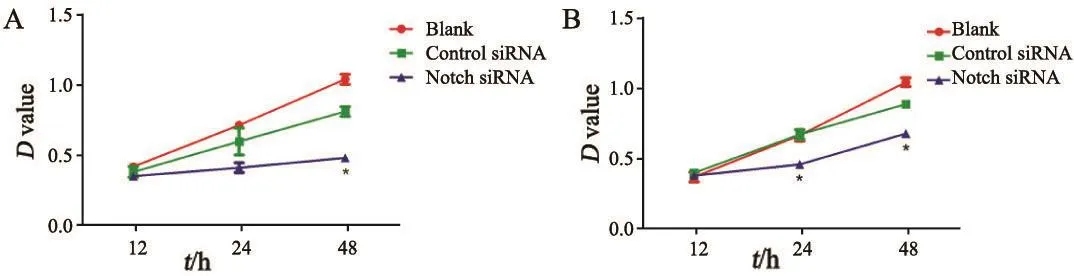
图 3 MTT检测特异性沉默Notch1基因后MG-63(A)、U-2 OS(B)细胞的增殖情况Fig. 3 MTT detection of the proliferation of MG-63 (A) and U-2 OS (B) tumor cells after speci fi city silencing of Notch1 gene
2.4 Notch1 siRNA转染后骨肉瘤细胞凋亡率增加
流式细胞术检测结果显示,Notch1 siRNA转染MG-63、U-2 OS骨肉瘤细胞48 h后,骨肉瘤细胞凋亡率增加。Notch1 siRNA组MG-63骨肉瘤细胞凋亡率(27.55%±2.16%)明显高于control siRNA组(11.79%±0.42%)和空白组(9.72%±1.65%),差异有统计学意义(P<0.05);Notch1 siRNA组U-2 OS骨肉瘤细胞凋亡率(27.545%±2.96%)明显高于control siRNA组(18.70%±2.61%)和空白组(16.345%±1.63%),差异有统计学意义(P<0.05),转染后两组细胞中空白组与control siRNA组相比,差异均无统计学意义(P>0.05,图4)。
2.5 Notch1 siRNA转染后骨肉瘤细胞Notch通路相关蛋白及mRNA水平降低
将靶向Notch1基因的siRNA转染入人骨肉瘤MG-63、U-2 OS细胞中,诱导降低或缺失Notch1基因后检测细胞中的Notch通路分子的活性,应用RTFQ-PCR和Western blot检测发现,MG-63骨肉瘤细胞和U-2 OS骨肉瘤细胞表现出Notch配体DLL1、Notchl和Notch靶基因Hes1含量的变化,Notch1 siRNA组与control siRNA组和空白组比较,上述蛋白的含量和表达均明显降低,差异有统计学意义(P<0.05,图5、6)。
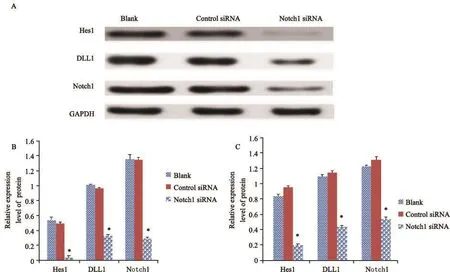
图 5 特异性转染Notch1 siRNA后,MG-63细胞中DLL1、Notch1和Hes1的表达情况Fig. 5 The expressions of DLL1, Notch1 and Hes1 after MG-63 cells were transfected by Notch1 siRNA
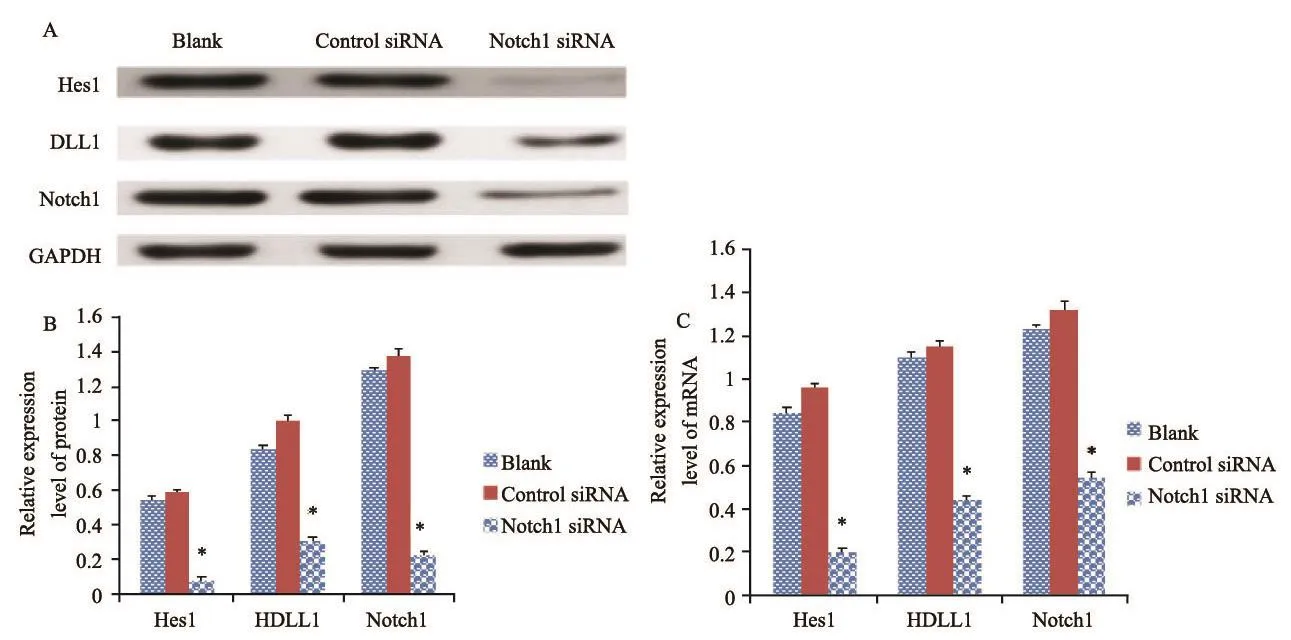
图 6 特异性转染Notch1 siRNA后,U-2 OS细胞中DLL1、Notch1和Hes1的表达情况Fig. 6 The expressions of DLL1, Notch1 and Hes1 after U-2 OS cells were transfected by Notch1 siRNA
2.6 Notch1 siRNA转染后骨肉瘤细胞Wnt通路相关蛋白及mRNA水平降低
将靶向Notch1基因的siRNA转染入人骨肉瘤MG-63、U-2 OS细胞中,诱导降低或缺失Notch1基因后检测细胞中的Wnt通路分子的活性,应用RTFQ-PCR和Western blot检测发现,MG-63骨肉瘤细胞和U-2 OS骨肉瘤细胞表现出β-catenin、Cyclin D1含量的变化,Notch1 siRNA组与control siRNA组和空白组比较,上述两种蛋白的mRNA表达均明显降低,差异有统计学意义(P<0.05,图7、8)。
2.7 Notch1 siRNA转染后骨肉瘤细胞中PIPK4表达降低
将靶向Notch1基因的siRNA转染入人骨肉瘤MG-63、U-2 OS细胞中,诱导降低或缺失Notch1基因后检测细胞中的RIPK4的表达,应用RTFQPCR和Western blot检测发现,MG-63骨肉瘤细胞和U-2 OS骨肉瘤细胞中,RIPK4 mRNA与蛋白表达水平均明显降低,差异有统计学意义(P<0.05,图9)。
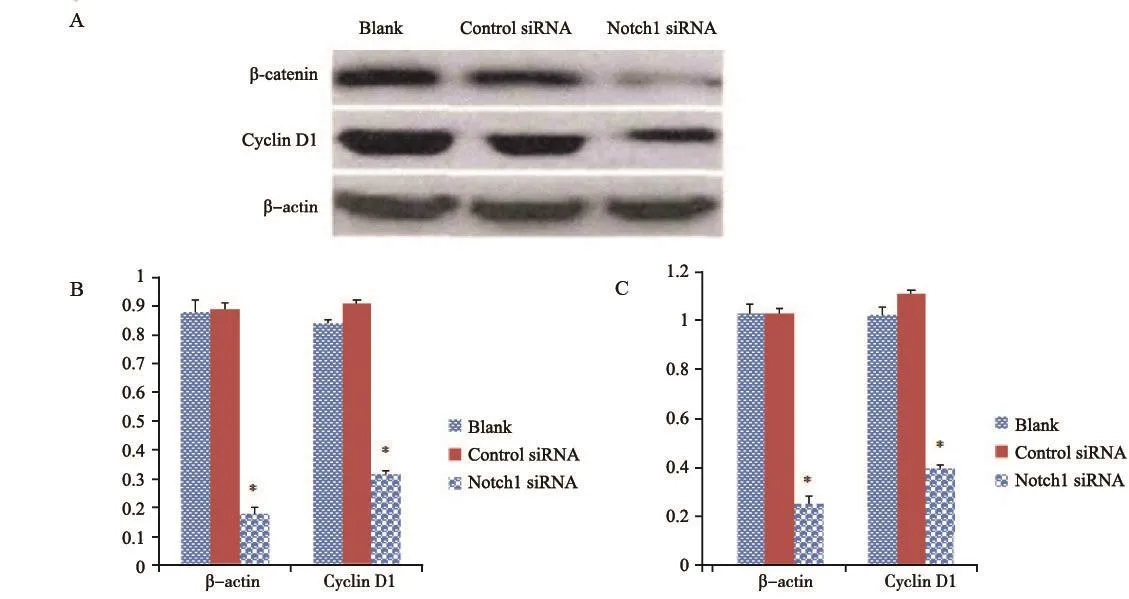
图 7 特异性转染Notch1 siRNA后,MG-63细胞中β-catenin、Cyclin D1的表达情况Fig. 7 The expressions of β-catenin and Cyclin D1 after MG-63 cells were transfected by Notch1 siRNA
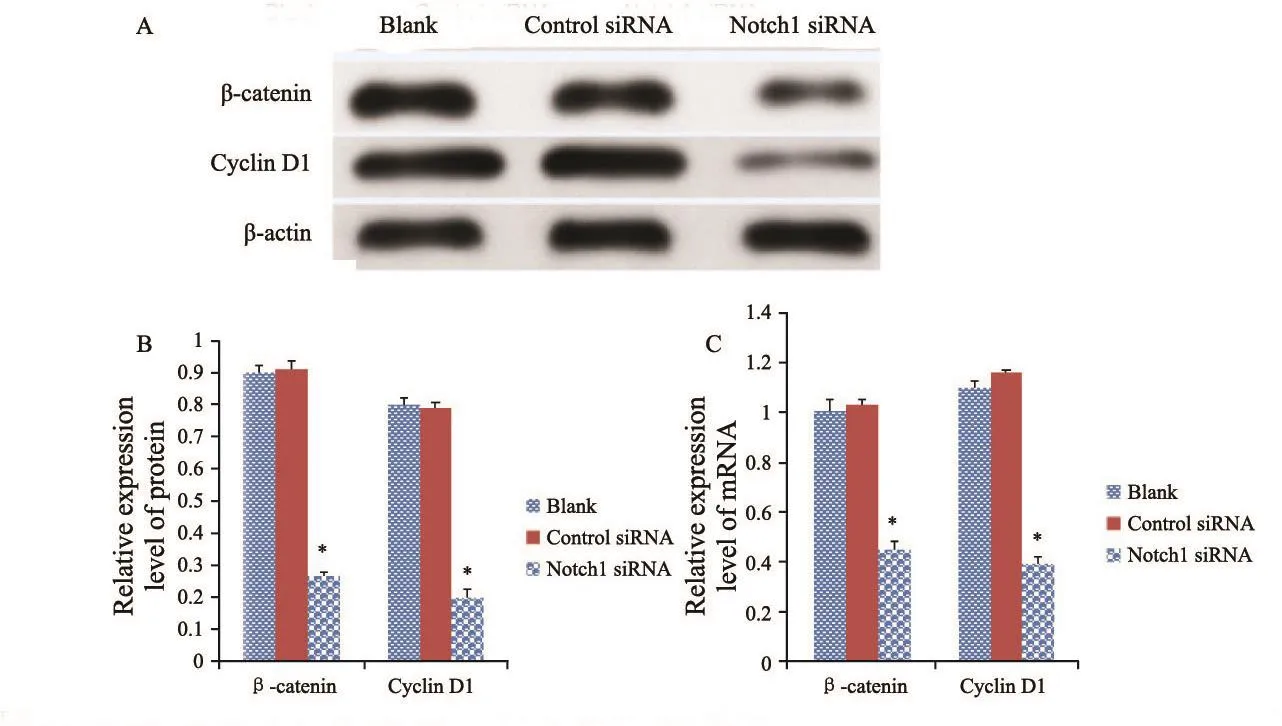
图 8 特异性转染Notch1 siRNA后,U-2 OS 细胞中β-catenin、Cyclin D1的表达情况Fig. 8 The expressions of β-catenin and Cyclin D1 after U-2 OS cells were transfected by Notch1 siRNA
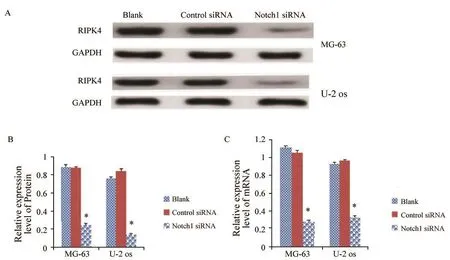
图 9 特异性转染Notch1 siRNA后,MG-63与U-2 OS细胞中RIPK4的表达情况Fig. 9 The expressions of RIPK4 after MG-63 and U-2 OS cells were transfected by Notch1 siRNA
3 讨 论
骨肉瘤是骨肿瘤中最常见的原发性恶性肿瘤,好发于儿童和青少年[9]。骨肉瘤在临床上为高度恶性,同时具有致残率高、肺部转移早及复发率高等特点。迄今为止,骨肉瘤发生、发展的相关分子机制尚不明确,临床上也没有针对性的有效治疗药物[10-11]。
已有研究报道,Notch1的表达量在肺癌、肝癌、骨肉瘤及乳腺癌等多种恶性肿瘤组织中显著升高,活化Notch1能够促进离体培养骨肉瘤细胞的侵袭、转移[12-14]。王克猛等[15]的研究结果显示,Notch1蛋白的阳性表达率在软骨肉瘤、骨软骨瘤及正常软骨组织3组间逐渐增高,组间差异有统计学意义(P<0.05)。周彬等[16]的研究结果表明,Notch1阻断剂能够抑制骨肉瘤小鼠模型肿瘤的生长,参与这一过程的可能分子机制包括降低促增殖分子和促侵袭分子的生成、增加促凋亡和侵袭抑制分子的生成。但是Notch1对骨肉瘤发生、发展的具体机制仍未阐明。
本实验结果显示,在19例临床骨肉瘤组织中有14例Notch1蛋白染色显示为阳性,且Notch1 mRNA表达及蛋白水平在组织中显著增加。另外采用MTT法检测Notch1 siRNA转染入人骨肉瘤MG-63和U-2 OS细胞中,发现其细胞增殖能力降低,同时流式细胞术检测显示,Notch1 siRNA转染入人骨肉瘤MG-63和U-2 OS细胞后其细胞凋亡率增加。上述结果进一步确定,Notch1不但与骨肉瘤有着高度相关性,而且在骨肉瘤的发生、发展过程中扮演着非常重要的促增殖角色。
Notch1基因有着重要的生理作用,其功能决定了Notch信号通路的整体功能。Dailey等[17]通过使用基因序列分析和RTFQ-PCR检测的方法,也发现在骨肉瘤组织中Hes1、Hey-1、Notch1和Notch2表达增强,提示当Notch信号通路被激活后,会促进骨肉瘤细胞的增殖和发育。此外,Wnt通路则是调控细胞增殖分化的重要信号通路。Wnt配体可通过β-catenin依赖性及β-catenin非依赖性信号通路对多种器官的发育和稳态维持产生重要影响。
已有研究证实,Wnt信号通路与Notch信号通路之间有着紧密的联系[18],Wnt信号通路和Notch信号通路是相互联系并协调平衡的,在胚胎发育、组织再生和肿瘤形成中共同起作用,具体分子作用机制复杂,可概括为3个类型:共同参与调控转录靶点[19];一条信号通路的转录靶基因对另一条信号通路造成影响,使信号活性在不同时间、不同空间产生差异[20];在信号转导过程中,直接通过分子作用串话[21]。
本研究将靶向Notch1基因的siRNA转染入人骨肉瘤MG-63和U-2 OS细胞中,诱导降低或缺失Notch1基因后,发现Notch配体DLL1、Notchl和Notch靶基因Hes1的表达明显降低,同时Wnt通路中关键分子β-catenin与Cyclin D1的表达也显著降低。此外诱导降低或缺失Notch1后,促增殖分子RIPK4的蛋白表达水平也明显下降。说明Notch1 siRNA信号分子可能通过抑制Notch-Wnt通路,减少促增殖分子RIPK4的表达,进而降低骨肉瘤细胞的增殖作用。
综上所述,Notch1在骨肉瘤的发生、发展过程中扮演促增殖分子的重要角色,参与这一过程的分子机制可能是通过影响Notch-Wnt信号通路进而增加促增殖分子RIPK4的表达而发挥促进肿瘤发生、发展的作用。
