针刺介入时机对缺血性中风大鼠脑组织中PTEN、p-AKT和p-GSK3b的影响
2018-09-14刘勇孙嘉婧
刘勇,孙嘉婧
针刺介入时机对缺血性中风大鼠脑组织中PTEN、p-AKT和p-GSK3b的影响
刘勇1,孙嘉婧2
(1.黑龙江中医药大学附属第一医院,哈尔滨 150040;2.黑龙江中医药大学,哈尔滨 150040)
观察不同针刺介入时间对局灶性脑缺血中风模型大鼠脑组织细胞中双特异性磷酸酶(PTEN)、磷酸化蛋白激酶B(p-AKT)和磷酸化糖原合酶激酶-3b(p-GSK3b)的影响。将200只成年雄性SD大鼠随机分为A组(假手术组)、B组(模型组)、C组(造模后2 h针刺组)、D组(造模后72 h针刺组)和E组(造模后168 h针刺组),每组40只。除A组外,其余各组均采用线栓法制备大鼠局灶性永久性脑缺血模型。各组术后1 d、3 d、7 d及14 d分别采用Garcia复合评分法评定神经功能,并采用Western Blot法和RT-PCR法检测脑组织中PTEN、p-AKT和p-GSK3b基因的转录和相应蛋白的表达情况。与B组比较,C组和E组在不同时间点(术后1 d、3 d、7 d和14 d)Garcia复合评分均显著提高(<0.01)。D组术后7 d和14 d Garcia复合评分与C组比较,差异有统计学意义(<0.05)。E组术后3 d、7 d和14 d Garcia复合评分与C组比较,差异均具有统计学意义(<0.05)。B组在不同时间点(术后1 d、3 d、7 d和14 d)PTEN、p-AKT、p-GSK3b蛋白表达及PTEN mRNA、p-AKT mRNA、p-GSK3bmRNA表达与A组和C组比较,差异均具有统计学意义(<0.01,<0.05)。D组和E组术后3 d、7 d和14 d PTEN、p-AKT、p-GSK3b蛋白表达与C组比较,差异均具有统计学意义(<0.01,<0.05)。D组和E组在不同时间点(术后1 d、3 d、7 d和14 d)PTEN mRNA、p-AKT mRNA、p-GSK3bmRNA表达与C组比较,差异均具有统计学意义(<0.01,<0.05)。针刺可显著降低缺血脑组织神经细胞中PTEN的表达,显著升高p-AKT和p-GSK3b的表达,从而抑制细胞凋亡,保护和修复受损神经元细胞,且越早进行针刺,效果越好。
针刺;脑梗死;中风;介入时机;双特异性磷酸酶;磷酸化蛋白激酶B;磷酸化糖原合酶激酶-3b;大鼠
针刺疗法对于脑梗死的临床治疗是积极有效的。大量实验研究证明,针刺对缺血性中风大鼠的治疗效果显著[1]。双特异性磷酸酶(PTEN)参与调控神经细胞周期[2],其表达升高可抑制磷酸化蛋白激酶B(p-AKT)的表达[3]。而PI3K/AKT通路是神经细胞再生的重要环节,磷酸化糖原合酶激酶-3b(p-GSK3b)是PI3K/Akt通路的下游效应靶点蛋白,p-GSK3b失活可阻止凋亡通路的激活。抑制PTEN的表达可促进p-AKT和p-GSK3b的表达[4],从而促进受损神经干细胞修复和再生。本研究通过观察不同针刺时机对缺血性中风大鼠脑组织中PTEN、p-AKT和GSK3b表达的影响,为寻找针刺治疗脑梗死的最佳时机提供实验室依据,现报告如下。
1 材料与方法
1.1 实验动物及分组
选用2月龄、体重为280~300 g的健康清洁级雄性Sprague-Dawley(SD)大鼠250只(其中50只备用),购于黑龙江中医药大学实验动物中心,许可证号(SCXK黑2008004)。将200只大鼠随机分为A组(假手术组)、B组(模型组)、C组(缺血2 h针刺组)、D组(缺血72 h针刺组)和E组(缺血168 h针刺组),每组40只。
1.2 实验仪器与试剂
1.2.1 主要仪器
电泳槽Mini P-4(Cavoy公司);MultiSkan3酶标仪(美国Thermo公司);水平脱色摇床(其林贝尔仪器制造有限公司);垂直电泳仪,半干槽,全自动梯度PCR仪、PCR反应扩增仪(美国Bio-Rad公司);凝胶成像系统(以色列MiniLumi公司);核酸电泳系统(美国Bio- Rad公司);pH仪(德国Sartorius公司)。
1.2.2 主要试剂
1.2.2.1 WB实验试剂
蛋白抽提试剂、BCA蛋白定量试剂盒、考马斯亮蓝染色液、电泳缓冲液、中分子量蛋白marker、NC膜、湿转缓冲液、丽春红染色液(赛诺博公司提供);蛋白酶、磷酸酶抑制剂(Roche group);Trizma base、Glycine、T1503、SDS、Sodium deoxycholate (Sigma- Aldrich);山羊抗兔IgG、HRP,山羊抗小鼠IgG、GAPDH鼠单克隆抗体(天德悦公司提供);PTEN、p-AKT和p-GSK3b单抗(美国SANTACRUZ公司)。
1.2.2.2 RT-PCR所用试剂
Goldview染料、50XTAE电泳缓冲液(诺特莱斯生物科技有限公司);2xPCR TaqMix(北京康为世纪生物科技有限公司);琼脂糖(上海贝晶生物技术有限公司);氯仿、异丙醇、无水乙醇(天津市富宇精细化工有限公司);PCR扩增引物、DNA Marker(2000bp)、RNA提取试剂盒、反转录试剂盒[宝生物工程(大连)有限公司]。
1.3 动物模型制备
采用颈内动脉线栓法制备大鼠局灶性永久性脑缺血模型[5]。将钓鱼线经75%乙醇消毒后制备线栓,并置于蒸馏水中备用。大鼠成功麻醉后,仰位固定于手术台上。手术区域常规消毒,备皮后沿颈前正中线纵行切开皮肤,钝性分离皮肤和皮下肌肉组织,在暴露左侧颈总动脉(common carotid artery, CCA)后,依次分离出颈外动脉(external carotid artery, ECA)、颈内动脉(internal carotid artery, ICA),并时刻保护迷走神经。依次在CCA近、远心两端以及ECA挂线备用。随后先用微动脉夹暂时夹闭ICA,并迅速结扎CCA近心端和ECA。在距离左侧CCA分叉4 mm处剪一斜向小口,由此将线栓小心插入ICA中,先将CCA远端挂线稍系紧,然后继续推进栓线进入ICA,在栓线过ICA的分叉18 mm时,系紧CCA远心端的挂线。然后清理手术切口,用青霉素消炎处理,再逐层缝合肌肉和皮肤,用碘伏对切口表面进行局部消毒。A组除不进行插入线栓外,其余处理同B组。造模成功大鼠会出现明显右肢瘫痪;或将其提尾悬空时,出现右上肢屈曲或向左侧倾斜、转圈。
1.4 动物干预方法
C组、D组和E组分别在造模成功后2 h、72 h和168 h进行针刺治疗。取左侧百会及双侧风池穴,穴位定位参照《实验针灸学》[6]。将大鼠牢牢捆绑固定后,采用0.30 mm×13 mm毫针进行针刺,百会向曲鬓穴透刺,进针约0.8 mm,留针30 min,其间每隔10 min行捻转手法1 min,要求速度为180~200 r/min;风池进针约0.5 mm,留针30 min,其间每隔10 min行提插捻转手法1次。各针刺组均每日治疗1次。
1.5 观察指标
1.5.1 神经功能评分测定
各组分别于术后1 d、3 d、7 d及14 d随机选择10只大鼠,采用Garcia 18分的复合评分法[7]对神经功能进行评分。
1.5.2 脑组织标本采集及指标的测定
在神经功能评分测试完成后,在相应时间将大鼠处死并断头,分离缺血部分的脑组织备用。利用WB法检测PTEN、p-AKT和p-GSK3b蛋白的表达,利用RT-PCR法检测PTEN、p-AKT和p-GSK3bmRNA的转录情况。
1.6 统计学方法
采用SPSS18.0软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用单因素方差分析,组间两两比较采用法。检验水准为α=0.05。
2 结果
各组在取材前共死亡45只,未进行取材及实验数据分析,总死亡率为18.4%。其中A组死亡1只,原因为进行CCA切口时不慎将其剪断,且近心端未结扎完全,导致大量出血死亡;B组死亡8只;C组死亡16只;D组死亡11只,E组死亡9只。造模时大鼠共死亡39只,造模成功率为80.9%,死亡原因为术中损伤迷走神经导致呼吸心率衰竭、插入线栓时大量出血及术后感染等。此外,C组在造模后2 h进行针刺治疗,由于大鼠挣扎导致未完全愈合的伤口开裂,从而出血或感染死亡5只。进行手术且存活的大鼠均单独置于实验动物专用笼,保证供给足量且等量的饲料和水,尽可能保证影响因素一致,并按时清理垫料保持卫生,以此避免感染及不必要的伤害。剩余5只大鼠妥善饲养。
2.1 各组不同时间点Garcia复合评分比较
由表1可见,A组不存在神经功能缺损,故4个时间点评分均为(18.00±0.00)分。C组和E组术后1 d、3 d、7 d和14 d Garcia复合评分与B组比较,差异有统计学意义(<0.01)。D组术后1 d Garcia复合评分与B组比较,差异有统计学意义(<0.01)。D组术后7 d和14 d Garcia复合评分与C组比较,差异有统计学意义(<0.05)。E组术后3 d、7 d和14 d Garcia复合评分与C组比较,差异有统计学意义(<0.05)。E组术后3 d、14 d Garcia复合评分与D组比较,差异有统计学意义(<0.05)。提示针刺能明显提高脑缺血中风大鼠Garcia复合评分,改善其感觉、运动和协调功能,其中C组改善大鼠神经功能效果最好。
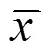
表1 各组不同时间点Garcia复合评分比较 (±s,分)
注:与B组比较1)<0.01;与C组比较2)<0.05;与D组比较3)<0.05
2.2 各组大鼠不同时间点缺血脑组织中PTEN、p-AKT和p-GSK3b蛋白表达比较
由图1、表2可见,A组大鼠脑组织中PTEN蛋白呈低表达;B组大鼠脑组织中PTEN蛋白呈高表达,随着缺血时间的延长逐渐增强,并在缺血7 d时到达高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中PTEN蛋白表达均有不同程度降低,随着针刺时间的延长,降低越为显著,其中以C组最为明显。
B组、C组、D组和E组在不同时间点(术后1 d、3 d、7 d和14 d)PTEN蛋白表达与A组比较,差异均具有统计学意义(<0.01,<0.05)。C组、D组和E组不同时间点(术后1 d、3 d、7 d和14 d)PTEN蛋白表达与B组比较,差异均有统计学意义(<0.05)。D组和E组术后3 d、7 d和14 d PTEN蛋白表达与C组比较,差异均具有统计学意义(<0.05)。E组术后14 d PTEN蛋白表达与D组比较,差异具有统计学意义(<0.05)。提示针刺能够降低缺血脑组织中PTEN蛋白表达,且针刺干预越早对PTEN的影响越明显。
由图1、表3可见,A组大鼠脑组织中p-AKT蛋白呈高表达;B组大鼠脑组织中p-AKT蛋白呈低表达,随着缺血时间的延长逐渐增强,并在缺血7 d时到达高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中p-AKT蛋白表达均有不同程度升高,随着针刺时间的延长,升高越为显著,其中以C组最明显。
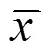
表2 各组大鼠不同时间点缺血脑组织中PTEN蛋白表达比较 (±s,OD)
注:与A组比较1)<0.01,2)<0.05;与B组比较3)<0.05;与C组比较4)<0.05;与D组比较5)<0.05
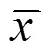
表3 各组大鼠不同时间点缺血脑组织中p-AKT蛋白表达比较 (±s,OD)
注:与A组比较1)<0.01,2)<0.05;与B组比较3)<0.01,4)<0.05;与C组比较5)<0.01,6)<0.05;与D组比较7)P<0.05
B组和C组不同时间点(术后1 d、3 d、7 d和14 d) p-AKT蛋白表达与A组比较,差异均具有统计学意义 (<0.01,<0.05)。C组和D组不同时间点(术后1 d、3 d、7 d和14 d)p-AKT蛋白表达与B组比较,差异均有统计学意义(<0.01,<0.05)。D组和E组术后3 d、7 d和14 d p-AKT蛋白表达与C组比较,差异均具有统计学意义(<0.01,<0.05)。E组术后3 d、7 d和14 d p-AKT蛋白表达与D组比较,差异具有统计学意义(<0.05)。提示针刺能够升高缺血脑组织中p-AKT蛋白表达,针刺干预越早对p-AKT影响越明显。
由图1、表4可见,A组大鼠脑组织中p-GSK3b蛋白呈高表达;B组大鼠脑组织中p-GSK3b蛋白呈低表达,随缺血时间的延长逐渐增强,并在缺血7 d时到达高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中p-GSK3b蛋白表达均有不同程度升高,随着针刺时间的延长,升高越为显著,其中以C组最明显。
B组、C组和D组不同时间点(术后1 d、3 d、7 d和14 d)p-GSK3b蛋白表达与A组比较,差异均具有统计学意义(<0.05)。C组不同时间点(术后1 d、3 d、7 d和14 d)p-GSK3b蛋白表达与B组、D组和E组比较,差异均具有统计学意义(<0.01,<0.05)。E组术后3 d、7 d和14 d p-GSK3b蛋白表达与D组比较,差异具有统计学意义(<0.05)。提示针刺能够升高缺血脑组织中p-GSK3b蛋白表达,针刺干预越早对p-GSK3b的影响越明显。
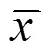
表4 各组大鼠不同时间点缺血脑组织中p-GSK3b蛋白表达比较 (±s,OD)
注:与A组比较1)<0.05;与B组比较2)<0.01,3)<0.05;与C组比较4)<0.01,5)<0.05;与D组比较6)<0.05
2.3 各组大鼠不同时间点缺血脑组织中PTEN、p-AKT和p-GSK3b转录比较
由图2可见,A组大鼠脑组织中PTEN mRNA呈低转录;B组大鼠脑组织中PTEN mRNA呈高转录,随着缺血时间的延长逐渐增强,并在缺血7 d时达到高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中PTEN mRNA的转录情况均有不同程度的降低,随着针刺时间的延长,降低越为显著,其中以C组最明显。
由表5可见,B组、C组、D组和E组不同时间点(术后1 d、3 d、7 d和14 d)PTEN mRNA表达与A组比较,差异均有统计学意义(<0.01,<0.05)。C组不同时间点(术后1 d、3 d、7 d和14 d)PTEN mRNA表达与B组、D组和E组比较,差异均有统计学意义(<0.01,<0.05)。E组术后3 d、7 d和14 d PTEN mRNA表达与D组比较,差异具有统计学意义(<0.05)。提示针刺能够有效抑制缺血脑组织中PTEN mRNA的转录,针刺干预越早对PTEN mRNA的影响越明显。
由图3可见,A组大鼠脑组织中p-AKT mRNA呈高表达;B组大鼠脑组织中p-AKT mRNA呈低表达,随着缺血时间的延长逐渐增强,并在缺血7 d时达高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中p-AKT mRNA表达均有不同程度的升高,随着针刺时间的延长,升高越为显著,其中以C组最明显。
由表6可见,B组、D组和E组不同时间点(术后1 d、3 d、7 d和14 d)p-AKT mRNA表达与A组比较,差异均具有统计学意义(<0.01,<0.05)。C组术后1 d、7 d和14 d p-AKT mRNA表达与A组比较,差异均具有统计学意义(<0.05)。C组不同时间点(术后1 d、3 d、7 d和14 d)p-AKT mRNA表达与B组、D组和E组比较,差异均具有统计学意义(<0.01,<0.05)。E组术后7 d和14 d PTEN mRNA表达与D组比较,差异具有统计学意义(<0.01,<0.05)。提示针刺能够升高缺血脑组织中p-AKT mRNA表达,针刺干预越早对p-AKT mRNA的影响越明显。
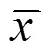
表5 各组大鼠不同时间点脑组织中PTEN mRNA表达比较 (±s,OD)
注:与A组比较1)<0.01,2)<0.05;与B组比较3)<0.01,4)<0.05;与C组比较5)<0.01,6)<0.05;与D组比较7)<0.05

注:M为Marker2000;1为A组术后1 d;2为A组术后3 d;3为A组术后7 d;4为A组术后14 d;5为B组术后1 d;6为B组术后3 d;7为B组术后7 d;8为B组术后14 d; 9为C组术后1 d;10为C组术后3 d;11为C组术后7 d;12为C组术后14 d;13为D组术后1 d;14为D组术后3 d;15为D组术后7 d;16为D组术后14 d;17为E组术后1 d;18为E组术后3 d;19为E组术后7 d;20为E组术后14 d
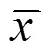
表6 各组大鼠缺血脑组织中p-AKT mRNA表达比较 (±s,OD)
注:与A组比较1)<0.01,2)<0.05;与B组比较3)<0.01,4)<0.05;与C组比较5)<0.01,6)<0.05;与D组比较7)<0.01,8)<0.05

注:M为Marker2000;1为A组术后1 d;2为A组术后3 d;3为A组术后7 d;4为A组术后14 d;5为B组术后1 d;6为B组术后3 d;7为B组术后7 d;8为B组术后14 d; 9为C组术后1 d;10为C组术后3 d;11为C组术后7 d;12为C组术后14 d;13为D组术后1 d;14为D组术后3 d;15为D组术后7 d;16为D组术后14 d;17为E组术后1 d;18为E组术后3 d;19为E组术后7 d;20为E组术后14 d
由图4可见,A组大鼠脑组织中p-GSK3bmRNA呈高表达;B组大鼠脑组织中p-GSK3bmRNA呈低表达,随着缺血时间的延长逐渐增强,并在缺血7 d时达高峰,然后略有下降;与B组比较,C组、D组和E组大鼠脑组织中p-GSK3bmRNA表达均有不同程度的升高,随着针刺时间的延长,升高越为显著,其中以C组最明显。
由表7可见,B组、C组、D组和E组不同时间点(术后1 d、3 d、7 d和14 d)p-GSK3bmRNA表达与A组比较,差异均具有统计学意义(<0.01,<0.05)。C组不同时间点(术后1 d、3 d、7 d和14 d)p-GSK3bmRNA表达与B组、D组和E组比较,差异均具有统计学意义(<0.01,<0.05)。E组术后14 d p-GSK3bmRNA表达与D组比较,差异具有统计学意义(<0.05)。提示针刺能够升高缺血脑组织中p-GSK3bmRNA表达,针刺干预越早对p-GSK3bmRNA的影响越明显。
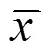
表7 各组大鼠不同时间点缺血脑组织中p-GSK3b mRNA表达比较 (±s,OD)
注:与A组比较1)<0.01,2)<0.05;与B组比较3)<0.01,4)<0.05;与C组比较5)<0.01;与D组比较6)<0.05

注:M为Marker2000;1为A组术后1 d;2为A组术后3 d;3为A组术后7 d;4为A组术后14 d;5为B组术后1 d;6为B组术后3 d;7为B组术后7 d;8为B组术后14 d; 9为C组术后1 d;10为C组术后3 d;11为C组术后7 d;12为C组术后14 d;13为D组术后1 d;14为D组术后3 d;15为D组术后7 d;16为D组术后14 d;17为E组术后1 d;18为E组术后3 d;19为E组术后7 d;20为E组术后14 d
3 讨论
神经功能评分是脑缺血中评价神经功能损害及神经功能恢复程度的行为学检查方法。目前,Garcia复合评分法从大鼠自主运动、体态活动对称性、前肢伸展功能、网格实验、身体双侧感觉、双侧胡须反射6方面多角度评价神经功能缺损程度,可避免单一评价方法的片面及主观性,且该方法可操作性好[5]。本研究对针刺后的脑缺血中风大鼠进行神经功能评分,证实针刺能明显提高脑中风大鼠神经功能Garcia复合评分,改善缺血性中风大鼠的感觉、运动和协调功能,从而有效改善缺血型脑中风大鼠的神经功能。
本研究在对于脑缺血模型大鼠的针刺治疗中遵循了中医学传统理论,并结合现代临床研究,采用活血化瘀、醒脑开窍的治法,取头部百会穴(透曲鬓穴)及风池穴,此法在头部贯穿督脉、膀胱经、胆经3条阳经,可通发阳气,从而达到疏通经络、行散瘀血的作用。针刺首先对还未凋亡的神经细胞和未受累及的正常神经细胞进行双向刺激,以此来抑制细胞凋亡,促进细胞活性;其次,针刺还能改善局部血液循环,提高缺血区神经细胞的兴奋性,这进一步加强了脑代偿功能,使神经细胞功能迅速得到改善和保护[7-9]。
PTEN阳性表达产物具有磷酸酶活性[3],其在神经系统中广泛存在,尤其在大脑皮质、杏仁核、尾壳核、小脑、海马的表达较强[10]。脑缺血后,缺血部位细胞内渗透迅速升高,严重打破细胞内外离子平衡,使细胞水肿、坏死、凋亡,严重情况可直接导致细胞破裂。由此凋亡的细胞破裂后,向周围细胞释放化学信号,使PTEN迅速升高表达[11],并调节PI3K/AKT信号传导通路,通过减少磷脂酰肌醇三磷酸(PIP3),抑制细胞增殖,从而导致细胞凋亡[12-15]。
本实验结果表明,缺血脑组织中PTEN蛋白和基因呈高表达,不同针刺介入时机治疗后,PTEN蛋白和基因表达均有不同程度的降低,其中以C组变化最为明显。神经元死亡形式主要有坏死和凋亡两种,下调PTEN可阻断钙离子内流[16],减少钙离子超载引起的神经元延迟性坏死,同时平衡细胞内外离子水平,改善能量代谢,抑制缺血半暗带神经元的凋亡[1]。笔者推测针刺对缺血性中风大鼠脑损伤的保护机制可能是通过诱导PTEN基因表达下调,从而激活PI3K/Akt信号通路,使p-AKT蛋白表达增加,抑制神经细胞的凋亡,发挥其神经保护作用[17]。
近年来相关研究表明,PI3K/AKT信号转导通路作为促进细胞生存关键信号通路已经得到广泛的证实,对维持细胞生存和抑制细胞凋亡中起关键作用[3]。PI3K/AKT途径的负性调控主要受具有双重功能的类脂磷酸酶PTEN的调控,存在p-AKT参与促进神经干细胞的增殖的生理活动,尤其在组织缺血和缺氧的条件下,p-AKT的作用则更为重要[18-20]。本实验结果表明,不同时间点脑缺血模型组p-AKT蛋白和基因表达明显降低,不同针刺介入治疗后较脑缺血组明显增加,且神经功能缺损减轻,脑组织病理损害减小,其中以C组最为明显。不同针刺介入时机是通过PI3K/AKT通路的激活并增加磷酸化AKT的水平发挥保护神经作用。
GSK-3是一种多功能的丝/苏氨酸蛋白激酶,包括GSK-3a和GSK-3b两种亚型,其中GSK-3b与细胞凋亡关系最为密切。研究发现,应用GSK-3b抑制剂可以保护脑缺血中神经细胞,减少脑梗死体积并且改善神经功能缺失。磷酸化的GSK-3b能够抑制GSK-3b的活性,参与神经细胞的保护。有研究报道,缺氧预处理可以通过增加p-AKT的表达而增加p-GSK3b的表达,从而对缺氧损伤的神经元起到保护作用[21]。本实验中B组p-GSK3b蛋白和基因的表达明显降低;不同针刺介入时机治疗后能明显增加p-GSK3b蛋白和基因的表达,其中以C组最为明显。针刺抑制GSK-3b活性可能通过提高体内Mg2+浓度直接抑制GSK-3b的活性,同时通过增加AKT的磷酸化间接减少GSK-3b活性。
综上所述,针刺能抑制缺血性中风大鼠PTEN蛋白和基因的表达,增强PI3K/AKT/GSK3b信号通路的转导,这可以改善其缺血组织的能量代谢,调控凋亡相关蛋白表达,从而起到对脑缺血神经元损伤的修复、再生和保护作用。而且造模后2 h针刺介入的效果明显优于72 h和168 h,故笔者推测针刺介入时机越早,对脑缺血神经元损伤的修复、再生和保护作用越明显。但由于实验条件和经验限制,故尚不足以证明此推测成立。望广大学者继续努力研究,寻找出最佳时机。
[1] 周鑫,周亚军,张怀波,等.针刺治疗急性缺血性中风的临床实验分析[J].中国中医急症,2017,26(8):1358- 1360.
[2] 秦光成,谢景梅,刘春晓,等.PTEN下调表达对反复发作性偏头痛大鼠模型行为学的影响[J].中国疼痛医学杂志,2016,22(1):11-16.
[3] 崔晓萍,陈建梅,穆军山,等.PTEN通过拮抗PI3K/Akt信号通路抑制神经干细胞增殖[J].西安交通大学报(医学版),2016,37(2):239-243.
[4] 刘小莺,吴莉,陈洲,等.PTEN抑制剂对高糖诱导的内皮细胞衰老的影响[J].中国药理学通报,2016,32(4): 514-519.
[5] 闵鹤鸣,贾玉洁,姜兴千,等.硫酸镁对大鼠局灶性脑缺血后氧化应激和NF-kB蛋白表达的影响[J].中风与神经疾病杂志,2016,33(7):588-591.
[6] 郭义.实验针灸学[M].北京:中国中医药出版社,2016: 133.
[7] 刘勇,王洪,赵军,等.针刺介入时机对缺血性中风大鼠神经功能评分和Bcl-2、Bax表达的影响[J].环球中医药,2014,7(8):581-586.
[8] 刘勇,邹伟,赵军,等.针刺对脑梗死大鼠神经功能损伤和能量代谢的影响[J].针灸临床杂志,2014,30(8): 64-67.
[9] 刘勇,赵军,王洪,等.针刺介入时机对脑梗死大鼠能量代谢和脑源性神经生长因子、酪氨酸激酶受体B的影响[J].中国临床保健杂志,2014,17(4);376-380.
[10] 张金朋.针康法对局灶性脑缺血大鼠神经功能缺损及缺血区皮层RhoA、PTEN表达的影响[D].黑龙江中医药大学硕士论文,2015:1-58.
[11] 赵婧,谢雪梅,陈玉蓉.肿瘤抑制因子PTEN亚细胞定位与缺血-缺氧性脑损伤[J].基础医学与临床,2016,36 (12):1718-1722.
[12] Arendt KL, Benoist M, Lario A,. PTEN counteracts PIP3 upregulation in spines during NMDA-receptor-dependent long-term depression[J]., 2014,127 (Pt 24):5253-5260.
[13] Chi H, Yang R, Zheng X,.LncRNA RP11-79H23.3 Functions as a Competing Endogenous RNA to Regulate PTEN Expression through Sponging hsa-miR-107 in the Development of Bladder Cancer [J]., 2018, 19(9):E2531.
[14] Xu W, Yang Z, Xie C,.PTEN lipid phosphatase inactivation links the hippo and PI3K/Akt pathways to induce gastric tumorigenesis[J]., 2018,37(1):198.
[15] Lin H, Huang ZP, Liu J,. MiR-494-3p promotes PI3K/AKT pathway hyperactivation and human hepatocellular carcinoma progression by targeting PTEN[J]., 2018,8(1):10461.
[16] Zhao J, Qu Y, Wu J,. PTEN inhibition prevents rat cortical neuron injury after hypoxia-ischemia[J]., 2013,238:242-251.
[17] Li W, Huang R, Chen Z,. PTEN degradation after ischemic stroke: a double-edged sword[J]., 2014,274:153-161.
[18] Di Y, Chen XL.Inhibition of LY294002 in retinal neovascularizationdown-regulation the PI3K/AKT- VEGF pathwayand[J]., 2018,11(8):1284-1289.
[19] Gao YY, Zhang ZH, Zhuang Z,. Recombinant milk fat globule-EGF factor-8 reduces apoptosis via integrin β3/FAK/PI3K/AKT signaling pathway in rats after traumatic brain injury[J]., 2018,9(9): 845.
[20] 陈勇,付贞,范林,等.PI3K/Akt信号通路在肝脏缺血再灌注损伤中的研究进展[J].中国临床医学,2018, 25(1):103-107.
[21] Mao LL, Hao DL, Mao XW,. Neuroprotective effects of bisperoxovanadium on cerebral ischemia by inflam- mation inhibition[J].urosci Lett, 2015,602:120-125.
Effect of Acupuncture Intervention Time on PTEN, p-AKT and p-GSK3bin Brain Tissues of Rats with Ischemic Stroke
1,-2.
1.,,150040,; 2.,150040,
To investigate the effects of different intervention times on phosphatase and tensin homology deleted on chromosome 10 (PTEN), phosphorylated protein kinase B (p-AKT) and glycogen synthase kinase-3b(p-GSK3b) in brain tissue of rats with ischemic stroke.Two hundred adult male Sprague-Dawley (SD) rats were randomized to group A (sham operation group ), group B (model group), group C (group of acupuncture at 2 h after modeling), group D (group of acupuncture at 72 h after modeling) and group E (group of acupuncture at 168 h after modeling), with 40 rats in each group. Except group A, the rats of all the other groups were prepared into permanent focal cerebral ischemia model by suture-occluded method. Respectively, 1, 3, 7 and 14 days after surgery, Garcia composite score method was used to evaluate the neural function of the rats. Transcription of PTEN, p-AKT and p-GSK3bgene and the expression of their proteins in brain tissues of rats were examined by Western blotting and reverse transcription-polymerase chain reaction (RT-PCR) method.Compared with group B, Garcia composite score increased significantly (<0.01) at different time points (1, 3, 7 and 14 days after surgery) in group C and group E. Garcia composite score at different time points (7 and 14 days after surgery) in group D were significantly different from that in group C (<0.05). Garcia composite score at different time points (3, 7 and 14 days after surgery) in group E were significantly different from that in group C (<0.05). The expressions of PTEN, p-AKT and p-GSK3bproteins and the expression of PTEN mRNA, p-AKT mRNA and p-GSK3bmRNA at different time points (1, 3, 7 and 14 days after surgery) in group B were significantly different from those in group A and group C (<0.01,<0.05). The expressions of PTEN, p-AKT and p-GSK3bproteins at different time points (3, 7 and 14 days after surgery) in group D and group E were significantly different from those in group C (<0.01,<0.05). The expressions of PTEN mRNA, p-AKT mRNA and p-GSK3bmRNA at different time points (1, 3, 7 and 14 days after surgery) in group D and group E were significantly different from those in group C (<0.01,<0.05).Acupuncture can significantlydown-regulate the expression of PTEN in the neurons of ischemic brain tissues, and significantly increase the expressions of p-AKT and p-GSK3b, through which it can suppress neural cell apoptosis, protect and repair the damaged neurons. The sooner the intervention of acupuncture, the better the treatment effect.
Acupuncture; Cerebral infarction; Intervention time; Stroke; Phosphatase and tensin homology deleted on chromosome 10; Phosphorylated Protein Kinase B; Glycogen synthase kinase-3b; Rats
1005-0957(2018)09-1068-08
R2-03
A
10.13460/j.issn.1005-0957.2018.09.1068
2018-04-18
黑龙江省自然科学基金项目(H2016061);黑龙江省博士后资助项目(LBH-Z11011)
刘勇(1975—),女,副主任医师,博士,Email:24680190@qq.com
