褪黑素对非生物胁迫下雨生红球藻中虾青素积累的影响
2018-09-13岳陈陈徐军伟余旭亚
岳陈陈 丁 巍 李 涛 赵 鹏 徐军伟 余旭亚
(昆明理工大学生命科学与技术学院, 昆明 650500)
雨生红球藻(Haematococcus pluvialis)是一种单细胞绿藻[1], 在生物或非生物胁迫下能够积累虾青素, 含量最高可达细胞干重的4%[2], 高于其他已知的虾青素来源。虾青素(3, 3′-二羟基-β, β-胡萝卜素-4, 4′-二酮)是一种红色酮类胡萝卜素, 有13个单双键交替排列的共轭键, 因此具有强抗氧化性、中和自由基、清除活性氧的特性[3,4], 广泛应用在食品、饲料、化妆品以及医药行业, 具有较高的商业价值[5,6]。然而, 虾青素生产中却存在着生产成本高、产量低等问题, 因此, 采用有效策略提高雨生红球藻虾青素产量成为研究的热点。
褪黑素(Melatonin, MLT)是一种广泛存在于生物界的激素, 在动物、植物以及微生物中均已发现,先前研究表明MLT具有降低细胞内活性氧、清除自由基、调节生物周期节律、信号分子和光合作用等功能[7—9], 从而对生物体代谢途径进行调控。研究显示雨生红球藻在胁迫条件如高光照、缺氮等[10,11]条件下, 有利于虾青素的积累。另外, 胁迫条件下细胞内发生应激反应产生活性氧(Reactive oxygen species, ROS), 作为信号分子参与生物系统的信号通路[12—14]; 一氧化氮 (Nitric oxide, NO)和水杨酸(Salicylic acid, SA)是植物中的信号分子, 参与固有的防御体系, 应对不利的生长条件[15,16]。雨生红球藻虾青素的生物合成开始于2-甲基-D-赤藻糖醇-4-磷酸(MEP)途径, 以丙酮酸和甘油醛-3-磷酸(GA3P)为起始物, 经第一个限速酶, 1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)催化, 形成1-脱氧-D-木酮糖-5-磷酸(DOXP), 用于后续的虾青素合成,dxs基因表达量的增加可提高DOXP的生成量, 进而促进虾青素的合成[17]。研究发现MLT能大幅提高单针藻中油脂含量, 而油脂和虾青素都是微藻的次级代谢产物且合成又联系密切[18,19], 这为本研究将MLT用于雨生红球藻诱导产虾青素提供了理论依据。
本研究选用MLT对雨生红球藻进行诱导, 检测MLT对生长、虾青素积累、信号分子以及虾青素合成途径中关键酶基因表达量的影响, 进而对MLT诱导虾青素合成的机制进行分析探讨。
1 材料与方法
1.1 材料与试剂
雨生红球藻由本实验室筛选、保存。MLT: 上海生工生物工程股份有限公司; 活性氧检测试剂盒、总一氧化氮检测试、Trizol、逆转录试剂盒和荧光定量试剂盒: 上海碧云天生物技术有限公司;SA检测试剂盒: 美国Bio Vision公司; 甲醇、DMSO(均为分析纯): 天津市风船化学试剂科技有限公司;丙酮: 重庆川东化工(集团)有限公司; KOH: 重庆北碚化学试剂厂; 二氯甲烷: 天津市兴复科技发展有限公司。
1.2 仪器与设备
XS-212-202显微镜: 江南光电(集团)股份有限公司; 1730R高速冷冻离心机: 丹麦Labogene Scanspeed公司; FA2004N分析天平: 上海箐海仪器有限公司; DS-8510DTH超声波微波组合体系: 上海生析超声仪器有限公司; Ultrospec 2100pro紫外可见分光光度计: 安玛西亚(中国)有限公司; HHW-D6水浴锅: 金坛双捷实验仪器厂; VS-840-1超净工作台: 上海博讯实业有限公司; LDZX-50KBS灭菌锅:上海申安医疗器械厂; 5804R离心机: 德国Eppendorf公司; FD5-12冷冻干燥机: 西盟国际集团; 荧光定量PCR仪: 美国伯乐公司; 高效液相仪: waters 996。
1.3 方法
雨生红球藻的培养选用Bold’s Basal Medium(BBM)[20]为基础培养基, 将纯化过的雨生红球藻转接到3 L(内置2 L培养基)锥形瓶中, 控制培养温度(25±1)℃, 光照强度50 μE/(m2·s), 持续通入0.1 vvm的无菌空气, 培养至对数生长期(此时生物量约为7×105cells/mL)。
将MLT诱导MLT溶于乙醇中配制成浓度为0.21 mol/L的MLT母液, 备用。将细胞液培养至对数生长期5000×g离心3min收集细胞, 用无菌水洗涤3次, 除去残留培养基, 重悬浮于缺氮的BBM培养基中, 配成体系为350 mL生物量为2.5×105cells/mL的光生物反应器, 使诱导培养基的MLT浓度为0、5、10和15 μmol/L(保持加入相同的乙醇), 每个梯度设置3个平行样。控制培养温度(27±1) ℃, 216 μE/(m2·s)持续光照, 连续通入0.04 vvm的无菌空气培养15d, 进行隔天取样, 测定藻细胞生物量以及虾青素积累量, 同时取样用于后续的NO、SA和ROS的测定。
测定细胞生物量和虾青素含量采用高效液相法测定雨生红球藻虾青素的含量。隔天定期取50 mL诱导培养基中的藻液, 5000 r/min离心3min, 弃上清收集藻细胞, 使用超纯水洗三次, 加入5 mL甲醇-二氯甲烷(3∶1)提取液, 冰水浴下用匀浆机2800 r/min匀浆20s, 匀浆液10000×g低温离心15min, 转移上清至另一试管中。重复提取2—3次,至沉淀物基本呈现无色为止。将收集的所有提取液10000×g再次低温离心15min, 取上清用高效液相色谱仪测定, 色谱柱为C18柱(waters, 25 cm×4.6 mm,5 mm)流动相A(丙酮)和流动相B(甲醇∶水=9∶1,v/v)遵循: 25min B 80%—20%, 10min 20% B, 5min B 20%—80%, 流速为1.25 mL/min; 检测器为waters 996光电二极管阵列检测器, 进样量30 μL测定波长476 nm, 积分得到虾青素质量浓度 (mg/L)。
此外, 每隔一天定期取10 mL诱导培养基中的藻液, 离心收集细胞, 冷冻, 干燥, 称重, 细胞生物量和虾青素含量按以下公式计算:
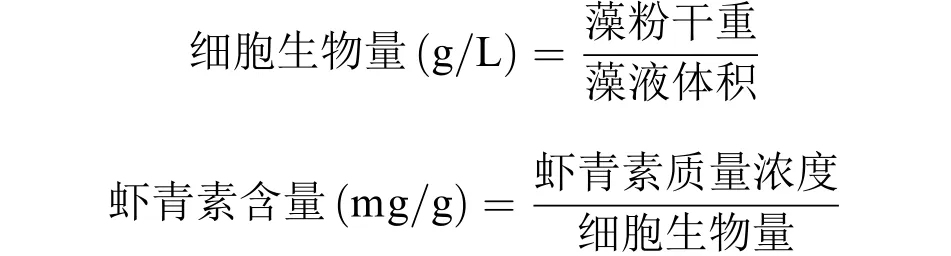
同时, 分别计算出游离虾青素和虾青素酯的含量。
细胞内ROS、NO和SA含量测定和抑制剂处理将收集的样品按照Che等[21]的方法使用活性氧检测试剂盒(上海碧云天生物技术有限公司)测定细胞内活性氧的含量。测定内源的SA和NO水平,离心收集所取样品并水洗2次, 磨碎藻细胞, 使用水杨酸检测试剂盒(Bio Vision, America)和总NO检测试剂盒(上海碧云天生物技术有限公司)测定细胞内SA和NO的水平。
为了测定在胁迫条件下MLT与NO、ROS以及SA之间的关系, 将微藻分别培养在含有10 μmol/L MLT+200 μmol/L carboxy-PTIO (NO清除剂)、10 μmol/L MLT+100 μmol/L paclobutrazol (PAC,SA抑制剂)和10 μmol/L MLT+10 mmol/L N-acetyl-L-cysteine (NAC, ROS清除剂)的缺氮BBM培养基中, 隔天取样, 测定虾青素含量。
雨生红球藻dxs基因表达分析本试验使用Primer5.0设计、上海生工合成dxs酶基因上下游扩增引物: 5′-ACAACCAGCAGGTGTCGC-3′与5′-CCGTCTCCGCACTCTTCA-3′, 扩增出序列后测序,以此为模板设计荧光引物dxsF (5′-GTCTCCGCAC TCTTCACC-3′)与dxsR (5′-CCCACCCAGTACA ACAAC-3′), 用Trizol法提取不同浓度MLT处理的微藻RNA, 采用RT-PCR法检测dxs酶基因的表达量,以18S (引物: 5′-CGGTCTGCCTCTGGTATG-3′与5′-GCTTGCTTTGAACACGCT-3′)基因作为内标来调节RNA的用量和循环数, 使内标基因在不同浓度诱导下的表达丰度一致。
1.4 数据处理
本实验重复了5次, 每次均设置3个平行样, 所有图表中数据为平均值±标准偏差, 使用ANOVA(SPSS 19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异, 图中“*”表示同一时间与其他组差异显著(P<0.05);“**”表示同一时间与其他组差异极显著(P<0.01)。
2 结果
2.1 MLT对微藻细胞生物量的影响
雨生红球藻在诱导条件下生物量会发生变化,为了探究外源添加MLT对雨生红球藻生长的影响,测定了不同浓度不同时间微藻的生长情况, 如图1所示, 所有组在诱导条件下的生长情况不同, 培养15d后, 对照组生物量达到了0.77 g/L, 15、10和5 μmol/L MLT处理浓度的细胞量峰值分别达到0.62、0.69和0.64 g/L, 低于对照组, 根据生物量的变化趋势可知, 15 μmol/L MLT诱导组有明显的下降趋势。这一现象表明低浓度的MLT处理对H.pluvialis生长没有促进作用, 而高浓度的MLT处理抑制微藻细胞的生长。
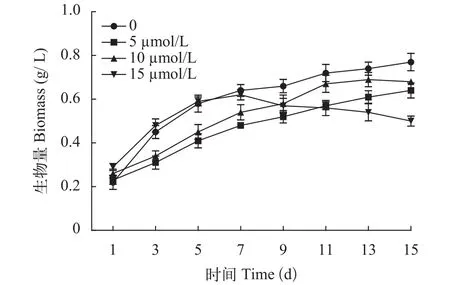
图1 不同浓度的MLT对微藻生长的影响Fig. 1 Effects of MLT on the biomass of H. pluvialis during induction process
2.2 MLT对雨生红球藻虾青素积累的影响
由图2可知, 在诱导条件下不同浓度的MLT对细胞内虾青素积累影响存在差异, 虾青素积累量与MLT间存在明显的剂量效应, MLT处理组中,MLT浓度为10 μmol/L时虾青素含量显著增加, 而在其他浓度处理组虾青素含量没有明显变化。10 μmol/L MLT处理组在开始诱导9d后虾青素积累开始显著增加, 13d时虾青素积累量达到最大(31.32 mg/g), 是对照组(13.27 mg/g)的2.36倍。在MLT浓度为5和15 μmol/L时, 虾青素的最大积累量分别为15.41和7.86 mg/g, 可能是高浓度的褪黑素抑制虾青素的积累。10 μmol/L的MLT处理虽然对微藻生物量没有积极影响, 但是明显提高了虾青素的积累量。
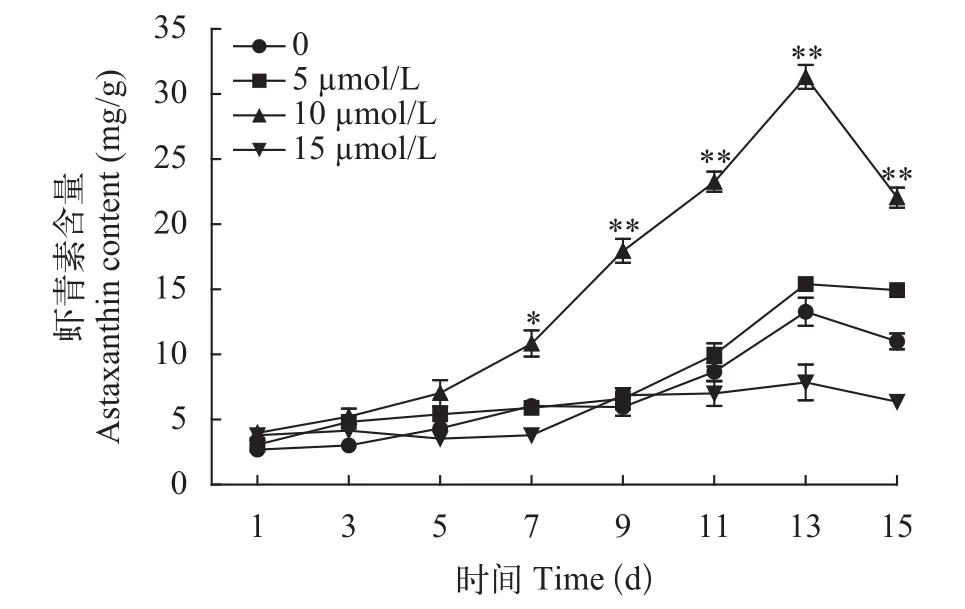
图2 不同浓度MLT对雨生红球藻虾青素含量的影响Fig. 2 Effects of MLT on astaxanthin content of H. pluvialis during induction process
2.3 MLT对微藻细胞ROS的影响
活性氧检测试剂盒中的探针DCFH-DA可以自由穿过细胞膜,进入细胞后被胞内的酯酶水解成DCFH,ROS氧化无荧光的DCFH生成有荧光的DCF,检测细胞内荧光强度得到细胞内活性氧的水平。图3 显示,细胞暴露在高光照、缺氮胁迫条件时,胞内的活性氧水平快速提高,第7天时,胞内活性氧水平达到最高,随后呈现出下降趋势,在培养过程中,10 μmol/L MLT处理组和对照组呈现出相似的趋势,但始终低于对照组,Shi等[7]在狗牙根(bermudagrass)中也有相似的结果。ROS抑制剂组活性氧一直处于很低的水平,同时对虾青素含量进行测定,发现虾青素含量很低(图3)。结果表明,活性氧对雨生红球藻虾青素的合成至关重要,适量的ROS触发虾青素积累,过高时对微藻细胞产生毒害,过低时又不能有效的触发虾青素积累。
2.4 MLT诱导对细胞NO的影响
NO是一种不稳定的气态分子,在细胞内很快代谢成硝酸盐和亚硝酸盐,通过检测两者的总量来计算NO的量。结果显示外源MLT能显著提高细胞内NO含量(图4),NO水平起初逐步下降,在第7天时, 10 μmol/L MLT处理组达到最高(73 μmol/L),是对照组的4.06倍,此时,MLT处理组虾青素的含量也开始明显高于对照组(图4),抑制剂处理显著抑制了NO浓度,虾青素的最大积累量也显著下降,达到9.36 mg/g,分别是对照组和10 μmol/L MLT处理的64.84 %和23.94 %。结果表明,NO在虾青素生物合成中起到一定的调控作用,有助于虾青素的积累。
2.5 MLT诱导对藻细胞内SA含量的影响
SA是一种信号分子, 参与植物对胁迫条件的应激反应, 能调节植物的生长发育。10 μmol/L MLT处理的SA水平第1、第3天时显著高于对照组,第7天时达到最高随后下降, 对照组在第9天时达到最高, SA抑制组波动不大且含量较低(图5)。由图5 可知, SA抑制剂组虾青素的含量很低。结果表明, MLT处理组能有效调节SA含量, 且促进了虾青素的增长, SA被抑制时, 虾青素含量大幅降低,可见, SA在雨生红球藻虾青素生物合成过程中起着重要作用。
2.6 MLT诱导对dxs基因表达量的影响
用qRT-PCR方法检测不同诱导时间内, 10 μmol/L MLT诱导组和对照组间雨生红球藻虾青素相关合成基因dxs的表达量(图6), 结合虾青素含量变化趋势, 10 μmol/L MLT处理组dxs基因表达量第7天时显著高于对照组, 第9天时, 达到最高, 是对照组的11.7倍, 虾青素的含量第7天开始明显高于对照组,第13天时达到最高31.32 mg/g, 此时dxs基因的表达量是对照组的2.74倍。
3 讨论
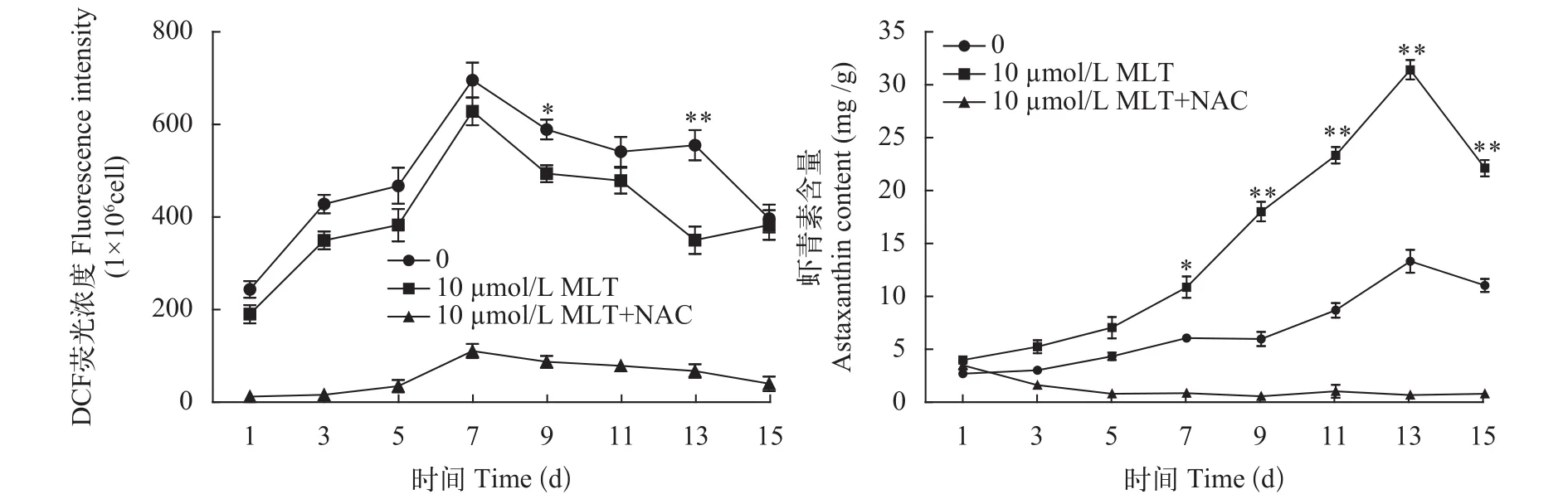
图3 MLT和ROS抑制剂对雨生红球藻内ROS水平和虾青素含量的影响Fig. 3 Effect of MLT and a ROS inhibitor on the ROS levels and astaxanthin content of H. pluvialis during induction process
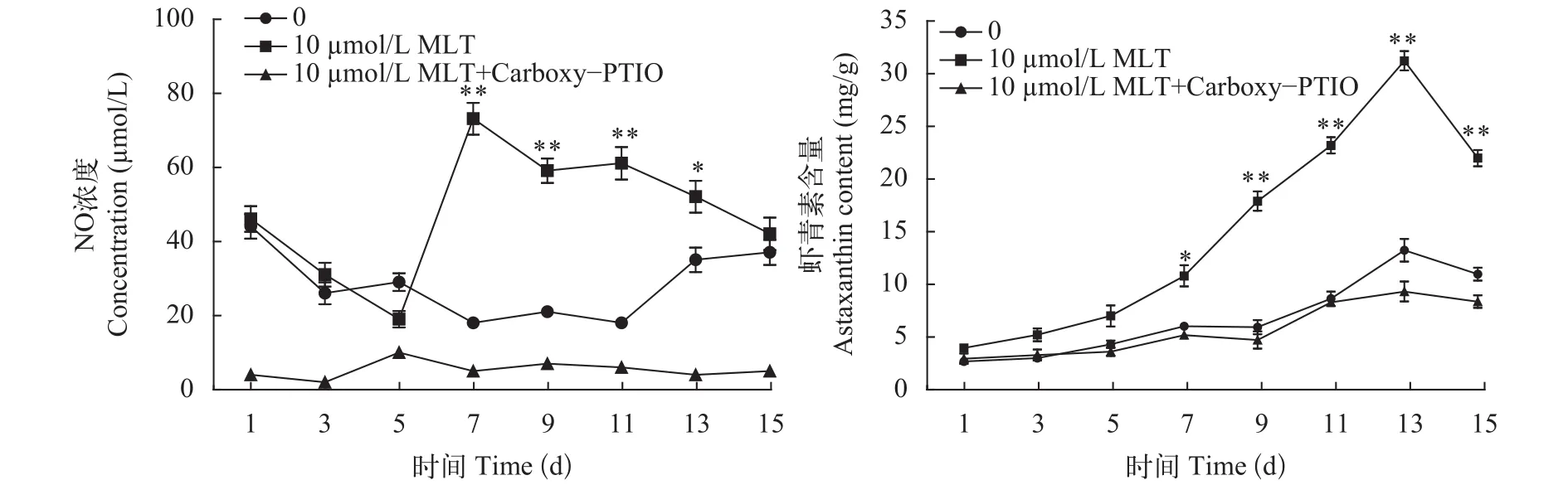
图4 MLT和NO抑制剂对细胞内NO浓度和虾青素含量的影响Fig. 4 Effects of MLT and NO inhibitor on the NO levels and astaxanthin content of H. pluvialis during induction process
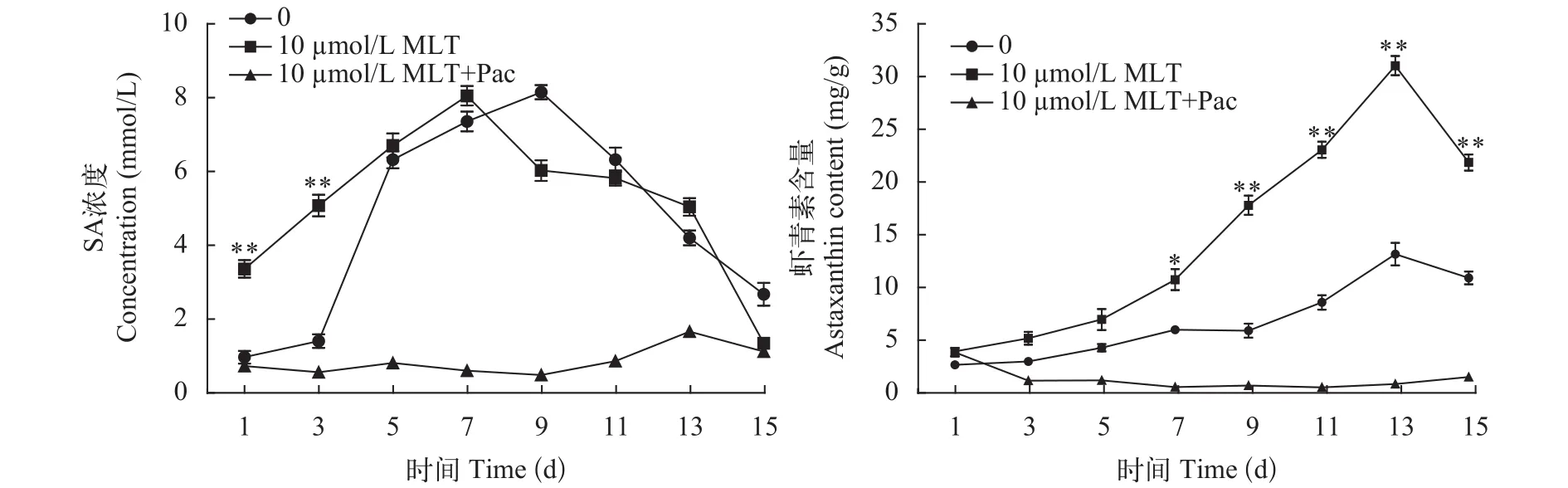
图5 MLT和SA抑制剂对细胞内SA水平和虾青素含量的影响Fig. 5 Effects of MLT and Salicylic acid (SA) inhibitor on the SA levels and astaxanthin content of H. pluvialis during induction process
本文探究了在高光照、氮缺陷的胁迫条件下,外源添加不同浓度MLT对雨生红球藻虾青素积累的影响及其可能的调控机制。在10 μmol/L MLT处理下, 藻细胞生物量较对照组无显著性变化。这与Tal等[22]的研究结果相似, 添加MLT对莱茵衣藻(Chlamydomonas reinhardtii)藻细胞的生长没有明显影响; Li等[19]研究表明外源添加褪黑素对单针藻生长也无显著性影响。此外, 本研究中外源添加MLT可提高雨生红球藻中虾青素的含量, 在10 μmol/L MLT诱导条件下藻细胞中虾青素的积累量可达31.32 mg/g, 与其他文章所述的雨生红球藻中虾青素含量相比优势较明显[23,24]。添加100 mg/L的褪黑素处理葡萄(Vitis vinifera)幼果, 可引起葡萄果实内源褪黑素积累, 促进果实膨大[25]。外源添加褪黑素可提高高温胁迫下黄瓜幼苗抗坏血酸代谢活性[26], 增强ROS清除能力[27], 提高氮代谢能力[28], 促进高温逆境下黄瓜幼苗的生长。另一方面, 在非生物胁迫条件下, MLT可通过多种机制调控植物胁迫应答, 清除过剩ROS及调控信号分子备受关注[29]。
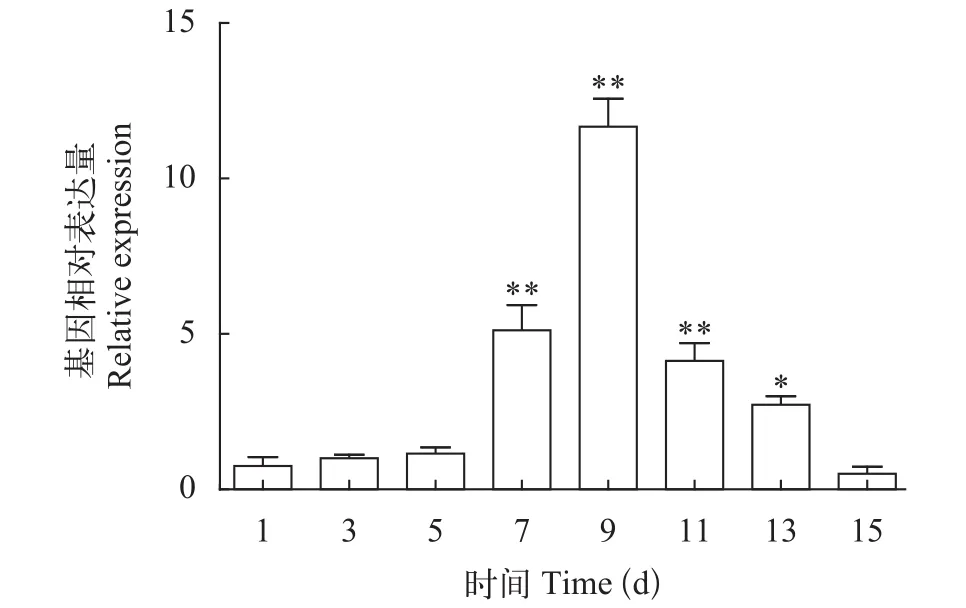
图6 MLT对dxs基因表达量的影响Fig. 6 Effects of MLT on the transcriptional expression level of dxs during induction process
有研究表明ROS在细胞内次生代谢产物积累中起着双重作用, 一方面, 能破坏细胞的生物大分子, 另一方面, ROS产生能促进雨生红球藻和杜氏藻中β-胡萝卜素的积累[14,30,31]。在本研究中, 高光照和氮缺陷条件引起了细胞内ROS的迸发, MLT作为抗氧化剂缓解了ROS的急剧增加, 在一定程度上保护了细胞内的生物大分子, 同时诱发了细胞内虾青素大量合成。此外, ROS的产生可能激活机体多种抗氧化系统进而调控ROS水平, 保持ROS产生与清除的平衡。在高等植物中, 抗性受多重信号转导途径调控, 其中SA和NO是重要的信号分子。Shi等[32]研究发现, 外源添加MLT能提高拟南芥中NO和SA含量, 进而增加其抗性相关基因表达量, 表现为抗病性提高, 而雨生红球藻正是通过大量积累虾青素来应对不利环境的[33,34]。在10 μmol/L MLT诱导雨生红球藻时, 下调了ROS水平, 上调了NO、SA含量, 促进了虾青素的积累。此外, Kováčik等[35]发现向Coccomyxa subellipsoidea中添加抗氧化剂维生素C降低了ROS水平, 提高了NO的含量, 进而提高了藻细胞对非生物胁迫的耐受性。Gao等[36]外源添加SA促进了雨生红球藻中虾青素的积累。可见, 褪黑素可能是通过调控藻细胞内ROS、NO和SA的含量来促进虾青素的积累的。为了验证上述假设, 本试验在10 μmol/L MLT处理组的基础上分别添加ROS、NO和SA抑制剂, 发现ROS、NO和SA水平受到明显抑制, 虾青素的积累量显著降低。可见信号分子ROS、NO和SA均参与虾青素的生物合成。
诸多报道显示外源添加一些植物生长调节剂,虾青素大量积累往往伴随着相关生物合成基因表达水平的提高。添加赤霉素和茉莉酸甲酯可显著提高dxs基因表达水平, 同时提高了虾青素的产量[37,38],dxs酶基因是虾青素生物合成途径中第一个限速酶(1-脱氧-D-木酮糖-5-磷酸合成酶, DXS)调控基因, 对比dxs基因表达量与虾青素积累量可知, 二者虽不具有同步性, 但dxs基因表达量增加后藻细胞虾青素大量积累, 可能是由于MLT诱导提高了dxs基因的表达量, DXS活性增高, 从而促进了丙酮酸和甘油醛-3-磷酸(GA3P)向DOXP的转化, 为后续虾青素的大量合成提供了足够的底物, 进而提高了虾青素的积累量。
综上所述, 在高光照联合氮缺陷培养条件下,诱发了雨生红球藻细胞中的ROS的迸发, 添加MLT时能清除细胞内过多的ROS, 保证了细胞的正常代谢活性; 另一方面, 褪黑素增加SA和NO的水平, 可能通过调控SA和NO依赖抗性途径增强雨生红球藻对胁迫条件的响应, 上调虾青素生物合成酶基因dxs的表达, 进而促进虾青素的合成。本研究表明, 添加适量浓度的MLT有利于雨生红球藻中虾青素的积累, 当MLT浓度为10 μmol/L MLT时, 藻细胞中虾青素可达31.32 mg/g; 此外, 本研究中MLT诱导雨生红球藻中虾青素的大量积累, 可能与其调控细胞内ROS、SA、NO及dxs基因表达有关, 后续分子生物学机制需进一步探究。
