海蜇胚胎发育和变态过程超微观察
2018-09-13刘春胜陈四清王爱民顾志峰
刘春胜 万 逸 高 菲 陈四清 王爱民 顾志峰
(1. 海南大学南海海洋资源利用国家重点实验室, 海口 570228; 2. 海南大学海洋学院, 海口 570228;3. 中国水产科学研究院黄海水产研究所, 青岛 266071)
刺胞动物为双胚层、辐射对称的简单生物, 在分类学上其可分为仅具固着生活的珊瑚虫纲(Anthozoa)和水螅纲(Hydrozoa), 以及具固着和浮游交替世代的钵水母纲(Scyphozoa)和立方水母纲(Cubozoa)[1,2]。在进化生物学上, 刺胞动物是最原始的真后生动物, 其被认为是其他高等多细胞动物的起点, 具有极其重要的地位[3]。因此, 解析该类群的发展演变过程对阐明两侧对称动物多样化进化模式, 重构生命演化历程具有重要意义。而研究其早期胚胎发育和变态过程是解析当前刺胞动物演化模式的主要方法之一[2,4,5]。
截至目前, 水螅纲和珊瑚虫纲中多个物种的发育模式已初步建立并不断完善, 如淡水水螅(Hydra)、有种贝螅(Hydractinia echinata)、海葵(Nematostella vectensis)、珊瑚(Acropora millepora)等[6—9]。与之相比, 钵水母纲和立方水母纲物种的发育模式研究报道较少[10,11]。现有证据表明, 在胚胎发育细胞轴向构建过程中, 固着生活的珊瑚类和水螅类物种的某些同源基因表达模式存在显著的差异[12—14], 并据此推断该现象是由于6亿多年前不同刺胞动物物种进化差异所造成的[15]。
海蜇(Rhopilema esculenta)隶属于钵水母纲(Scyphozoa)根口水母目(Rhizostomeae)根口水母科(Rhizostomidae)海蜇属(Rhopilema), 分布于中国、日本、朝鲜沿岸以及苏联远东水域, 是一种经济价值极高的大型可食用水母, 它也是我国研究最为深入的钵水母种类[16]。作为世界上唯一的人工养殖类可食用水母, 海蜇在我国的海洋渔业中占有重要地位, 年产值近百亿[17]。我国对海蜇研究也多是将其作为渔业资源来开展, 相关成果主要集中在苗种繁育、池塘养殖、资源调查以及增殖放流等领域[17—21], 而对其早期胚胎发育研究涉及较少, 且多仅局限于简单的形态描述[16,22,23]。基于此, 本研究拟通过扫描电镜、透射电镜和蛋白银染色等多种组织学方法对海蜇胚胎发育和变态过程进行观察,旨在系统研究其早期发育特点。
1 材料与方法
1.1 材料获取
实验于2015年8月20—28日在山东省海洋捕捞生产管理站开展海蜇有性繁殖实验, 待海蜇产卵后(产卵时间为00:30)用400目筛绢收集足量的受精卵转移至500 L白色塑料桶中, 微充气孵化, 孵化水温(26±1)℃, 盐度26—27、光照强度400—500 lx。用Olympus AX显微镜定期观察胚胎发育过程, 待受精卵发育至不同时期后, 用400目筛绢收集一定量个体转移至10 mL 离心管中, 然后用2.5%戊二醛(0.2 mol/L PBS配制, 4℃)清洗3遍, 最终固定于相同浓度的戊二醛溶液中。附着后的海蜇杯状体和4触手螅状体2个发育阶段, 则需在Olympus SZX体视镜下用解剖刀小心将其从聚乙烯波纹板表面刮下,而后用2.5%戊二醛清洗并固定。胚胎发育不同阶段取样时间参照刘春胜等[16], 具体如下: 受精卵为排卵后10—15min; 2细胞期为排卵后25—30min,64细胞期为排卵后约3h, 原肠胚为排卵后约5h, 早期浮浪游虫为排卵后15h, 后期为排卵后48h, 杯状体为排卵后50h, 4触手螅状体为排卵后72h。
1.2 扫描电镜样品制备与观察
取一定量的固定样品转移至1.5 mL离心管中,用PBS磷酸缓冲液清洗, 乙醇梯度脱水后(30%、50%、70%、85%、90%各 1 次, 每次10min,100%乙醇2次, 每次15min), 进行乙酸异戊酯置换,而后进行二氧化碳临界干燥处理(XD-1 型, 美国Eiko公司)和喷金镀膜(IB-3型, Eiko公司, 美国), 最后进行扫描电镜(JSM-840, JEOL公司, 日本)观察。
1.3 透射电镜样品制备与观察
取适量固定样品, 用PBS清洗后, 1%锇酸4℃固定4h, PBS 缓冲液冲洗后, 乙醇梯度脱水, Epon812环氧树脂包埋。样品包埋完成后用Ultracut E超薄切片机(Ultracut EUItramicrotome, Reichert-Jung 公司, 德国)半薄切片, 厚度1 μm, 甲苯胺蓝染色, 而后置于Olympus AX显微镜下观察。定位后再修块并进行超薄切片, 厚70 nm, 醋酸双氧铀硝酸铅染色,透射电镜(JEM-1200EX, JEOL公司, 美国)观察。
1.4 蛋白银染色制片与观察
海蜇不同发育阶段制片方法采用Wilbert的蛋白银染色法[24]。将制备样片置于Olympus AX显微镜下观察, 拍照。
2 结果
2.1 海蜇早期发育扫描电镜观察
海蜇受精卵直径约为90—120 μm, 其从分裂开始至原肠胚阶段, 细胞分裂方式为均等分裂(图1d)。对64细胞进一步观察发现, 其细胞与细胞之间存在非常多的胞间连接(图2a)。进入原肠期后, 胚胎出现内陷(图1d), 而后细胞逐渐拉伸变为椭圆形。进入浮游的浮浪游虫阶段(图1e), 浮游幼虫继续伸长,在附着变态前其长轴达到210 μm (图1f)。当遇到适宜附着基后, 浮浪幼虫后端细胞经一系列变化,分化成具黏附能力的柱状细胞附着于附着基表面(图1g)。约50h后, 变态浮浪游虫从基部的附着部位开始拉伸, 顶部膨大, 形成高脚酒杯状的杯状体(图1h)。对即将变态的浮浪幼虫附着部位(图2b、2c)观察发现, 其与附着基黏附的细胞多呈不规则柱状,且具小囊泡状结构。而杯状体附着部位则发育为盘状(图2d)。

图1 海蜇胚胎发育和变态Fig. 1 Embryonic development and metamorphosis of R. esculentum

图2 细胞连接及附着部位显微结构Fig. 2 Ultrastructure of cell junction and attachment site
2.2 海蜇早期发育透射电镜观察
透射电镜结果表明, 原肠期细胞未出现分化,呈长扇形(长轴长约17 μm), 细胞核位于外部1/3处,颜色较深的卵黄体位于内部1/2处(图3a)。细胞朝向外部位置线粒体较多(图3b), 表明细胞代谢活跃。进入浮浪幼虫期后, 内部空腔消失, 呈现实体化(图3c)。细胞进一步分裂, 并出现细胞分化, 外胚层近中胶层细胞分化出现刺细胞, 最外层细胞出现空泡化, 且部分外部细胞内部卵黄体逐步分解为卵黄颗粒, 细胞间具紧密连接(图3c、3d、3e)。海蜇浮浪幼虫发育过程中, 尽管细胞长轴变长, 但其内部细胞与早期相比无显著差异(图3f、3g、3h)。
海蜇浮浪游虫附着变态后, 其外层细胞间布满紧密连接, 使整个外部细胞黏连在一起, 几乎所有外部细胞内部具有空泡, 且空泡化体积更大(图4a、4c)。此外, 外胚层细胞内部出现疑似凋亡小体结构(图4c),内胚层细胞内出现大量核糖体(图4d)。72h 4触手螅状体以中胶层为界限, 所有外层细胞均出现极高的空泡化, 内胚层细胞仅出现少量的空泡化, 且仍富含有颜色较深的卵黄体(图4e、4f)。该阶段在螅状体表面观察到成熟的刺细胞(图4g), 并发现到大量疑似凋亡小体的结构(图4h)。
2.3 纤毛的形成与退化过程观察
通过海蜇早期不同发育阶段蛋白银染色制片观察发现, 其在早期和晚期浮浪游虫阶段, 以及杯状体阶段具有纤毛(图5), 而原肠胚和4触手螅状体阶段未发现纤毛结构。
2.4 胚胎发育各阶段对细菌的吞噬作用
通过对原肠期、浮浪游虫期和即将变态的浮浪游虫三个发育阶段的扫描电镜观察发现, 仅浮浪游虫阶段表面附着有细菌(1.4—2 μm)(图6c、6d),其他时期细胞表面仅有大量<400 nm非生物体状囊泡(原肠期, 图6a、6b; 浮浪幼虫变态期, 图6g、6h)。透射电镜结果亦发现在浮浪游虫阶段, 海蜇能够吞噬细菌, 进行胞内消化(图6e、6f)。
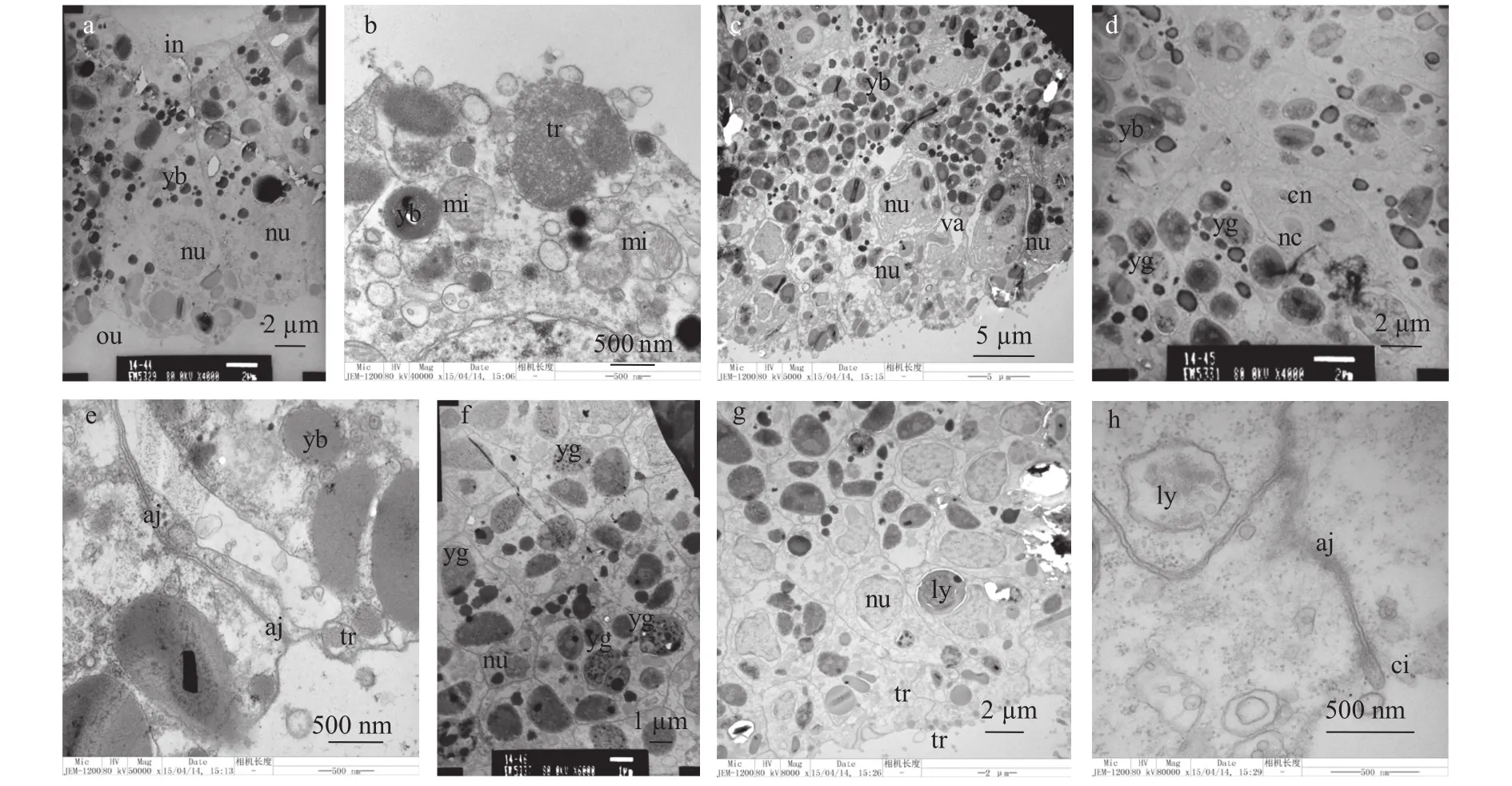
图3 原肠期和浮浪游虫期透射电镜观察Fig. 3 Representative images of gastrula and planula with transmission electron microscopy (TEM)
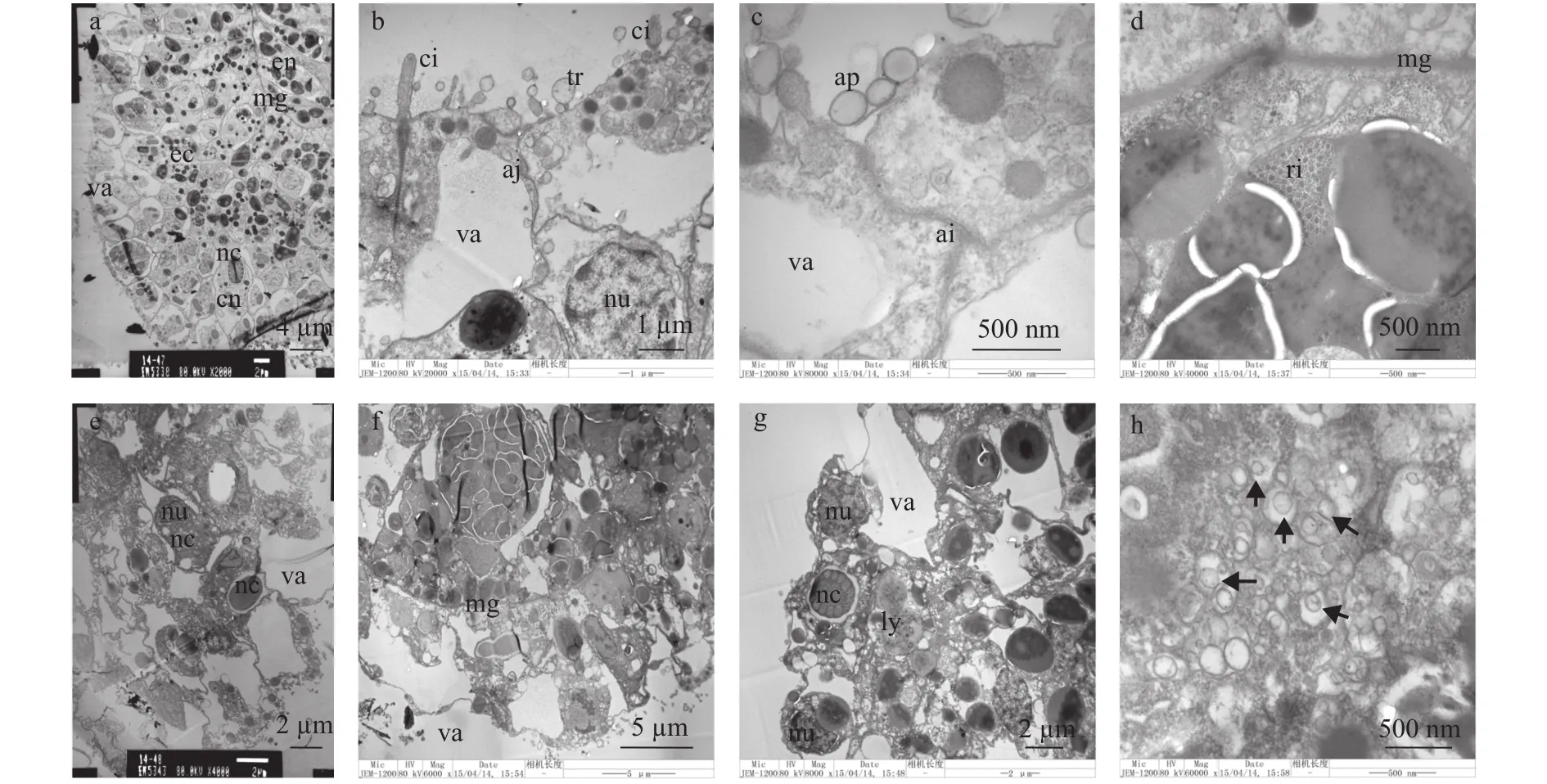
图4 杯状体期和4触手螅状体期透射电镜观察Fig. 4 Representative images of scyphostoma and 4-tentacle polyp with TEM
3 讨论
3.1 海蜇早期发育过程中的细胞学特征
刺胞动物为低等双胚层生物, 其生物体由外胚层、内胚层以及两者间的中胶层组成。通过对其整个早期发育阶段研究发现, 海蜇在原肠期之前细胞为均等分裂, 且未出现显著的细胞分化现象。而同为钵水母的海月水母其早期多细胞阶段即出现了不均等分裂[25]。海葵(Nematostella vectensis)则在4细胞阶段即出现不均等分裂[26]。由此可以初步推测海蜇的细胞分化时期与其他刺胞动物相比要延后。
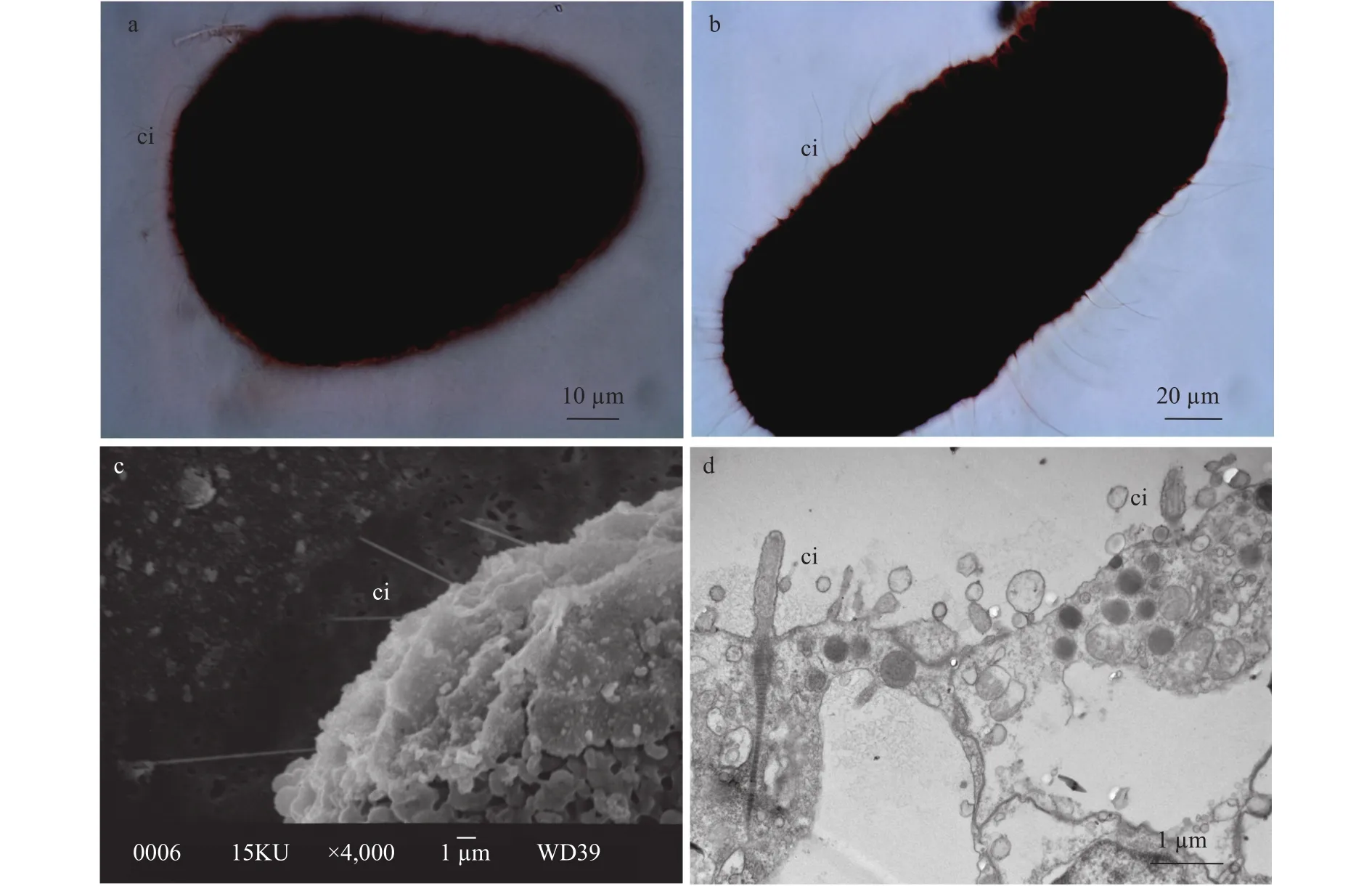
图5 浮浪游虫和杯状体期纤毛显微观察Fig. 5 Representative images of cilium at planula and scyphostoma stage
在细胞分化发育过程中, 海蜇在早期浮浪游虫的外胚层细胞中观察到空泡, 且随着其发育空泡比例逐渐升高, 在72h的4触手螅状体时期几乎所有的外胚层细胞均出现高度的空泡化, 而内胚层细胞在其附着后才出现少量的空泡化。尽管该现象在海月水母中已有报道, 但其空泡化仅出现在内胚层[11]。进一步研究发现, 在空泡化现象较为普遍的杯状体和4触手螅状体时期, 观察到大量疑似凋亡小体的囊泡, 推测这2种现象是同步进行的, 且与海蜇细胞分化和重排有密切关系。
与其他高等动物相比, 刺胞动物细胞类型较为单一, 本实验在海蜇早期发育阶段共鉴定3种外胚层细胞(纤毛运动细胞、刺细胞和普通体细胞), 未发现神经及感应相关细胞。而在同属钵水母纲的朝天水母(Cassiopeia xamachana)中鉴定了4种[27]。与之相比, 水螅纲和珊瑚虫纲早期幼虫中细胞种类较多, 包括上皮肌肉细胞, 腺细胞、感觉前体细胞、神经细胞和刺细胞共5种[28,29], 而立方水母纲较少仅2种[30]。相关报道已证实了海蜇浮浪游虫具有趋弱光性和应激反应能力[16], 但在本研究未发现相关类型细胞, 或许与所用的方法有关。在已报道的刺胞动物早期发育相关研究中, 表明神经和感应细胞数量相对较少, 透射电镜观察结果具随机性,难以对特定细胞准确定位和鉴定。与之相比, FMRFamide 荧光免疫反应靶向性较强, Yuan等[11]利用该方法确定了海月水母浮浪游虫中神经细胞仅存在于口周边的外胚层。此外, 本实验在对刺细胞观察中, 发现海蜇的刺细胞最早形成于早期浮浪游虫外胚层近中胶层位置, 其后逐渐成熟, 位置亦逐步外移, 当发育至4触手阶段才观察到成熟刺胞囊, 由此推断, 4触手螅状体之前各阶段海蜇是不能主动捕食的。该结果与刘春胜[16]等关于海蜇早期摄食研究结果一致。
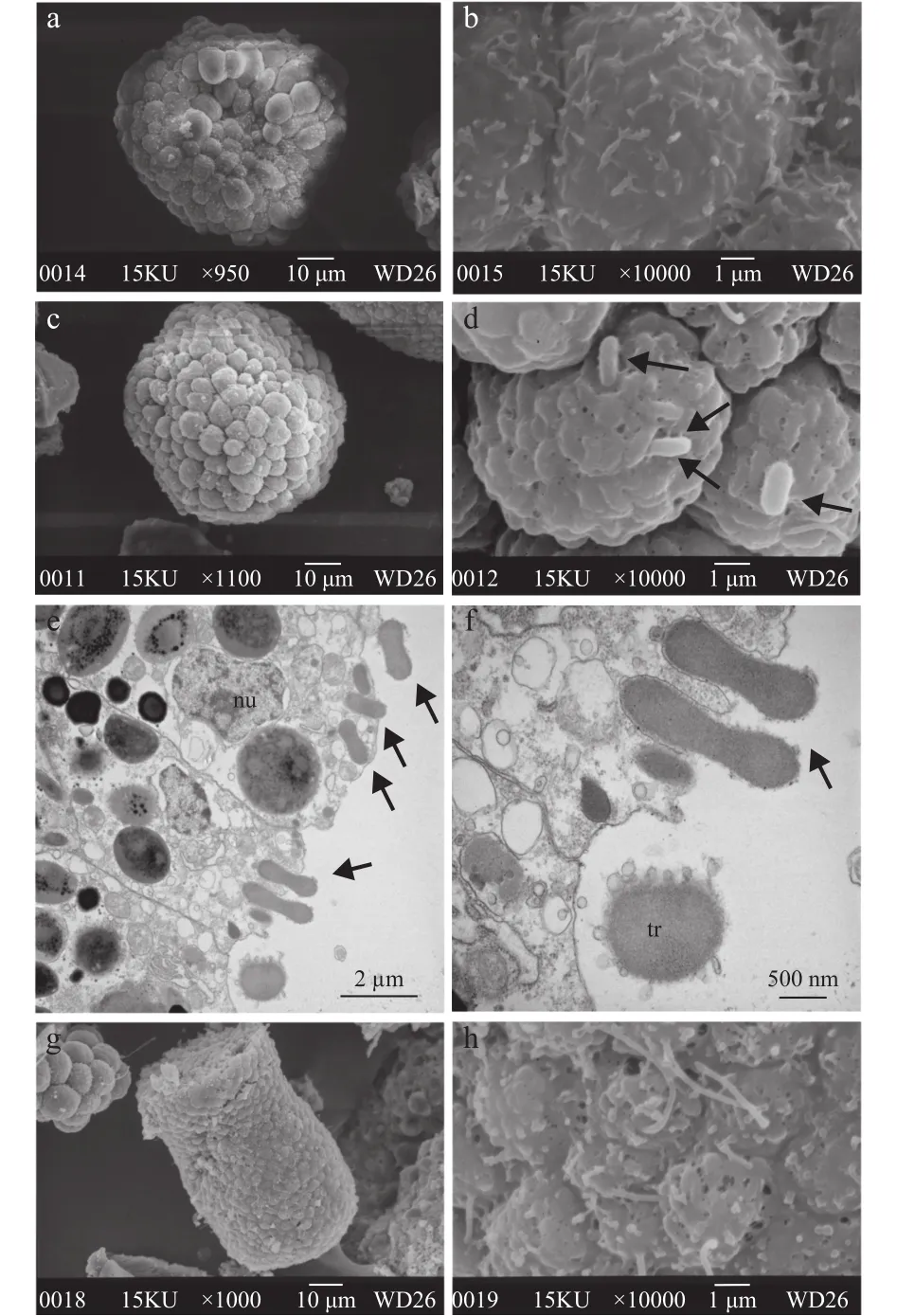
图6 不同发育胚胎阶段细胞内吞Fig. 6 Endocytosis of different developmental stage
3.2 浮浪游虫纤毛的形成与退化
所有刺胞动物早期发育过程均需经历由静止到浮游, 再到附着变态的过程, 而纤毛是浮浪游虫趋利避害的主要运动器官。尽管大量研究对纤毛的结构和功能进行了描述, 但截至目前尚未有纤毛形成与退化相关报道[11,26,30—32]。本研究利用透射和扫描电镜, 以及蛋白银染色方法首次对各阶段纤毛变化进行了系统研究, 发现海蜇纤毛形成于早期浮浪游虫阶段, 其附着后逐渐退化, 在4触手螅状体阶段才完全消失, 其存在时间几乎与浮游时间完全吻合。
3.3 海蜇早期发育营养来源
浮游幼虫是刺胞动物、贝类、鱼类等多数海洋生物早期发育的必经阶段, 其营养来源主要由摄食浮游饵料和内源营养2种类型组成[33,34]。对包括刺胞动物在内的大部分物种而言, 早期浮游生物为内源性营养型, 即卵黄内营养物质[28,29,35]。在海蜇早期发育各个时期, 其内部亦发现大量的富含颜色较深的卵黄体, 如原肠期卵黄体分布于细胞靠内1/2处, 浮浪幼虫、杯状体和4触手螅状体的外胚层近中胶层细胞和内胚层细胞中亦观察到大量富含卵黄颗粒的细胞。由此推断, 内部卵黄营养是海蜇早期发育的营养来源之一[16]。然而本实验在浮浪游虫阶段首次观察到海蜇外层细胞能够主动吞噬细菌, 且该现象未在后期的杯状体和4触手螅状体阶段中发现, 由此我们推断海蜇在较为活跃的浮浪幼虫阶段能够通过胞吞作用摄食细菌。尽管大量报道证实了细菌在刺胞动物附着变态过程中具有相关性, 并证实菌膜能够产生刺激刺胞动物浮浪游虫附着变态[36—38]。但尚未有刺胞动物早期摄食细菌的报道, 本实验首次观察到了刺胞动物浮浪幼虫摄食细菌现象, 具有重要意义。
