直接进样-质谱检测指纹图谱技术 结合化学计量学研究干燥方法 对黄花菜质量的影响
2018-09-13苏东林李高阳
刘 伟,赵 杨,苏东林,李高阳,单 杨,*
(1.湖南省农业科学院湖南省农产品加工研究所,湖南长沙 410125; 2.中南大学隆平分院,湖南长沙 410125 3.贝兹维尔人类营养研究中心,美国马里兰 20705)
黄花菜(Hemerocallisfulva)又名金针菜,为百合科多年生草本植物,是我国的特色蔬菜之一。黄花菜营养丰富,含有大量糖类、维生素及多种人体必需的氨基酸,具有平肝养血、消肿利尿、抗菌消炎等功能[1-7]。目前,我国黄花菜种植面积约60万亩,其中主要分布在湖南、陕西、甘肃、山西4个产区[2],年产鲜黄花菜56~80万吨,加工干制黄花菜10~16万吨,产值达100亿元以上。
黄花菜采收期集中,采后10 h就黄化、开放、衰老,降低了其营养价值和商品价值,且由于采摘时间一般在早晨,露水较重,病原微生物极易侵染,加之采后环节中的机械损伤,在采后24 h就开始变质。常温下新鲜黄花菜耐存性差,用普通薄膜包装,一般2 d后全部开花,4 d后腐烂[1-2]。干制加工是当前黄花菜延长贮藏保质期的唯一途径。黄花菜的干制只有小部分采用烘干机械或机械化的烘烤厂房,大部分农户依然采用传统的太阳晒干的方式,即用蒸煮后进行太阳晒干,但遇阴雨天气易出现大量发霉变质,降低黄花菜商品品质[2]。目前,在食品行业广泛应用的干燥方法有普通热风干燥、微波干燥、远红外干燥、真空冷冻干燥等[8-12],研究主要集中在红枣、胡萝卜等大宗干制农产品品质的影响,而黄花菜干制方面的研究极少,不同干燥方法黄花菜化学成分的变化尚未报道。
指纹图谱已被广泛应用于食品原料质量控制和加工过程监控等研究中,在食品工业现代化进程中起到了尤为重要的作用。采用不同的分离手段(色谱、光谱)及检测器,可以得到不同类型的指纹特征。直接进样-质谱检测指纹图谱技术(FIMS)是一种新颖、高效的指纹图谱技术,其最大特点是样品在经过提取、滤过后不需要色谱分离,直接导入质谱仪分析,在1~2 min即得到样品的总离子流图和质谱信息[13-17]。质谱原始数据经预处理后,通过主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA),可以建立化学判别式及选择化学标记物预判未知样品的信息,直观、深入地分析原料或产品质量[18-24]。此方法结合化学计量学能有效评估不同样品在化学成分方面的相似性和差异性,同时,采用超高效液相色谱高分辨率质谱(UHPLC/HRMS)进行指纹图谱分析有助于样品中代表性化学标记物的鉴别。目前,此方法已被应用于中药材、植物材料、膳食补充剂及水果等多种领域[13,25]。
本实验以黄花菜为原料,采用直接进样-质谱检测指纹图谱技术结合化学计量学快速分析自然干燥、热风干燥、真空冷冻干燥3种不同干燥方法的黄花菜,对其代表性的成分进行研究,筛选出代表性的特征成分,为黄花菜的加工利用提供理论参考。
1 材料与方法
1.1 材料与仪器
新鲜黄花菜(品种:猛子花) 均于7月采自湖南省衡阳市祁东县,根据色泽和外形,选择均一的成熟度进行采收,一般为抽穗后大约27~35 d,所有的样品在采摘后30 min内送到实验室,并在4 ℃储存待干燥处理;乙腈、甲醇 美国Fisher Scientific公司;甲酸 美国Sigma/Aldrich公司,其他试剂 均为分析纯。
Thermo Fisher LTQ Orbitrap XL质谱仪,包括Accela 1250二元泵、PAL-HTC-Accela自动进样器、Accela 1250 PDA检测器、G1316A Agilent柱温箱、ESI 离子源、Xcalibur工作站 美国赛默飞世尔科技有限公司;AL 204型十万分之一分析天平 梅特勒-托利多仪器有限公司;KQ 5200E型超声波清洗器 昆山市超声仪器有限公司;TGL-16M台式高速冷冻离心机 长沙迈佳森仪器设备有限公司;微量移液器 德国Eppendorf公司;FD-2真空冷冻干燥机 北京博医康实验仪器有限公司;热风干燥加工线 新发食品有限公司自制。
1.2 实验方法
1.2.1 黄花菜的干燥 真空冷冻干燥:真空度0.6 Pa,温度-50 ℃,干燥时间24 h,干燥至水分含量10%左右。每个样品重复3次,10组样品标记为1~30。
自然干燥:黄花菜在100 ℃ 蒸汽漂烫2 min后,在太阳下凉晒48 h,至水份含量10%左右。每个样品重复3次,10组样品标记为31~60。
热风干燥:黄花菜在100 ℃ 蒸汽漂烫2 min后,在55 ℃热风干燥箱中干燥9 h,至水份含量10%左右。每个样品重复3次,10组样品标记为61~90。
样品干燥后粉碎过80目网筛,收集于密封袋中室温保存待分析。
1.2.2 样品制备 取干燥后黄花菜粉末样品0.30 g,置于15 mL离心管中,加入10.0 mL甲醇-水溶液(70∶30,v/v),室温下700 W超声提取60 min,提取液于5000 r/min离心15 min,取上清液稀释100倍后过0.45 μm微孔滤膜,即得待测样品提取液。为了减少化合物分解所引起的误差,所有样品分析在提取后24 h内完成。FIMS分析,每个样品重复3次,进样量5 μL。
1.2.3 FIMS条件
1.2.3.1 色谱条件 C18保护柱(Adsorbosphere All-Guard Cartridge,5 μm,4.6 mm×7.5 mm);流动相为0.1%甲酸乙腈和甲酸水溶液(50∶50)等度洗脱,流量0.5 mL/min;进样量为5 μL,每个样品平行进样5次,每次分析时间为2 min。
1.2.3.2 质谱条件 采用ESI离子源,在负离子模式下采集数据。数据采集范围m/z 100~1500。质谱参数通过Xcalibur软件的自动优化,参数为:采用电喷雾离子源(ESI),鞘气为80单位,辅助气为15单位,喷雾电压为-4.5 kV,毛细管温度为300 ℃,毛细管电压为-40.0 V,套管透镜补偿电压为-150 V。
1.2.4 FIMS的数据采集 样品经高效液相色谱仪自动进样系统吸取,通过C18保护柱滤除杂质(以减少对质谱检测器的污染),不经色谱柱分离直接进入质谱检测器检测。在样品的检测过程中,采用全扫描模式,扫描范围为100~1500 m/z,每个样品平行进样3次。
1.3 数据处理
质谱分析获得的响应离子强度与化合物质荷比组成的数据,经Xcalibur软件处理后导入Excel办公软件和多元数据分析软件Simca-P 11.5(瑞典Umetrics公司)进行UV标度化预处理,进行PCA和PLS-DA分析,对黄花菜进行成分评价和判别。
2 结果与分析
2.1 3种不同干燥处理黄花菜的FIMS指纹图谱分析
对3种不同干燥处理黄花菜进行了FIMS指纹图谱分析,在负离子模式下质谱图见图1。在本研究中,样品不通过色谱柱进行分离,经保护柱滤除杂质以后直接进行质谱分析,每次分析只需2.0 min。从图中可以看出,负离子模式下质谱图给出离子信息丰富,响应强度较高的离子主要集中在m/z 100~1000,除了m/z 191.06、259.09、341.11、503.16这4个强度最高的离子以外,m/z 421.15、609.15、665.21、711.22、827.27及989.32等离子也出现较高的响应强度。同时,不同处理的样品的共有离子响应强度存在差异,表明不同干燥处理黄花菜含有相似化学组成,而其含量各不相同。
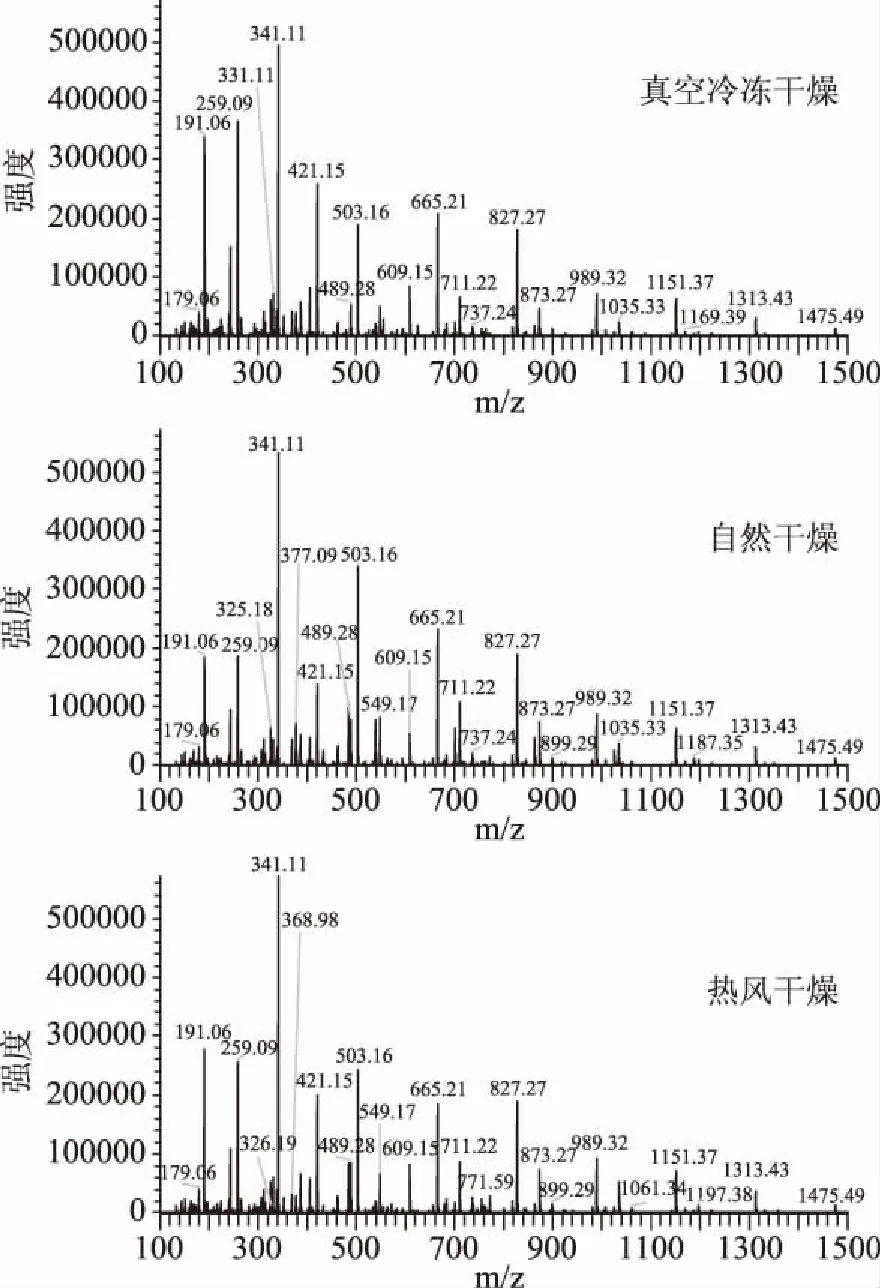
图1 负模式下不同干燥处理黄花菜的质谱图Fig.1 Representative MS for treatment of daylily in negative modes
FIMS与其它指纹图谱技术相比最大的优势在于可完成对大量样品的快速分析。本实验的30批不同干燥处理黄花菜的质谱分析仅需60 min。通过质谱数据的直观分析,可以发现不同干燥处理黄花菜在负离子模式下的相似信息及不同干燥处理后差异较大的离子信息。然而,总离子流图中的大量离子信息仅直观分析不能科学、全面地反映样品之间的差异,需要合化学计量学方法进一步的深入分析。同时,为了增加数据分析的可靠性,样本平行分析3次。
2.2 PCA分析
由质谱响应离子强度与化合物质荷比组成的数据经Xcalibur软件处理后导入Excel,通过LCQ程序完成对数据的预处理,以m/z 100~1000的881个离子(取整数)的离子强度为变量,对90(30×3)个样本进行PCA分析,3个主成分(PC1、PC2和PC3)对总方差的贡献率较大(91.2%),其分别达到了54.2%、21.6%和15.4%。分别以前2个和前3个主成分建立坐标系进行投影,即可得到所有样本在二维平面的分布,结果见图2。
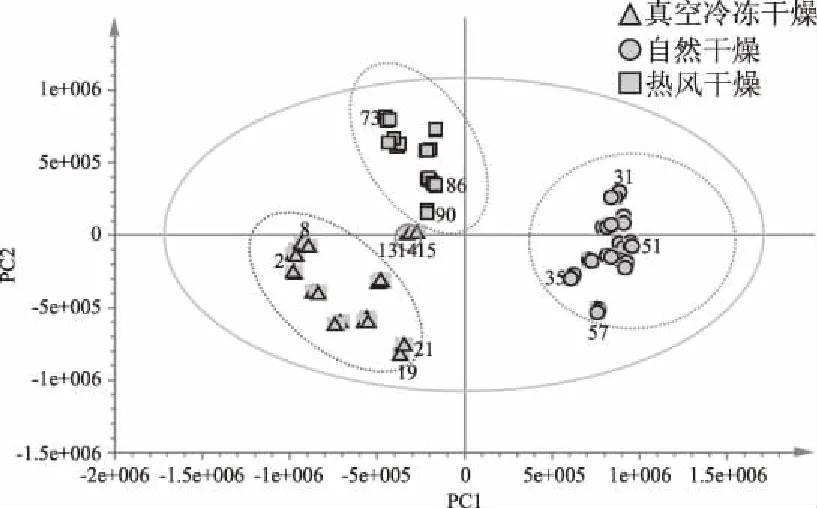
图2 不同干燥处理黄花菜的PCA得分图Fig.2 PCA scores plot for treatment of daylily
图2是负离子模式下黄花菜在二维平面上的得分投影图。由图2可知3种处理的黄花菜样品较好的分成了3类。为了便于说明,将得分图分为4个象限。1象限在PC1的负半轴,PC2的正半轴,分布于此象限的样品在PC1得分值小于0,在PC2大于0;2象限在PC1和PC2的正半轴,分布于此象限的样品在PC1和PC2得分值都大于0;3象限在PC1和PC2的负半轴,分布于此象限的样品在PC1和PC2得分值都小于0;4象限在PC1的正半轴,PC2的负半轴,分布于此象限的样品在PC1得分值大于0,在PC2小于0。由图2可以看出,不同干燥处理的黄花菜分别位于不同的象限区域,其中编号为31~60的自然干燥样品分布于得分图的右侧,位于第2和4象限之间;编号为61~90的热风干燥样品分布于得分图的上部偏左,位于第1象限;编号为1~30的真空冷冻干燥样品分布于得分图的左下方,位于第3象限,而13、14、15号样品分布异常,远离数据集。
从不同干燥处理黄花菜在PC1和PC2的得分上来看,编号为31~60的自然干燥样品在PC1上的得分值都大于0,分布于这个区域的所有样品中,51和35号样品分别得到最高和最低的PC1值,31和57号样品分别得到最高和最低的PC2值;编号为61~90的热风干燥样品在PC1上的得分值均小于0,在PC2上的得分值均大于0,86和73号样品分别得到最高和最低的PC1值,73和90号样品分别得到最高和最低的PC2值;编号为1~30的真空冷冻干燥样品在2个主成分上的得分值均小于0,21和2号样品分别得到最高和最低的PC1值,8和19号样品分别得到最高和最低的PC2值。由于不同处理样品在得分图上3个局域的PC1和PC2的得分差异,使得30个不同干燥处理黄花菜的之间存在相似性或差异性。
2.3 PLS-DA分析
在负离子模式下PCA分类信息的基础上,以m/z 100~1000的881个离子(取整数)的离子强度为变量,对90(30×3)个样本进行PLS-DA,使组内差异最小化,组间差异最大化。
通过PLS-DA分析提取得到6个主成分,其代表97% X变量和97.6% Y变量变化,该模型拥有97.3%的预测能力。图3是显示了在X变量空间内的至模型距离,反映了不同干燥处理黄花菜在Y变量的拟合效果,由图3可知,1、14、15、19、31、32、33、35和90号样品测定的结果超出了95%的置信范围,其余各个样品皆在范围内。表明该方法可对不同干燥处理黄花菜FIMS指纹图谱进行有效的分析。

图3 不同干燥处理黄花菜PLS-DA的至模型距离Fig.3 PLS-DA of distance to model X plot FIMS fingerprints for treatment of daylily
图4是负离子模式下不同干燥处理黄花菜PLS-DA在二维平面上的得分图。不同处理样品的区分效果较好,3个干燥处理90个黄花菜的数据点均位于95%置信区间内,同时不同处理的样品分别集中于图的3个不同区域。由图4可以看出,不同干燥处理的黄花菜分别位于不同的象限区域,其中编号为1~30的真空冷冻干燥样品分布于得分图的右下方,位于第4象限;编号为31~60的自然干燥样品分布于得分图的左下方,位于第3象限;编号为61~90的热风干燥样品分布于得分图的上部,位于第1和2象限之间。

图4 不同干燥处理黄花菜的PLS-DA得分图Fig.4 PLS-DA scores plot for treatment of daylily
从负离子模式下不同干燥处理黄花菜的PLS-DA结果可以看出,与PCA分析相比,不同干燥处理的样品分布位置略有不同,但数据集分布的更为集中,通过组间数据的差异最大化以及组内数据的差异最小化,不同处理后的黄花菜样品由于化学成分的差异,得到了更好地分类(组间)与聚集(组内)。通过该数据处理方法可以快速、客观地分析不同干燥处理黄花菜化学成分的差异及其组别。
2.4 化学标记物筛选及分析
通过PLS-DA可以看出,干燥处理后含有相似化学成分或化学成分含量相近的黄花菜样本被聚为一类,各组内样本点聚集较好,而含有不同化学成分或化学成分含量相差较大的样本在得分图上离得较远。为了分析在分类中起决定性作用的化学标记物,通过载荷图对数据进行了进一步分析,见图5。
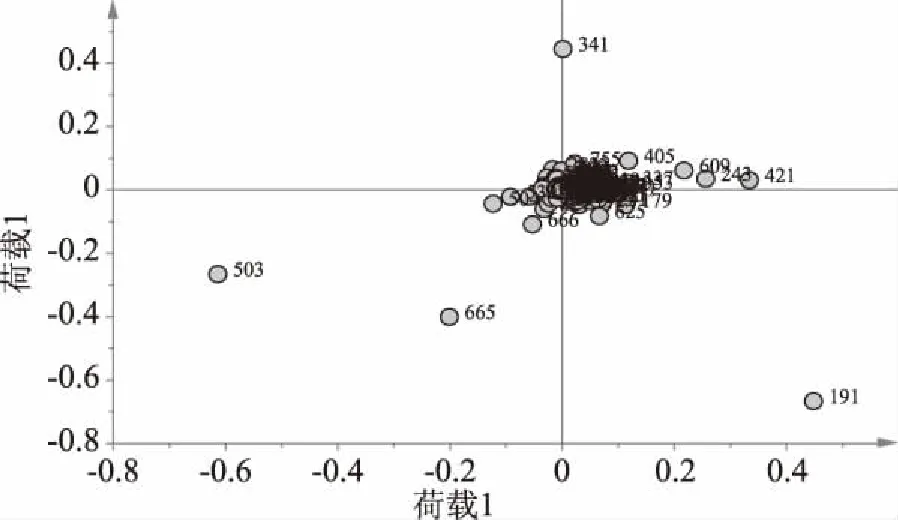
图5 不同干燥处理黄花菜的PLS-DA载荷图Fig.5 PLS-DA loading plot for treatment of daylily
图5是负离子模式下不同干燥处理黄花菜PLS-DA得到的二维载荷图,该图反映了各变量对不同干燥处理样本分布的影响。在因子载荷图上,每一个变量都体现出了其对样品在得分图上分布的贡献,离密集区越远的变量对样品分类影响越大。在本实验中,变量就是不同干燥黄花菜提取物直接进样而得到的离子,其对样品分类的贡献可以通过在因子载荷图上的位置来判断[13]。那些在因子载荷图上比较分散的离子对样品分类的贡献比较大,称之为特征离子。由图5可知,真空冷冻干燥的黄花菜样品中m/z 191、243、421和609 4个离子强度较高,故分布在PC1正方向;自然干燥的黄花菜样品中m/z 665和503离子强度较高;热风干燥的黄花菜样品中m/z 341离子强度较高,说明了正是这些成分造成了不同干燥黄花菜样品质量之间的差异。VIP图可显示模型中因素的重要性,从中筛选出VIP值>1的成分确定为贡献较大的成分。由图6可见,VIP值由大到小排序,VIP值>1的有26个特征离子,是造成不同干燥处理黄花菜差异性的贡献较大的特征离子,其中m/z 503、191、421、243、609、665 6个贡献最大,可以作为化学标记物研究不同干燥方式黄花菜的质量差别。

图6 PLS-DA VIP值图Fig.6 PLS-DA VIP plot for treatment of daylily
3 结论
本研究首次运用FIMS对不同干燥处理的黄花菜进行了分析。
采用PCA和PLS-DA这两种化学计量学方法建立了数据分析模型,PCA和PLS-DA模型均能对不同处理的黄花菜样品进行有效分类,但PCA处理后3个主成分的贡献率是91.2%,PLS-DA的分类模型预测能力达到97.3%,因此选择更优的PLS-DA模型,可以较全面的反映数据信息,而且具有较高的预测能力。因此,该方法作为一种极具特点的指纹图谱分析技术,可以用于不同加工方式对农产品质量的快速判别研究。
