超高效液相色谱-串联质谱法检测动物组织中 10种抗胆碱类药物残留方法建立
2018-09-13刘洪斌姚喜梅姜艳彬蔡英华
刘洪斌,姚喜梅,张 鹭,李 颖,姜艳彬,蔡英华,*
(1.中国动物疫病预防控制中心,北京 102609; 2.中国标准化协会,北京 100048)
抗胆碱类药物临床主要用于解痉止痛、松弛肌肉和治疗重症高血压病等[1-2],但同时也存在口干,心跳过速和尿潴留的副作用,如果过量使用会出现烦躁不安、痉挛等神经兴奋症状,进而造成昏迷、呼吸困难或者死亡[3-4]。随着畜牧养殖业的高速发展,部分抗胆碱药物也被允许用于治疗动物疾病,促进动物生长,但不合理用药造成的药物残留对消费者造成极大的安全隐患,同时该类药物存在口干和尿潴留的副作用变相促使动物多饮水,保水抗利尿以达到动物异常增重的效果[5],这为不法分子通过非法向动物体内注水,借助药物保水抗利尿功能,达到动物增重的目的提供了可能。但目前还未见通过检测动物体内具有此类功能药物异常含量来监控药滥用和指示注水可能的报道,因此建立动物组织中抗胆碱类药物确证检测方法对打击非法药物添加和注水意义重大。
目前抗胆碱类药物的研究多见于医学研究领域[6-9],主要研究内容为该类药物对人体及动物的治疗效果及药物作用机理研究;主要检测方法包括液相色谱法[10-11]、液质或气质联用法[12-15]、飞行时间质谱法[16]和电化学方法[17]等,而该类药物在动物组织中残留检测方法的报道较少[18],多残留同时检测还未见报道,因此本文建立动物组织中10种抗胆碱类药物残留液质串联检测方法,该方法操作简单,耗时少,灵敏度高,稳定性好,较好的满足动物组织中抗胆碱药物残留检测需求,对更好地防范和监管动物源性食品药物残留和非法添加具有重要意义。
1 材料与方法
1.1 材料与仪器
猪肉、猪肝 购于农贸市场,经LC-MS/MS分析确认为阴性样本;盐酸丙哌维林(cas:54556-98-8)、盐酸贝那替嗪(cas:57-37-4)、氢溴酸后马托品(cas:51-56-9)、盐酸哌仑西平(cas:29866-97-1)、盐酸双环胺(cas:67-92-5)、氢溴酸东莨菪碱(cas:6533-68-2)、托吡卡胺(cas:1508-75-4)、硫酸阿托品(cas:55-48-1)、丁溴酸东莨菪碱(cas:149-64-4)、美卡拉明(cas:60-40-2) 购于美仑生物技术公司,纯度均在97%以上;乙腈、甲醇、甲酸等有机溶剂 均为色谱纯,购自美国Fisher公司;用甲醇将上述标准品配制单标母液(已折扣盐酸盐、硫酸盐及纯度),并配制10 μg/mL混合储备液于-20 ℃保存,使用时现配成系列标准工作液;GHP膜 美国Waters公司;PTFE膜 Agilent公司;津腾尼龙膜和聚醚砜膜 天津津腾实验设备有限公司。
Waters Oasis PRiME HLB SPE柱(60 mg,3 mL)、超高效液相色谱仪(Acquity UPLC I-CLASS)配三重四极杆质谱仪(TQ-XS) 美国Waters公司;3K15型离心机 美国Sigma公司;均质机 德国IKA公司;N-EVAP氮吹仪 美国Organomation公司:纯水仪 美国Millipore公司。
1.2 实验方法
1.2.1 前处理过程
1.2.1.1 提取 准确称取匀浆好的2 g(精确到0.01 g)动物组织样品(猪肉、猪肝)于50 mL离心管中,加入10 mL 1.0%甲酸乙腈,9500 r/min离心5 min取上清液于另一50 mL离心管中,再用10 mL 1.0%甲酸乙腈重复提取一次,合并两次提取液,待过净化柱。
1.2.1.2 净化 将提取液全部加入事先用3 mL 1.0%甲酸乙腈活化的Oasis PRiME HLB柱中,流速1 d/s左右,收集全部滤过液,50 ℃氮气吹至近干,1 mL初始流动相定容,12000 r/min离心5 min,0.22 μm尼龙滤膜过滤待上机测定。
1.2.2 液相色谱条件 色谱柱:Acquity UPLC BEH C18(50 mm×2.1 mm,1.7 μm);流速:0.3 mL/min;流动相A:0.1%甲酸水溶液,B:甲醇,0~0.5 min,95% A保持不变,0.5~2.0 min,95% A线性变化至75%;2.0~3.5 min,75% A保持不变,3.5~3.6 min,75% A线性变化至60%,3.6~4.0 min,60% A保持不变,4.0~6.0 min,60% A线性变化至0%,6.0~8.0 min,0% A保持不变,8.0~8.5 min,0% A线性变化至95%;8.5~10.5 min,95% A保持不变;进样量10 μL。
1.2.3 质谱条件 电离模式:ESI+;毛细管电压:3.0 kV;萃取锥孔电压:3 V;RF透镜电压:0.5 V;源温:150 ℃;脱溶剂温度:250 ℃;锥孔气流速:150 L/h;脱溶剂气流速:600 L/h;碰撞气流速:0.15 mL/min;采集模式:MRM;各种药物优化母离子和子离子及对应聚焦电压和碰撞电压值见表1。
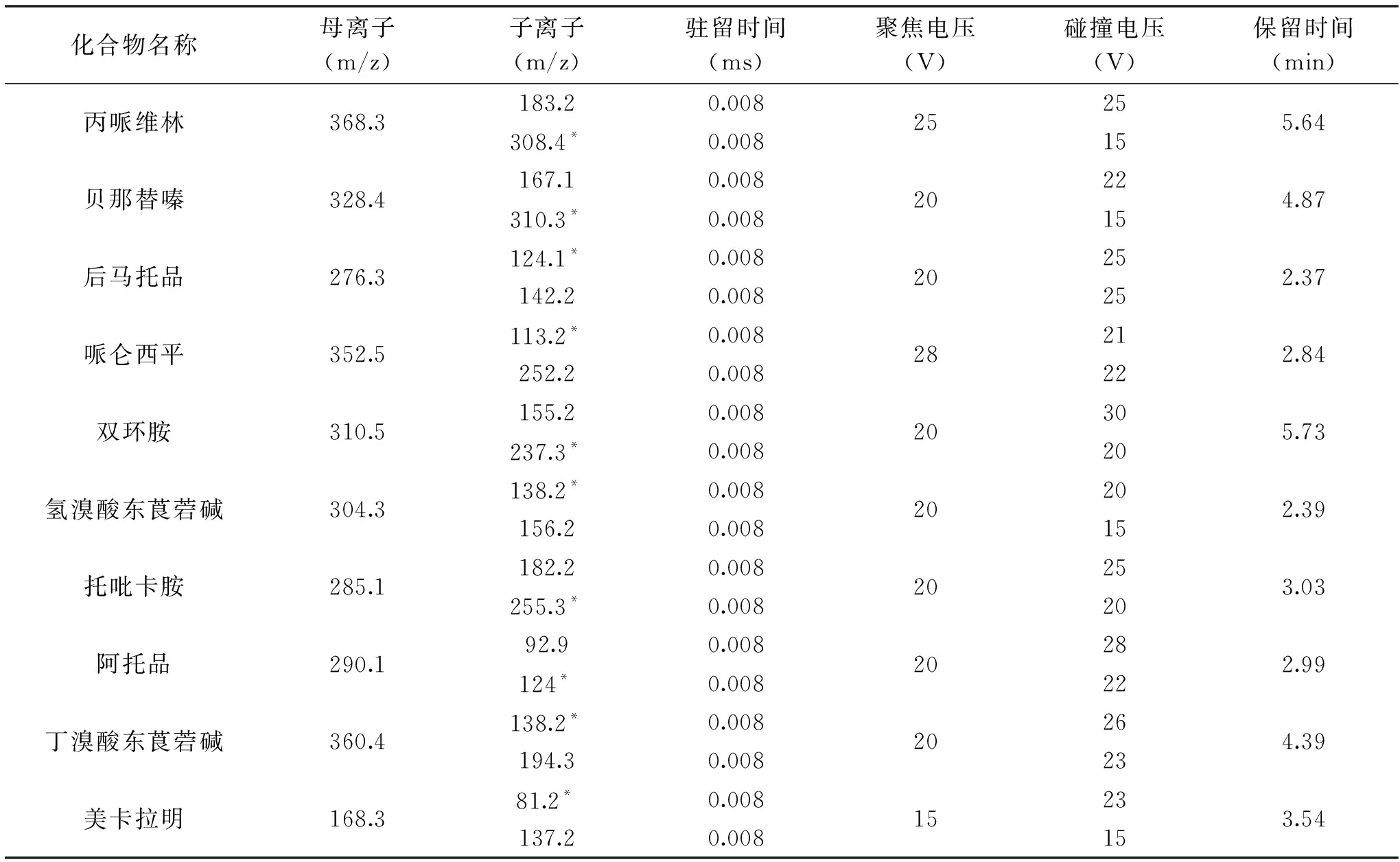
表1 抗胆碱类药物检测离子、对应质谱参数及保留时间Table 1 Qualitative ions,quantitative ions and relevant parameters of anticholinergic drugs
1.2.4 不同过滤膜选择实验 过滤步骤在前处理过程中起着减少杂质,降低基质效应的重要作用,因此滤膜种类与药物的吸附程度对检测方法的准确性影响甚大,本文考察了4种不同厂家、型号滤膜对20 μg/L混合标准溶液的吸附影响,试验选取Waters GHP膜、Agilent PTFE膜以及津腾尼龙膜、聚醚砜膜等4种适用于绝大多数有机溶剂和水溶液的滤膜,实验结果采用吸附率衡量滤膜的适用性。吸附率(%)=(C未过膜-C过膜)/C未过膜×100,其中C表示上机浓度。
1.2.5 提取溶剂优化实验 已知抗胆碱类药物检测方法多为医学领域,基质多为血浆[12-15]、尿液[16]、药品制剂[11,19]等,动物组织中前处理方法少见报道[18],鉴于动物组织的复杂性,本文通过空白猪肝样品添加10 μg/kg 10种抗胆碱类药物混标溶液,分别选取甲醇、乙腈、80%乙腈水(V乙腈∶V水=8∶2)、0.1%甲酸乙腈、0.2%甲酸乙腈、0.5%甲酸乙腈、1.0%甲酸乙腈等7类提取溶剂处理样品,通过提取回收率确定最佳提取溶剂。回收率(%)=C提取后/C添加浓度×100,其中C表示浓度。
1.2.6 基质效应实验 动物组织成分较为复杂,脂类、可溶性蛋白或肽类及其代谢产物等各种有机物[20-21]经前处理过程后,仍有部分会保留在待测样品溶液中,以共流出物形式和待测药物同时进入电离源时,对待测药物离子化过程产生严重干扰,从而产生抑制或增强的效果。实验采用提取后添加法[22]来判断基质效应的影响,实验按照1.2.1方法处理组织样本(猪肉、猪肝),然后添加10 μg/kg混合标准溶液制成基质加标溶液,与溶剂加标溶液进行比较,基质效应(ME)=标液在空白动物组织中峰面积/标液在纯溶剂中峰面积,若比值小于1.0,说明基质对待测物的响应产生抑制作用;若大于1.0,说明基质的存在增强效果;若等于1.0,说明待测物的响应未受影响。
1.2.7 线性方程及灵敏度 实验实验采用空白组织样品经1.2.1方法处理,在1.0~50.0 μg/L浓度范围内分别添加10种抗胆碱类药物混标溶液,配制1.0、2.0、5.0、10.0、20.0、50.0 μg/L基质加标溶液,经UPLC-MS/MS检测,以定量离子色谱峰面积为纵坐标,待测药物浓度为横坐标做标准曲线,将处理好的空白组织样品逐级稀释标准溶液,按3倍信噪比确定方法检出限(LOD),10倍信噪比确定方法的定量限(LOQ)。
1.2.8 回收率实验 取空白猪肉、猪肝样品,添加浓度为1.0、2.0、10 μg/kg 3个水平混标溶液,批内6次平行,不同时间重复测定3个批次,按1.2.1方法进行添加回收实验;同时通过空白样品与添加样品总离子图比较该方法的专属性。
1.2.9 实际样品检测 本实验对从超市及农贸市场共抽检猪肉、猪肝样品30份进行测定,并随样进行盲样添加试验,对方法的准确性和适用性再次进行验证。
1.3 数据处理
MassLynxTM4.2数据采集分析软件。
2 结果与分析
2.1 仪器条件优化
由于抗胆碱类药物具有哌啶环,含氮杂环或具有氨基结构,因此采用正离子模式采集数据,将浓度为0.5 mg/L的抗胆碱类药物以单标样流动泵直接进样方式采集[M+H]+准分子离子峰,在一定碰撞电压下,对其[M+H]+进行二级质谱扫描,得到定性和定量碎片离子信息,并对碰撞气能量、电喷雾电压、雾化气、源温等质谱参数进行优化,具体参数见表1。
针对多种类药物残留检测,梯度洗脱能较好的实现各种药物的有效分离,本实验采用从高水相到高有机相比例渐进的洗脱方式,既能保证不同极性差异的药物在不同保留时间的良好分离,又能充分洗脱掉组织基质中不同极性杂质,配合仪器溶剂延迟功能,极大的降低了待测样品对色谱柱和进样锥孔的污染。
2.2 不同过滤膜对药物吸附率的影响
由图1可知,显示4种滤膜对美卡拉明、氢溴酸东莨菪碱、双环胺、贝那替嗪、哌仑西平、丁溴酸东莨菪碱等六种物质存在不同程度吸附作用(见图1),吸附率在0.7%~68.7%之间;其中Waters GHP膜、Agilent PTFE膜对双环胺吸附明显,吸附率分别为36.3%和68.7%,综合各药物吸附率及性价比考虑,实验选取尼龙膜作为过滤膜,但考虑到尼龙膜对部分药物也存在吸附作用,因此,为减少滤膜吸附对实验结果造成的影响,标准溶液也需经滤膜过滤后上机。
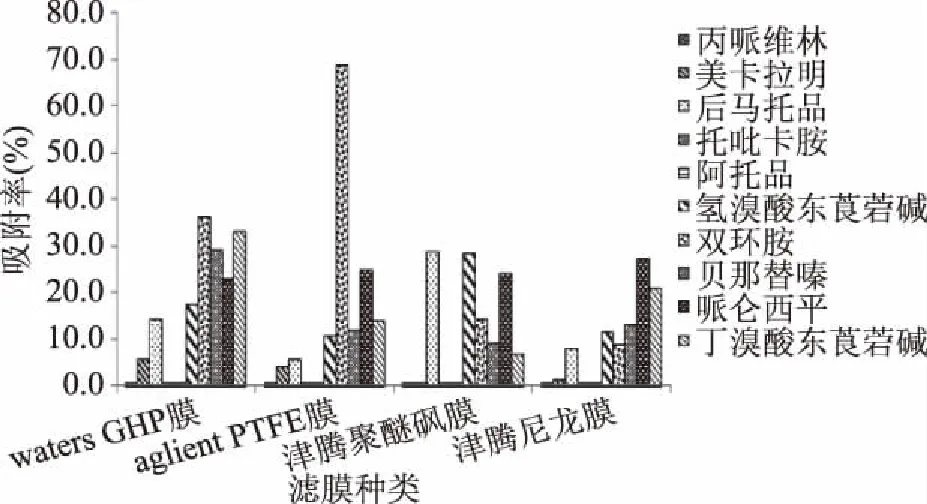
图1 不同滤膜过滤条件下吸附率对比图Fig.1 Adsorption rate were obtained by different filtration conditions
2.3 提取溶剂选择
由图2可知,当甲醇为提取剂时,蛋白变性沉淀不完全,样品整体较为浑浊,杂质干扰较大;10种药物在甲醇、80%乙腈水中回收率低于乙腈和酸性乙腈提取剂,除双环胺、丙哌维林外,其他药物在乙腈及酸性乙腈中回收率差异不明显,而双环胺、丙哌维林和乙腈中甲酸含量成正比,当甲酸含量达到1.0%时,两种药物的回收率能达到60%以上,原因主要为酸性条件有助于该类药物在提取溶剂的溶解,因此实验最终提取溶剂选择为1.0%甲酸乙腈。
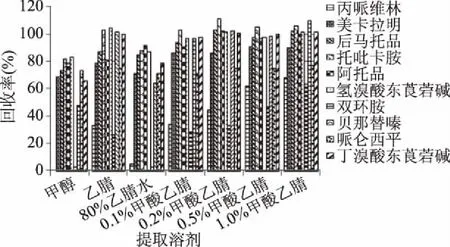
图2 不同提取条件下回收率Fig.2 Recoveries were obtained by different extraction methods
2.4 基质效应
由图3可知,除猪肉中哌仑西平、猪肝中丁溴酸东莨菪碱抑制效果不明显外,其它种类药物在两种基质中均存在不同程度抑制效果,ME在0.37~0.98之间,其中猪肝基质比猪肉样本抑制作用更为严重,因此为减少基质效应带来的影响,应在实际检测中采用空白基质加标溶液。不同药物基质抑制程度见图3。
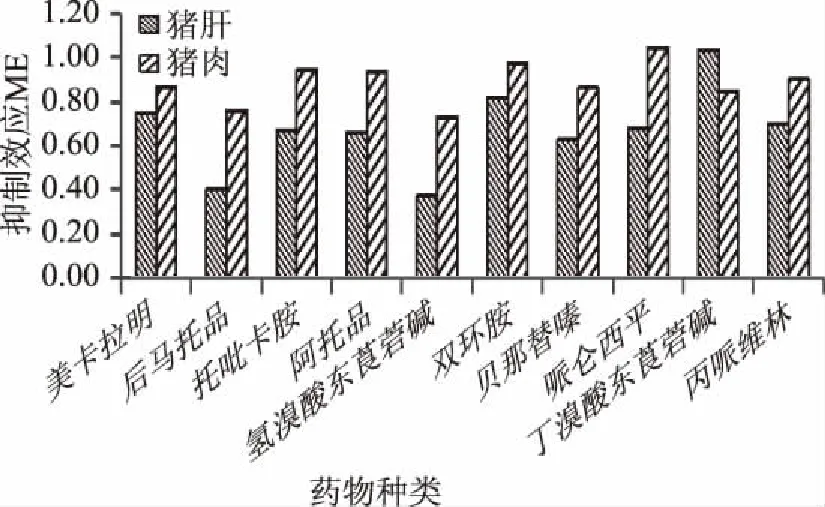
图3 基质效应图Fig.3 Figure of matrix effect in animal matrix
2.5 线性方程及灵敏度实验
实验结果表明在猪肉、猪肝组织中,10种抗胆碱类药物均在1.0~50.0μg/L范围内线性良好,线性系数均大于0.9951,10种抗胆碱类药物的方法定量限均低于1.0 μg/kg。因猪肝基质干扰较大,标准曲线及灵敏度略低于猪肉中。因此,以猪肝组织为例,10种抗胆碱类药物线性方程、相关系数、检出限和定量限等参数见表2。
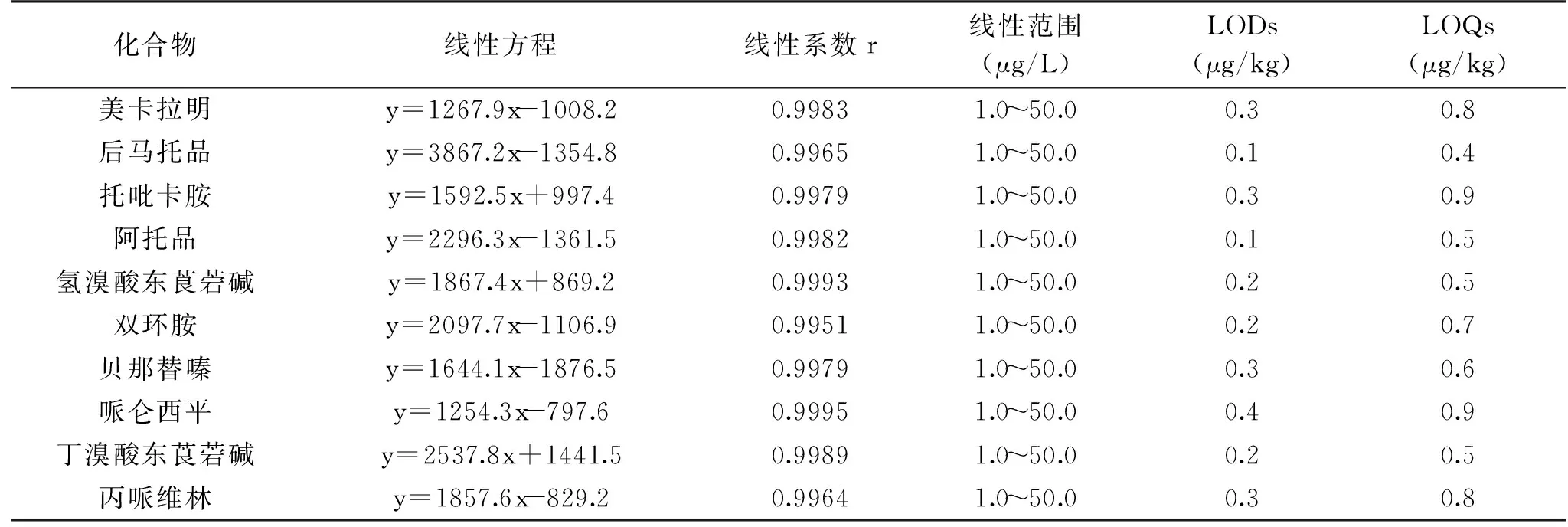
表2 猪肝中10种抗胆碱类药物线性方程、相关系数、检出限和定量限Table 2 Linear equations,correlation coefficients,detection limits,and quantification limits of ten anticholinergic drugs in liver
2.6 回收率实验
由表3可知,猪肉中平均回收率在64.7%~108.2%,批内变异系数为1.09%~10.5%,批间变异系数为2.31%~11.4%,猪肝中平均回收率在62.6%~108.0%,批内变异系数为0.38%~10.7%,批间变异系数为2.24%~11.2%,方法的准确度及精密度满足 GB/T 27404-2008[23]技术要求,结果见表3。

表3 动物组织中10种抗胆碱类药物添加回收率、RSD值(n=6)。Table 3 Spiked recoveries,RSDsof ten anticholinergic drugs in animal matrix(n=6)
同时由图4、图5可以看出空白基质中待测药物应出峰位置处并不存在干扰峰,进一步说明该方法专属性较强。空白样品与添加样品总离子图(以猪肝样本为例)见图4、图5。
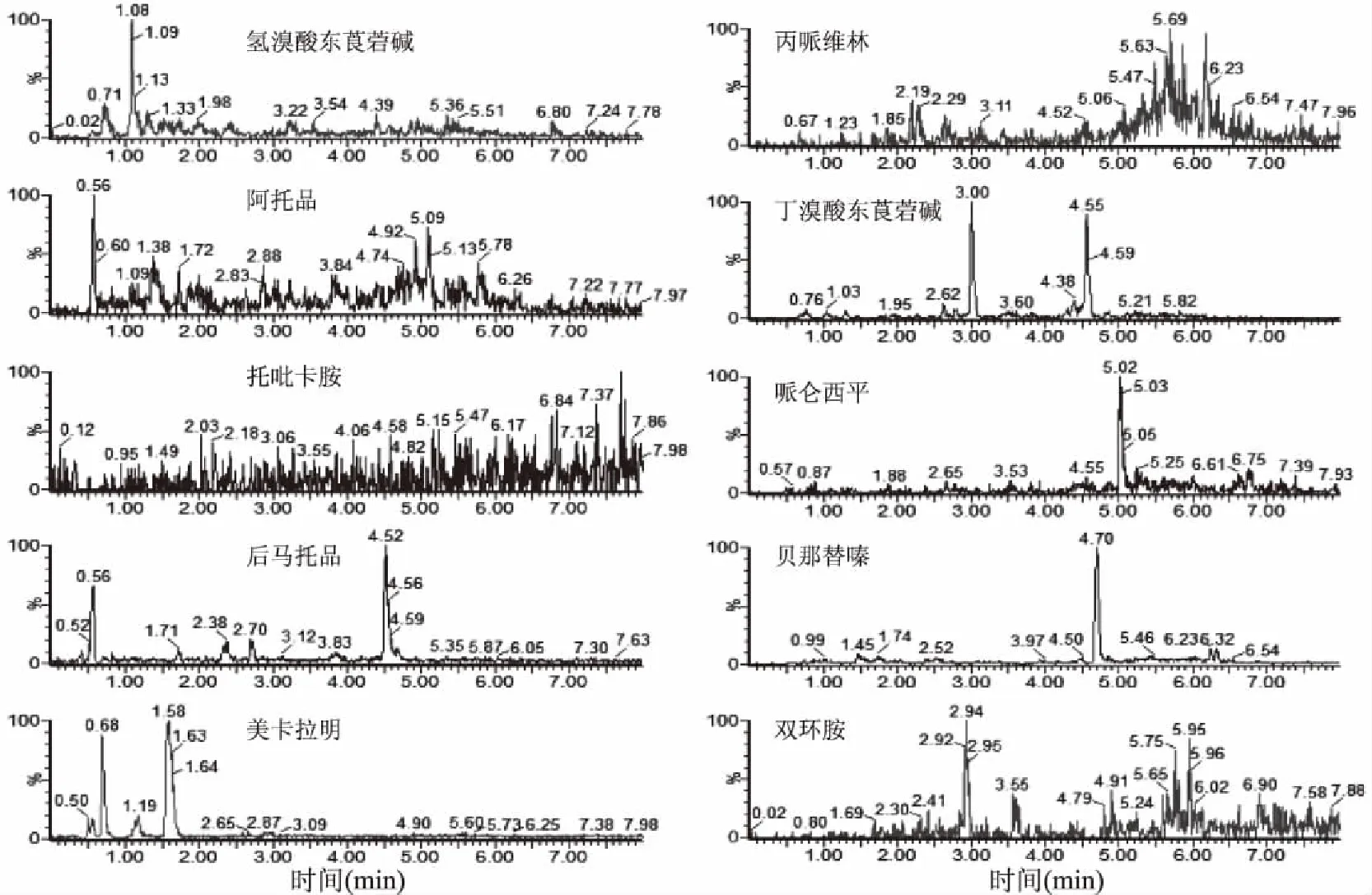
图4 空白猪肝样品选择离子图Fig.4 MRM chromatograms of the blankliver
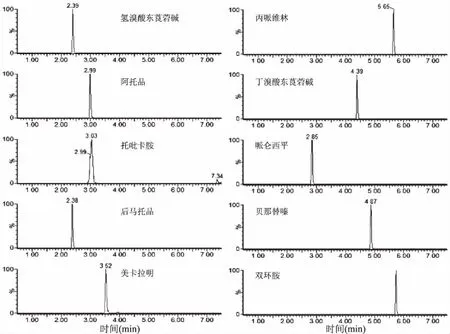
图5 空白猪肝基质中添加10 μg/kg10种抗胆碱类药物选择离子图Fig.5 Chromatograms obtained from blank liver spiked with10 μg/kg of ten anticholinergic drugs
2.7 实际样品检测
本实验对从超市及农贸市场共抽检猪肉、猪肝样品30份进行测定,并随样进行盲样添加试验,最终从抽检的50份样本中未检出上述10种抗胆碱类药物,而随测盲样检出阿托品及贝那替秦分别为4.32 μg/kg和3.87 μg/kg(添加量均为5.0 μg/kg),回收率分别为86.4%和77.4%,进一步证实该方法适用于动物组织中10种抗胆碱类药物检测。
3 结论
本实验建立了一种针对动物组织中多种抗胆碱类药物残留检测方法,通过优化液相、质谱参数,优化前处理方法,最终建立了动物组织中10种抗胆碱类药物UPLC-MS/MS检测方法,并通过方法学验证。该方法操作简单快捷,灵敏度较高,稳定性较好的特点,能够较好满足动物组织中该类药物残留检测要求,鉴于目前还未见相关药物在动物产品中多残留检测报道,该方法的建立能有效防范药物滥用和非法添加行为,并对打击注水肉提供一定的技术支撑。
