非脱羧勒克菌wt16对 黄曲霉菌生长与产毒的抑制作用
2018-09-13谢华里马向东李培武
王 同,谢华里,王 婷,马向东,李培武,3,*,张 奇
(1.湖北大学生命科学学院/生物资源绿色转化湖北省协同创新中心,湖北武汉 430062; 2.中国农业科学院油料作物研究所,农业部油料作物生物学 与遗传育种重点实验室,农业部生物毒素检测重点实验室,湖北武汉 430062; 3.农业部油料产品质量安全风险评估实验室,农业部油料 及制品质量监督检验测试中心,湖北武汉 430062)
黄曲霉菌(Aspergillusflavus),是腐生性的病原真菌。主要存在于玉米、棉花、花生以及许多干果和香料中。分离出来的大多黄曲霉菌都能产生次级代谢产物黄曲霉毒B1(AFB1),它具有致癌性、致畸性、免疫抑制性,被认定为自然界中危害性最大的生物毒素之一[1-4]。黄曲霉毒素污染是极其棘手的食品安全问题,黄曲霉毒素除对人畜的健康造成极大的危害外,也会对社会经济造成巨大的损失[5-8]。因此如何有效地防治黄曲霉的污染具有十分重要的理论和现实意义。
黄曲霉及其毒素污染防控一直是国际国内农产品质量安全研究领域的热点和难点,黄曲霉毒素的防治方法主要有物理、化学、生物三种方法,但物理法费时费力、去毒力不高,化学农药对环境有较大危害,而利用生物防治法来抑制黄曲霉毒素产生的技术处理条件比较温和,对产品质量影响较小,有利于环境保护及人体健康[9]。因此,绿色防控技术已经成为当前发展趋势。黄曲霉及其毒素污染的生物防控是重要发展方向。
目前,黄曲霉毒素生物防治技术主要包括利用不产毒霉菌[10-11]、拮抗微生物[12]及其活性物质[13]、植物源活性物质[14]来抑制黄曲霉的产毒及生长。研究乳酸菌对乳制品中黄曲霉毒素污染的生防作用,发现乳酸菌可以抑制黄曲霉生长及黄曲霉毒素B1的产生[15],乳酸菌属的许多菌株,包括丙酸杆菌属Propionibacterium[16]、乳球菌Lactococcus[17]、双歧杆菌Bifi-dobacterium[18]和乳酸杆菌属Lactobacillus[19]等,均具有抑制黄曲霉生长及产毒的作用,但乳酸菌属厌氧菌,在实际应用过程中难以保证厌氧的环境,从而限制了乳酸菌作为拮抗菌的实际应用[20]。孔青等[21]发现一株海洋巨大芽孢杆菌可以抑制黄曲霉毒素的产生,其在培养基中抑制率约为87%,并且此株巨大芽孢杆菌只可在受机械损伤的花生上抑制黄曲霉毒素的生物合成。
随着人们对绿色环保理念的兴起,生物防治黄曲霉菌侵染及其毒素产生成为一种主流研究方向。非脱羧勒克菌(Leclerciaadecarboxylata)wt16,是非脱羧勒克菌属惟一的1个菌种,是肠杆菌科的一种具有动力的革兰阴性杆菌,通常来源于环境和动物[22],于1962年被发现,生化特性与大肠埃希菌相似,其对黄曲霉的生防作用此前并未见报道,本研究首次将该非脱羧勒克菌wt16菌株进行对黄曲霉菌生长及产毒的研究,并找出其有效作用成分,因此本文为日后研究分离鉴定非脱羧勒克菌wt16分泌的有效抑制黄曲霉毒素产生的代谢产物提供了理论基础。
1 材料与方法
1.1 材料与仪器
非脱羧勒克菌wt16 分离自湖北黄陂,保存于中国农业科学院油料作物研究所;7个高产毒黄曲霉菌株73、271、393-2、54、pc157-2、pg11、pc400 为本实验室前期分别从广西北海、福建郡武、湖北黄陂、福建泉州、南昌进贤、江西樟树、湖北红安分离获得;大肠杆菌(E.coli) 为本实验室分离保存;PDA培养基 美国BD公司;LB固体培养基、沙氏液体培养基 青岛高科技工业园海博生物科技有限公司;乙醇、吐温80、丙三醇、磷酸盐缓冲液(PBS) 国药集团化学试剂有限公司;甲醇 安徽时联特种溶剂股份有限公司。
恒温培养振荡器 天津市欧诺仪器仪表有限公司;LEICA DMLS型光学显微镜 德国LEICA公司;SU8010型高分辨场发射扫描电镜 日本HITACHI公司;AUTESTER-E30型高压灭菌锅 西班牙J.PSELECTA公司;WFO-400型干燥箱 上海爱朗仪器有限公司;CPA224S型电子天平 德国Sartorius公司。
1.2 实验方法
1.2.1 非脱羧勒克菌wt16种子液的制备 LB固体平板上活化非脱羧勒克菌wt16菌株,37 ℃培养箱放置24 h,挑取单菌落于液体LB试管中,置于摇床中发酵,200 r/min,37 ℃,培养12 h。在实验过程中通过菌悬液浓度与吸光度值的回归方程进行计算[23-24],将后续实验所需菌悬液浓度配制成107CFU/mL。
1.2.2 黄曲霉菌孢子悬浮液的制备 7种黄曲霉菌株(73、271、393-2、54、pc157-2、pg11、pc400)分别在PDA培养基上28 ℃培养7 d后,用无菌水(含0.1%的吐温80)将孢子从培养基上洗下,用血球板计数法计数[25]。
1.2.3 非脱羧勒克菌wt16对不同地区黄曲霉菌生长的影响 将非脱羧勒克菌wt16菌液(1×107CFU/mL)和7种不同地区的黄曲霉菌孢子悬液(5×105个/mL)同时接种于15 mL沙氏液体培养基中,以无菌培养液为空白、以大肠杆菌培养液(1×107CFU/mL)为对照替代非脱羧勒克菌wt16菌液,28 ℃培养5 d,分别测定菌丝干重。
1.2.4 菌丝干重的测定 以Whatman No. 4滤纸过滤培养液,得到的菌丝于80 ℃烘干至恒重后,称重[26]。根据抑制率(%)=(对照组菌丝干重-处理组延菌丝干重)/对照组菌丝干重×100%,计算对黄曲霉菌丝生长的抑制率。
1.2.5 非脱羧勒克菌wt16对不同地区黄曲霉菌产毒的影响 将非脱羧勒克菌wt16菌液(1×107CFU/mL)和7种不同地区黄曲霉孢子悬液(5×105个/mL)同时接种于15 mL沙氏液体培养基中,对照组分别以无菌培养液、大肠杆菌培养液(1×107CFU/mL)替代非脱羧勒克菌wt16菌液,28 ℃培养5 d,取1 mL培养液测定其黄曲霉毒素B1(AFB1)含量[27-28]。抑制率(%)=(对照组毒素含量-处理组毒素含量)/对照组毒素含量×100。
1.2.6 黄曲霉毒素的定量检测 将不同地区黄曲霉菌株在沙氏液体培养基中于28 ℃培养7 d,产生孢子后用无菌吐温水冲洗孢子制成孢子菌悬液,以终浓度为5×105个/mL 在沙氏液体培养基中于28 ℃培养5 d,双层Whatman No. 4滤纸过滤后用免疫亲和柱-HPLC法检测培养液中的黄曲霉毒素B1的含量。
取1 mL待测液过免疫亲和柱,将黄曲霉毒素截留,用1 mL的甲醇洗脱,进行高效液相分析,HPLC检测条件为:色谱柱:Boston Boschrom ODS,4.6×150 Vmm,5 Vμm;流动相:甲醇45%,水55%;光衍生流速:1 mL/min进样量:10 μL;荧光检测器激发波长:360 nm;发射波长:440 nm。
1.2.7 非脱羧勒克菌wt16在花生粉上对黄曲霉73菌生长与产毒的影响 将采集于湖北花生地,大小、成熟度均匀一致,无腐烂的花生颗粒研磨成花生粉,称取1 g该花生粉于培养皿中,同时加入1 mL产毒力较居中的黄曲霉菌73孢子液(5×105个/mL)及1 mL非脱羧勒克菌wt16菌液(1×107CFU/mL),以沙氏培养基代替非脱羧勒克菌wt16菌液为对照,在28 ℃培养箱中培养9 d后加入15 mL 70%甲醇水,涡旋后放入摇床30 min。取3 mL上清加入8 mL超纯水涡旋离心,取8 mL上清用免疫亲和柱-HPLC法测定黄曲霉毒素B1的含量。抑制率(%)=(对照组毒素含量-处理组毒素含量)/对照组毒素含量×100。
1.2.8 非脱羧勒克菌wt16在花生颗粒上对黄曲霉菌73生长与产毒的影响 取采集于湖北花生地,大小、成熟度均匀一致,无腐烂无机械损伤的花生颗粒花生10粒,将非脱羧勒克菌wt16菌液(1×107CFU/mL)包覆在花生表面,同时加入1 mL黄曲霉菌73孢子液(5×105个/mL),以沙氏培养基代替wt16菌液为对照;将已接种后的花生粒在28 ℃培养箱中培养9 d后,观察其生长情况,然后将花生粒研磨成花生粉,加入15 mL 70%甲醇水,涡旋后放入摇床30 min。取3 mL上清加入8 mL超纯水涡旋离心,取8 mL上清用免疫亲和柱-HPLC法测定黄曲霉毒素B1的含量。抑制率(%)=(对照组毒素含量-处理组毒素含量)/对照组毒素含量×100。
1.2.9 非脱羧勒克菌wt16菌株对黄曲霉菌73株形态影响扫描电镜分析 将非脱羧勒克菌wt16菌液(1×107CFU/mL)和黄曲霉菌73孢子悬液(5×105个/mL)同时接种于15 mL沙氏液体培养基中,对照组分别以无菌培养液为对照,在28 ℃,200 r/min培养5 d,将培养好的黄曲霉菌丝经3000 r/min离心8 min富集沉淀,取沉淀浸入磷酸盐缓冲液PBS(0.1 mol/L、pH7.2、不含NaCl)中,漂洗细胞或组织数次,3000 r/min离心8 min去上清,加4 ℃预冷的戊二醛,在4 ℃固定4 h,吸出固定剂,用PBS浸洗3次。用系列梯度乙醇(30%、50%、70%、80%、90%、95%、100%)分别脱水1次,再用100%乙醇彻底脱水2次,接下来加醋酸异戊酯2次后使其自然干燥。用真空喷镀法喷镀均匀,完成后在扫描电镜下分别放大100倍、2000倍、5000倍、20000倍进行观察。
1.2.10 非脱羧勒克菌wt16菌株不同发酵组分对黄曲霉73的影响 为了探究非脱羧勒克菌wt16不同组分对黄曲霉菌73的影响,将wt16菌株进行了3组处理,处理如下:处理Ⅰ:将非脱羧勒克菌wt16菌液以12000 r/min离心20 min后取其上清液用0.22 μm无菌滤膜过滤制备无菌发酵上清液,在上清液中加入黄曲霉73孢子液培养5 d;处理Ⅱ:将非脱羧勒克菌wt16菌株发酵上清液以121 ℃高温处理30 min后加入黄曲霉73孢子液培养5 d;处理Ⅲ:非脱羧勒克菌wt16菌株发酵液121 ℃高温处理30 min灭活后的死菌体将用无菌水洗涤3遍后用沙氏液体培养基溶解,加入黄曲霉73孢子液后培养5 d;并进行两组对照:对照Ⅰ:以无菌培养基为对照,在沙氏液体培养基中加入黄曲霉73孢子液培养5 d;对照Ⅱ以大肠杆菌作为对照菌株将其(107CFU/mL)加入沙氏液体培养基中,培养5 d后,加入黄曲霉73孢子液培养5 d。将以上处理测其菌丝干重及其黄曲霉73毒素含量。
1.2.11 发酵时间对非脱羧勒克菌wt16菌株有效成分的影响 将非脱羧勒克菌wt16菌株(107CFU/mL)加入到沙氏液体培养基中,在200 r/min,28 ℃摇床中分别培养1、2、3、4、5、6、7、8、9 d,以12000 r/min离心20 min,121 ℃高温30 min制备无菌上清液,在其中加入黄曲霉73孢子液(5×105个/mL),在200 r/min,28 ℃摇床中培养5 d后测其黄曲霉毒素含量。
1.2.12 发酵温度对非脱羧勒克菌wt16菌株有效成分的影响 分别在10、15、20、25、30、35、40、45 ℃条件下,200 r/min摇床培养非脱羧勒克菌wt16菌液5 d,以12000 r/min离心20 min,121 ℃高温处理30 min制备上清液,加入黄曲霉73孢子液(5×105个/mL),在200 r/min,28 ℃摇床中培养5 d后测其黄曲霉73毒素含量。
1.3 数据处理
所有实验内设3个重复,数据采用Excel分析处理。
2 结果与讨论
2.1 非脱羧勒克菌wt16对不同地区黄曲霉菌生长的影响
由图1可知,在沙氏液体培养基中,与对照组相比,非脱羧勒克菌wt16菌株能使不同地区黄曲霉菌丝干重明显降低,其抑制率最低为77%,最高为92%,而与对照菌株大肠杆菌共培养的不同地区黄曲霉菌菌丝干重并未明显降低,表明wt16能有效抑制不同地区黄曲霉菌的生长。
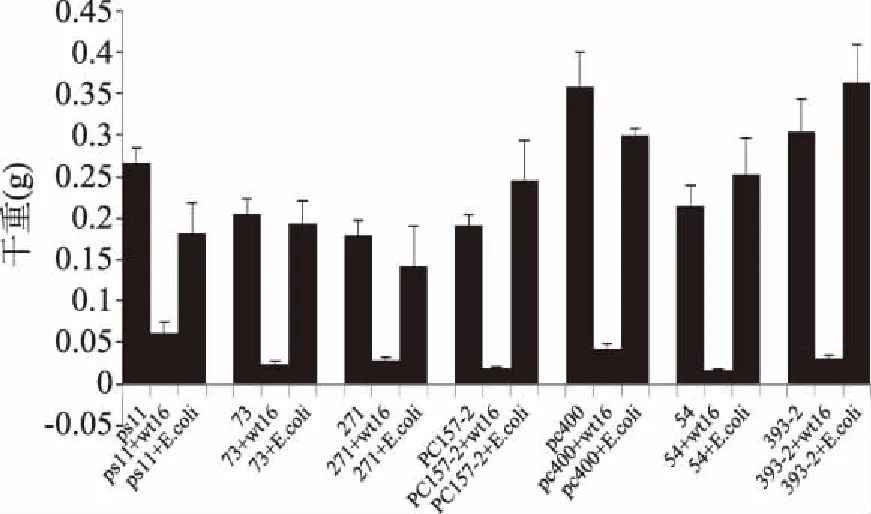
图1 wt16对不同地区黄曲霉菌生长的影响Fig.1 Effect of wt16 on the growth of Aspergillus flavus from different regions
2.2 非脱羧勒克菌wt16对不同地区黄曲霉菌产毒的影响
由图2可知,在沙氏液体培养基中,与对照组相比,非脱羧勒克菌wt16菌株能使不同地区黄曲霉菌合成的毒素明显降低,其抑毒率最低为90%,最高为96%,而与大肠杆菌共培养的不同地区黄曲霉菌产毒并未明显降低,表明wt16能有效抑制不同地区黄曲霉菌的产毒。

图2 wt16对不同地区黄曲霉菌产毒的影响Fig.2 Effect of wt16 on toxin production of Aspergillus flavus from different regions
2.3 非脱羧勒克菌wt16在花生粉上对不同地区黄曲霉73菌生长与产毒的影响
为了探究非脱羧勒克菌wt16菌株是否也能应用于营养条件复杂的花生中,本实验在花生粉上同时接种黄曲霉73菌及非脱羧勒克菌wt16。由图3可知,在花生粉上,经由黄曲霉73菌侵染的花生粉上长满了黄绿色黄黄曲霉孢子,而非脱羧勒克菌wt16与黄曲霉73菌共培养的花生粉上黄曲霉孢子明显减少,说明wt16菌株能明显抑制黄曲霉生长;由图4可知,与对照相比,经黄曲霉菌侵染的花生粉经非脱羧勒克菌wt16处理后,处理组中黄曲霉73毒素B1含量明显低于对照组,其抑制率达83.19%。
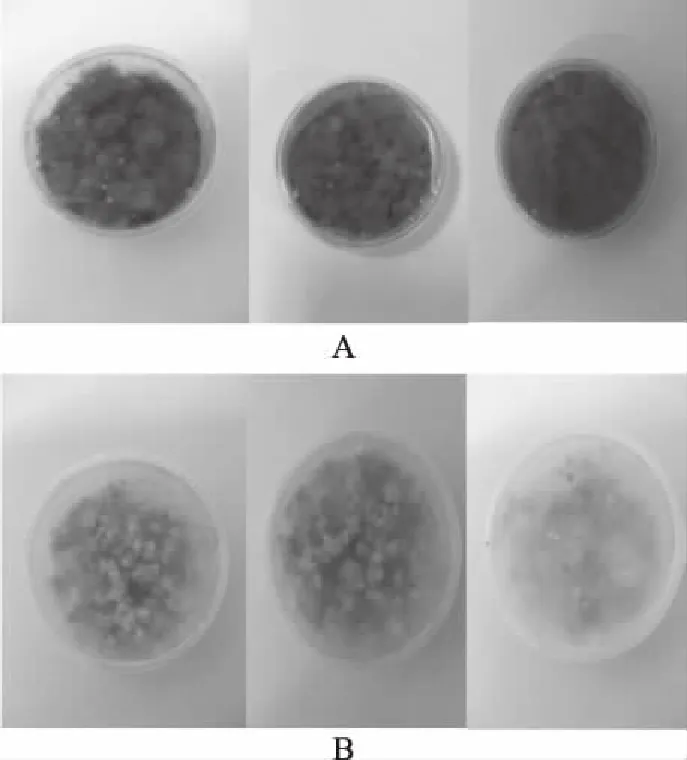
图3 wt16在花生粉上对黄曲霉生长的影响Fig.3 Effect of wt16 on the growth of Aspergillus flavus 73 in the peanut powers注:(A)为经由黄曲霉菌73侵染的花生粉;(B)为黄曲霉菌73与wt16共培养的花生粉。
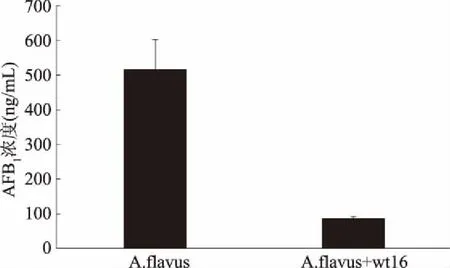
图4 wt16在花生粉上对黄曲霉菌73产毒的影响Fig.4 Effect of wt16 on toxin production of Aspergillus flavus 73 in the peanut powers
2.4 非脱羧勒克菌wt16在花生颗粒上对黄曲霉73菌生长与产毒的影响
为了探究研究非脱羧勒克菌wt16菌株在无机械损伤的花生粒上是否也有抑制黄曲霉73生长及产毒的作用,本实验在花生粒上同时接种黄曲霉及非脱羧勒克菌wt16。由图5可知,在花生上,经由黄曲霉73菌侵染的花生粒表面长出许多黄绿色的孢子,而黄曲霉73与非脱羧勒克菌wt16共培养的花生粒上黄曲霉孢子明显减少,说明wt16菌株能显著抑制黄曲霉生长;由图6可知,与对照相比,经黄曲霉73菌侵染的花生粒经wt16处理后,处理组中黄曲霉73毒素B1含量明显比对照组低,其抑制率达88.64%。

图5 wt16在花生粒上对黄曲霉菌73生长的影响Fig.5 Effect of wt16 on growth of Aspergillus flavus 73 in the peanuts注:图A为黄曲霉菌T3与wt16共培养的花生粒; 图B为经由黄曲霉菌73侵染的花生粒。
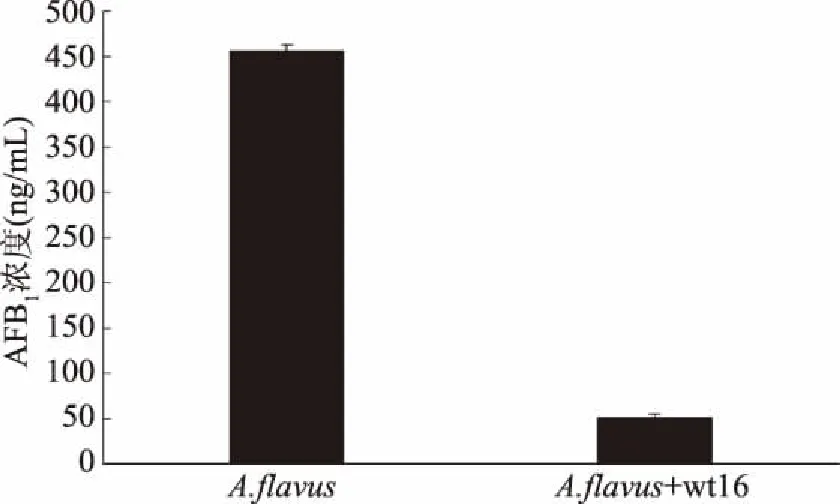
图6 wt16在花生颗粒上对黄曲霉73菌产毒的影响Fig.6 Effect of wt16 on toxin production of Aspergillus flavus 73 in the peanuts
2.5 非脱羧勒克菌wt16菌株对黄曲霉73菌株形态影响扫描电镜分析
黄曲霉菌73在沙氏液体培养基中培养5 d后可观察到,黄曲霉73可形成规则的菌丝球体,单个菌丝呈细长型,表面有绒毛(图7A),而与非脱羧勒克菌wt16作用后,黄曲霉73菌丝会聚集成不规则形状,单个菌丝会由细长型断裂成小截形态,菌丝表面会变得较光滑(图7B)。
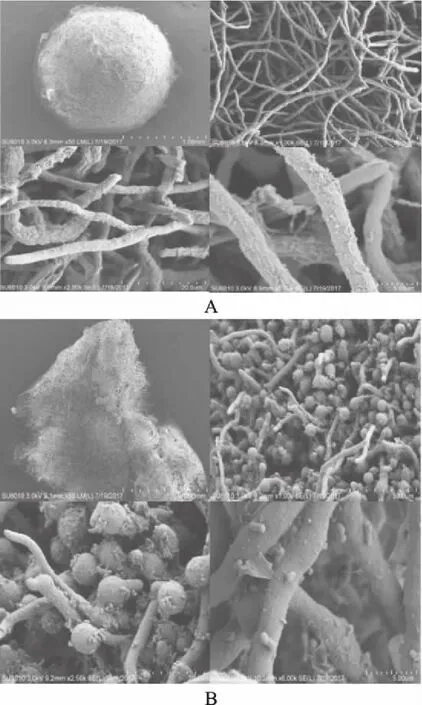
图7 wt16菌株对黄曲霉菌株形态影响扫描电镜图Fig.7 Scanning electron microscopy(SEM) images of A.flavus effected by wt16注:(A)为黄曲霉73菌丝体在扫描电镜下放大100×、 2000×、5000×、20000×的形态图;(B)为与wt16菌株 作用过后的黄曲霉73菌丝体在扫描电镜下 放大100×、2000×、5000×、20000×的形态图。
2.6 非脱羧勒克菌wt16菌株不同发酵组分对黄曲霉73菌的影响
由表1可知,与对照Ⅰ相比,非脱羧勒克菌wt16上清液能抑制黄曲霉73菌的生长及产毒,进行高温处理后的上清液只能抑制黄曲霉73菌的产毒而不能抑制黄曲霉73菌的生长,非脱羧勒克菌wt16的死菌体对黄曲霉73菌没有作用,而大肠杆菌的上清液(对照Ⅱ)不能抑制黄曲霉73菌产毒,说明非脱羧勒克菌wt16上清中有某种代谢产物对黄曲霉菌株73菌的产毒和生长有抑制作用,并且其代谢产物中有某些可以抑制黄曲霉73菌生长的产物在经高温处理后会失去抑制作用,而高温对能抑制产毒的代谢物质无影响。
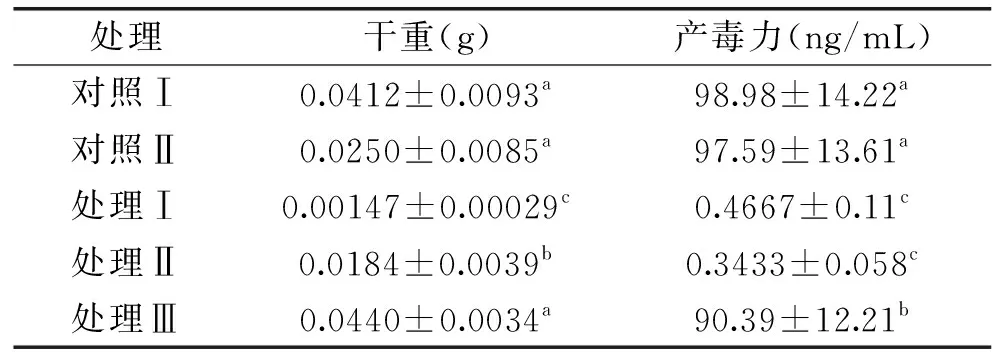
表1 wt16不同组分对黄曲霉73菌的影响(n=3)Table 1 The influence of different components of wt16 on A.flavus 73(n=3)
2.7 发酵时间对非脱羧勒克菌wt16菌株有效成分的影响
由图8可知,对照组中黄曲霉毒素含量为(237.27±13.63) ng/mL,黄曲霉73菌在培养1 d的非脱羧勒克菌wt16上清液中生长5 d后产毒量为(30.83±3.59) ng/mL,其抑制率为87%,1~3 d对黄曲霉菌73的产毒抑制率差异性不显著(p>0.05),6 d培养出来的wt16上清液对黄曲霉菌73的产毒抑制率最高,其毒素含量为(11.5±3.08) ng/mL,抑制率达93.85%,但4~9 d的抑制率差异性不显著(p>0.05),因此wt16培养时间超过4 d最佳。
2.8 发酵温度对非脱羧勒克菌wt16有效成分的影响
由图9可知,在10 ℃时wt16菌株会变性,菌液变粘稠,无法离心制备wt16菌株的发酵上清液,在45 ℃时wt16菌株不生长。实验结果发现,对照组毒素含量为(294.71±6.65) ng/mL,在40 ℃培养时wt16发酵上清液对黄曲霉73菌的产毒抑制率最高,其毒素含量为(11.61±4.04) ng/mL,对黄曲霉73菌的产毒抑制率达96.1%,其余温度毒素含量差异性不显著(p>0.05),因此wt16培养温度在15~40 ℃均可。
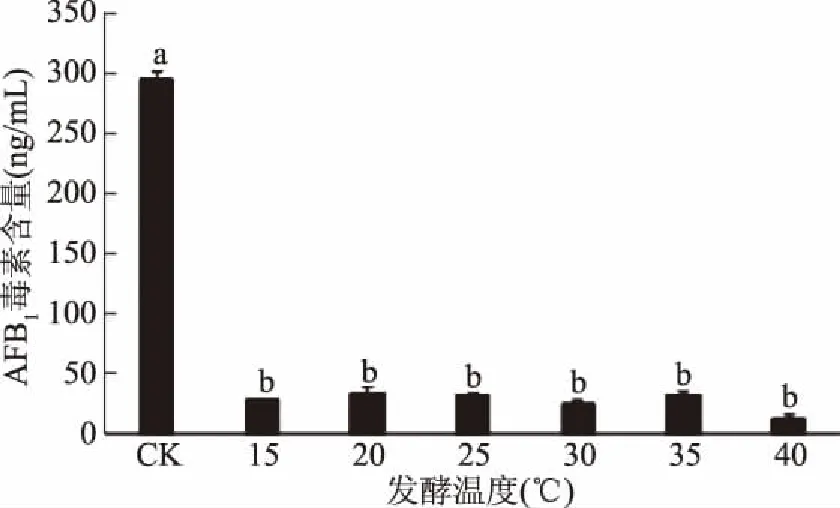
图9 发酵温度对wt16有效成分的影响Fig.9 Effect of different temperatures of wt16 on control of A. flavus
3 结论
本实验在前期筛选获得一株非脱羧勒克菌wt16的基础上,首次研究表征了非脱羧勒克菌wt16对黄曲霉具有抑生长性及抑毒性,研究发现在液体培养基中,非脱羧勒克菌wt16能明显抑制黄曲霉菌的生长及产毒,并且对不同地区分离出来的黄曲霉菌均有抑制作用,其对黄曲霉菌丝生长抑制率达77%、92%,对黄曲霉菌产毒的抑制率达90%~96%,对有无损伤的花生均能抑制黄曲霉菌的生长及产毒。用扫描电子显微镜观察发现非脱羧勒克菌wt16能改变黄曲霉菌菌丝形态。非脱羧勒克菌wt16在15~40 ℃条件下培养4 d后,其发酵上清液对黄曲霉菌产毒抑制率最高。
虽然黄曲霉毒素的生物防治取得了一定的研究进展,但目前的研究仍存在许多不足之处,对其有效抑菌成分的研究还缺乏深入的探讨,如果能分离鉴定出确切的抑菌成分,将会加速生防黄曲霉毒素研究的进程,初步认为该非脱羧勒克菌wt16菌株能通过产生次级代谢产物来抑制黄曲霉的生长及产毒,这个结果与其他拮抗剂如枯草芽孢杆菌[29]及短小芽孢杆菌[30]的研究结果一致。本研究发现非脱羧勒克菌wt16对黄曲霉的生长及产毒有很好的抑制作用,具有潜在的应用价值,但由于本实验未做安全性评价,为了避免活菌影响,本实验室将进一步研究非脱羧勒克菌wt16上清液内的有效活性成分,再利用对环境无害的活性成分进行黄曲霉菌生物防治的应用。
