农杆菌介导的外源基因在本氏烟中瞬时表达体系优化研究
2018-09-13陈思涵彭杰军鲁宇文郑红英陈剑平
陈思涵 钱 靖 彭杰军 鲁宇文 郑红英 林 林 燕 飞 陈剑平
(1. 安徽农业大学植物保护学院,安徽 合肥 230036;2. 浙江省农业科学院病毒学与生物技术研究所,浙江 杭州 310021;3. 宁波大学植物病毒学研究所,浙江 宁波 315211)
由于植物也是一个生产成本低廉、相对较为安全的高性价比 “绿色工厂”,且植物体内可以进行蛋白折叠、复合体装配以及糖基化等翻译后修饰过程,因此植物中表达外源蛋白的研究也成为热点之一[1]。植物表达系统应用于商业模式存在许多技术瓶颈,增加植物体内重组蛋白产量是难点之一。为提高植物体内目的蛋白的表达产量,科研工作者分别从蛋白形成、分泌运输、降解3个方面展开研究[2]。首先在转录及转录后水平进行研究发现,使用强启动子、增加内含子、5′-UTR等方式可以有效增加mRNA的转录水平,保证外源基因mRNA的表达量及稳定性,从而增加重组蛋白表达量[3-4]。同时利用病毒沉默抑制子抑制目的蛋白mRNA降解,也能有效促进重组蛋白表达量的增加[5]。但随后研究发现,部分蛋白出现较高的mRNA水平,较低的蛋白产量,研究表明该类重组蛋白可能被植物蛋白降解系统快速降解[6]。这可能与蛋白分泌运输有关,植物体内部分细胞区域富含多种蛋白水解酶,目的蛋白一旦处于此类区域将被快速降解,如合成蛋白从内质网运输到高尔基体等细胞器后会导致蛋白降解[7]。在目的蛋白N或C端添加信号肽,通过改变外源蛋白定位可抑制降解速率, ER定位以及叶绿体内表达外源蛋白能有效抑制降解[8-9]。根据蛋白水解酶的降解功能及目的蛋白的表达特性,如在植物细胞BY-2培养液中添加蛋白稳定剂,或者共表达蛋白酶抑制子如SlCDI (Cathepsin D inhibitor)[10]、proteinase inhibitor II (I20家族)、Serine proteae inhibitor (I12家族) 等均能一定程度提高外源蛋白的表达量[11-12]。除此之外,通过沉默蛋白水解酶基因的方式也能提高外源蛋白表达,如CysP6沉默可以使外源蛋白表达量增加1.6倍;在BY-2细胞系中NtCP、NMMP1、NtSP等缺失也可以有效提高外源蛋白表达量[13-14]。由此可见,植物外源蛋白表达是一个复杂的系统过程,抑制蛋白降解过程是有效解决外源蛋白表达量的重要方式。
目前对于植物体内外源蛋白的降解研究,主要集中于蛋白水解酶的研究,由于植物体内蛋白水解酶具有数百种,一类蛋白水解酶仅针对某一类外源蛋白,因此很难找到一种适用性较广的蛋白水解酶抑制策略。细胞自噬途径是普遍存在于植物体内的重要蛋白降解途径,主要通过细胞内双层膜凹陷形成囊泡结构后,与溶酶体融合成为自噬溶酶体执行降解功能。根据形成自噬体的方式不同可以分为3类:巨自噬、微自噬和伴侣参与的自噬,而在植物中只发现巨自噬和微自噬[15-16]。自噬途径涉及30多个蛋白,Atg5是参与自噬途径的重要基因,在植物体内仅发现一个,它参与Atg8介导的泛素化系统[17],是自噬途径的重要蛋白。研究进展可知,自噬途径对于被UPS (ubiquitin-proteasome system) 标记的异常、变性、未折叠或者缩短的有害蛋白或者细胞器,通过双层膜包裹降解[18-19]。自噬途径也可能参与叶绿体、线粒体等内含物、细胞器的降解过程,因此自噬途径是植物体内监控外源、内源蛋白及细胞器的重要功能途径,但目前未有详细报道关于自噬途径与外源蛋白表达的研究。本研究期望通过添加定位信号、共表达沉默抑制子、沉默atg5,从RNA、蛋白水平来初步探讨3类因素对外源蛋白表达的影响,为后续制定合理的外源蛋白表达策略提供参考。
1 材料与方法
1.1 质粒及农杆菌
根癌农杆菌EHA105由浙江省农业科学院病毒与生物技术研究所吴学龙提供,pCV1300,p25、HC-Pro、根癌农杆菌C58C1由本实验室提供。
1.2 质粒构建
根据 (http://nebenfuehrlab.utk.edu/markers/default.htm) 提供的已确认的内质网、叶绿体、高尔基体等细胞器定位的信号肽序列,以本实验改造的pCV1300为载体,分别构建Gi (Golgi)、ER (Endoplasmie reticulum)、Px (peroxisomes)、Mt (mitochondria)、Pt (plastids)、Ch (chloroplast) 定位载体 (表1)。以本实验改造的pCV1300为载体,根据NCBI (KX369397.1) 的Nb-Atg5序列设计反向重复结构,双酶切构建atg5局部沉默载体—siatg5。

表1 定位信号序列Table 1 Sequences of signal location
1.3 本氏烟种植
本实验所用植物材料均为本氏烟草 (Nicotianabenthamiana)。将本氏烟种子播种于基质土 (V(营养土)∶V(蛭石) 为1∶3),10 d后发芽分苗,22 ℃,16 h光培养,8 h暗培养,20 d左右成苗,选取6~8叶的本氏烟用于农杆菌浸润实验。
1.4 农杆菌共浸润实验
将p25、HC-pro、ER-GFP、siatg5等质粒电转到EHA105农杆菌,28 ℃过夜培养。分别挑取单克隆放在5 mL含有5 μL/mL卡那霉素和利福平5 μL/mL的LB 培养基中,28 ℃过夜培养 (280 r/min),次日按照1∶50的比例将1 mL的培养物加到50 mL的含有上述抗生素的培养基中,另加入终浓度为20 μmol/L的乙酰丁香酮 (AS) 和终浓度为10 mmol/L的乙磺酸 (MES)。28 ℃过夜培养 (280 r/min) 后,在4 ℃、5 000 r/min的条件下离心20 min收集菌体,该菌体用MMA溶液 (含有终浓度100 μmol/L的AS,终浓度为10 mmol/L MES和终浓度为10 mmol/L的MgSO4) 重悬。按照p25/HC-Pro与ER-GFP终浓度OD600分别为1.000和0.500,siatg5与ER-GFP/Mt-GFP/Pt-GFP/Px-GFP终浓度OD600分别为0.500 0和0.500 0混合,将重悬液在室温下静止2~3 h后对本氏烟进行共浸润,UV下每隔12 h观察1次。
1.5 GFP蛋白检测
用直径2 cm的打孔器取样,每个样品取4个亮斑,液氮研磨后加100 μL PBS蛋白提取液,4 ℃裂解12 h后14 000 r/min,4 ℃离心15 min,吸取上清液获得植物总蛋白,提取液按比例与5 × loading buffer混合,PAGE胶后转膜,Anti-GFP抗体进行Western杂交。
1.6 GFP mRNA表达水平检测
用直径2 cm的打孔器取样,每个样品取4个亮斑,液氮研磨后,利用Trizol提取总RNA,反转后进行半定量检测。以UBC为内参,GFP为检测引物,每个样品每对引物分别准备4管,扩增循环体系为预变性94 ℃ 5 min,循环体94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s、4 ℃ 1 min,循环数28~34个。每个样品每对引物分别获得28、30、32、34个循环时的PCR产物,琼脂糖胶后检测对照和处理样品的UBC灰度值,分析UBC一致的情况下,对照和处理样品 GFP条带的灰度值。
2 结果与分析
2.1 沉默抑制子通过抑制RNA沉默减缓外源蛋白降解
mRNA积累量直接决定蛋白的表达水平,RNA沉默是植物体内重要的RNA降解途径,病毒沉默抑制子能有效抑制RNA沉默过程。本研究利用已知的沉默抑制子p25、HC-Pro,以ER-GFP为研究对象 (ER-GFP终浓度OD600=0.500),确认沉默抑制子对外源蛋白表达的影响。将p25、HC-Pro与ER-GFP共浸润, UV下观察GFP荧光的表达。随着时间推移沉默抑制子一侧荧光明显强于对照一侧,蛋白检测显示p25,HC-Pro能减缓GFP蛋白的降解。以第2天对照样品GFP蛋白表达量为参照,第6天对照样品分别下调至0.35、0.74,第6天沉默抑制子一侧蛋白量(p25/HC-Pro)分别保持在1.56、2.27倍。p25/HC-Pro处理后ER-GFP mRNA在第6天时仅下调约20%,而对照一侧几乎降解完全 (图1a,b)。由此表明,p25/HC-Pro通过抑制mRNA降解来保持较高的GFP蛋白表达量,mRNA的积累能保证较高的外源蛋白表达。
图1中:a为p25与ER-GFP共浸润第2~6天,UV、Western blot、半定量检测结果;b为HC-Pro与ER-GFP共浸润第2~6天,UV、Western blot、半定量检测结果。Western blot、mRNA检测条带数值通过ImageJ计算出条带灰度值,将各时间点对照与处理样品蛋白/mRNA数值均与第2天对照样品值比较,第2天对照样品记为1。
2.2 内质网定位信号可显著提高外源蛋白表达的稳定
蛋白合成后运输到不同细胞器,将导致外源蛋白不同程度发生降解,为确认各细胞器定位对外源蛋白降解的影响,本研究构建内质网、高尔基体、叶绿体、线粒体等细胞器定位载体,确认各定位信号对蛋白降解的影响。本研究将各细胞器定位载体农杆菌瞬时转染本氏烟(OD600=1.000),注射后2 d各载体出现不同程度的绿色荧光,第6天时除ER外,其余细胞器定位蛋白均已淬灭。各定位载体蛋白检测结果也表明, ER蛋白较为稳定,其次为GFP、Ch (第6天GFP、Ch-GFP蛋白分别保持在0.40、0.55)。同时各载体mRNA表达量分析表明,ER mRNA降解速度也低于其余样品 (图2)。但GI/Px-GFP检测结果显示,第6天时mRNA分别保持在0.43、0.33,其蛋白表达量仅有0.03、0.03,由此可知,高的mRNA表达水平,并非一定具有较高的蛋白表达量,细胞器定位也对蛋白最终表达产生影响。本研究显示ER定位载体蛋白稳定性均高于其他定位载体,内质网定位信号是增加外源蛋白表达的高效定位信号。

图1 p25、HC-Pro抑制外源蛋白mRNA降解Fig.1 Suppressor p25 and HC-Pro inhibited the degradation of exogenous mRNA

图2 不同定位信号GFP表达稳定性有明显差异Fig.2 The significant differences in the expression stability of GFP with different localization signals
图2中:Western blot、半定量检测条带数值通过ImageJ检测灰度值,将各样品第4,6天蛋白/mRNA数值与第2天数值比较,第2天样品记为1;各载体浸润第2~6天,UV、Western blot、半定量检测结果,其中Western检测上样量除GI为20 μL外,其余样品均为10 μL。
2.3 atg5沉默能缓解外源蛋白的降解
atg5沉默抑制外源蛋白降解见图3。
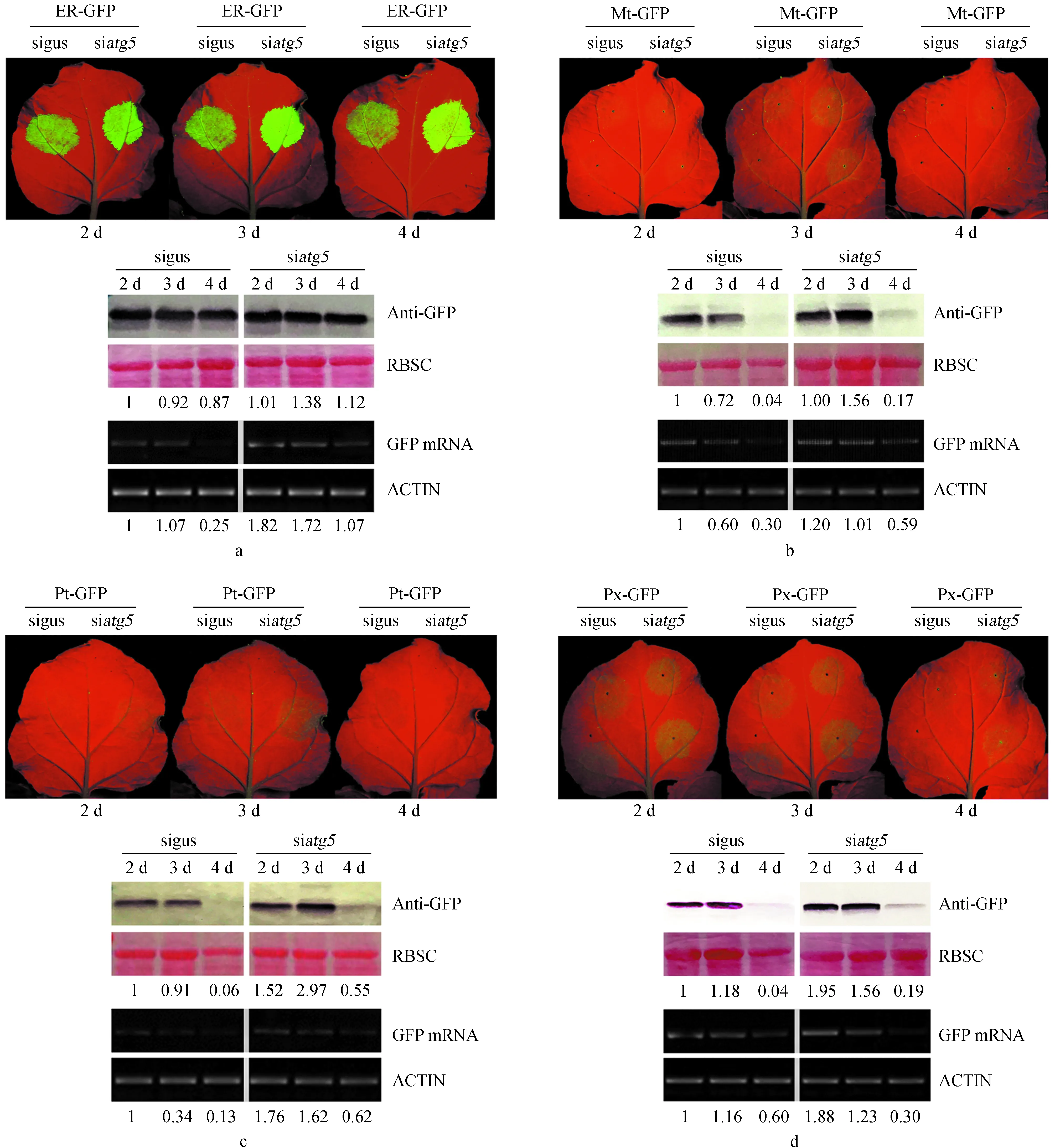
图3 atg5沉默抑制外源蛋白降解Fig.3 atg5 silencing inhibited the degradation of exogenous proteins
植物体内除监控外源RNA的途径以外,存在众多蛋白监控途径,自噬途径是植物体内重要的蛋白降解途径,Atg5是自噬途径中决定自噬囊泡形成的关键基因,且植物体内该家族仅有1个基因,对atg5的沉默会直接导致自噬途径受阻。将构建的siatg5与ER-GFP共浸润 (OD600为0.500),以sigus+ER-GFP为对照组检测第2~4天的表达情况,结果表明atg5沉默一侧GFP蛋白表达量明显高于对照一侧,第4天对照组蛋白降至0.87,atg5沉默的样品仍能保持1.12倍表达 (图3a)。为进一步确认atg5沉默对其他易降解蛋白的影响,本研究分别以稳定性稍差的Mt/Pt/Px-GFP为研究对象。结果表明,atg5沉默部分缓解Mt/Pt/Px-GFP蛋白的降解,第3天时atg5沉默样品Mt/Pt/Px-GFP分别为第2天对照组蛋白量的1.56、2.97、1.56倍 (图3b,c,d)。mRNA分析表明,atg5沉默没有对mRNA的降解速率产生明显影响。由此可知,atg5沉默能一定程度缓解外源蛋白降解速率。
图3中:a为atg5沉默后ER-GFP第2~4天,UV、Western blot、mRNA的表达变化;b为atg5沉默后Mt-GFP第2~4天,UV、Western blot、mRNA的表达变化;c为atg5沉默后Pt-GFP第2~4天,UV、Western blot、mRNA的表达变化;d为atg5沉默后Px-GFP第2~4天,UV、Western blot、mRNA的表达变化。Western blot、半定量检测条带数值通过ImageJ检测灰度值,将sigus与siatg5的样品蛋白/mRNA数值分别与第2天sigus样品蛋白/mRNA灰度值比较,第2天sigus样品记为。
3 结论与讨论
植物的生产成本低廉,具有蛋白折叠、翻译后修饰、可以体内形成蛋白复合体等优势,使植物作为生物反应器表达外源蛋白,成为近几十年的研究热点。目前植物表达系统常用于重要经济价值的药用蛋白或疫苗的制备等,并在普通烟、本氏烟、水稻细胞等细胞或植株中,成功表达鼠IgG1抗体、hGM-CSF、人类VEGF等[11,20],均产生较高的经济价值,但植物表达系统仍然存在目标蛋白表达量较低的问题。研究表明筛选合适的启动子、添加5′-UTR、增加内含子、添加3′-UTR的顺式作用元件等方法能增加mRNA的转录水平,提高mRNA转录后的稳定性,从而促进外源蛋白表达[3-4]。沉默抑制子抑制RNA沉默途径也是提高mRNA表达水平的有效手段,本研究也证明p25/HC-Pro与ER-GFP共表达,可以高效抑制mRNA降解,从而使目的蛋白增加1.5~2倍。本研究结果表明,GI/Px-GFP高的mRNA水平不一定具有较高的蛋白表达,这可能与GI、Px定位有关[21];内质网定位能有效降低蛋白降解,第6天时仍有1.33倍的蛋白表达。内质网是一个多功能管网状结构,是蛋白合成、折叠、分泌、跨膜运输、脂类、甾醇类生物合成的重要场所。在内质网上还能通过分子伴侣和蛋白修饰酶,来确保合成蛋白的正确折叠、修饰并装配到多蛋白复合体中,因此内质网是蛋白合成的重要场所,也是目的蛋白定位的理想工厂。
目前研究显示外源蛋白降解的原因较为复杂,可能与细胞内分泌蛋白水解酶、目的蛋白被细胞吸收、蛋白自身稳定性等有关。植物中存在大量蛋白水解酶,如拟南芥中大约有1 900个直接或间接参与多肽链水解的基因。针对目的蛋白特性抑制蛋白水解酶也是常用的有效手段,如筛选的CDI (Cathepsin D inhibitor)、Oryzacystatin I、能较好的增加蛋白表达,但对蛋白性质和表达细胞器位置有一定偏好性。为增加表达蛋白稳定性,开发出种子、胚乳、叶绿体等组织和器官中特异表达外源蛋白的策略[22]。
虽然内质网或叶绿体定位可以大量表达蛋白,但过量表达蛋白会造成细胞器受到胁迫,过量蛋白的表达会导致未折叠蛋白过量积累,并被蛋白降解系统识别[23]。其中内质网合成蛋白的过程能被ERAD (ER-associated degradation) 机制监控,该系统能将错误和未折叠蛋白通过26S泛素化蛋白酶体降解。研究表明内质网蛋白大量表达会造成UPR (Unfold protein response),UPR随后能触发自噬途径,植物细胞利用自噬途径降解未折叠蛋白[24-25]。叶绿体是具有双层膜结构的重要细胞器,研究表明叶绿体及内含物也与自噬途径有密切相关,受到胁迫的叶绿体能被自噬途径所吞噬[26],由此可知,内质网、叶绿体虽然是理想的外源蛋白表达场所,但由于自身容量限制及细胞的调控机制,过量表达外源蛋白也能被植物内源监控系统——自噬途径所识别调控。自噬途径是普遍存在于真核生物中调控细胞正常生理活动的重要途径,由于该途径涉及众多生物活动,并且与人类癌症、肿瘤等密切相关,自噬途径也成为近期研究的热点,但目前外源蛋白表达与植物自噬途径的关联研究尚未明确。
自噬途径是植物体内重要监控机制,除参与ER胁迫、叶绿体降解等过程外,自噬系统可能在翻译后修饰过程如泛素化、乙酰化、磷酸化作用都起到调节作用[27]。因此自噬途径在外源蛋白表达过程中,可能参与蛋白分泌、降解以及翻译后修饰等过程,基于自噬途径的重要性,本研究针对自噬途径重要基因Atg5与外源蛋白降解过程进行初步研究。结果表明,沉默atg5会导致ER/Mt/Pt/Px等多种细胞器定位蛋白表达量不同程度的增加,自噬途径可能对多种细胞器定位蛋白起到监控作用。Toyooka等研究发现Cytb5 (cytochrome b5) 融合RFP在BY-2中过表达,能定位于空泡内,当自噬途径被抑制该定位消失,表明外源蛋白可能受自噬途径调控,本研究atg5沉默实验也进一步验证此推测[28]。由此可知,自噬途径可能指导外源蛋白的降解过程,但自噬途径对外源蛋白的具体调控机制,还有待于做进一步研究。
植物作为生物反应器由于成本低,操作简单一直被广泛应用,但由于外源蛋白表达不稳定和表达量低等问题,成为限制植物蛋白表达系统规模化生产的瓶颈。本研究通过共表达沉默抑制子、添加定位信号、沉默atg5,进一步明确内质网定位可以提高外源蛋白的稳定性;沉默抑制子可以延缓mRNA的降解提高蛋白表达量;而atg5沉默能有效抑制外源蛋白降解。因此根据外源蛋白表达要求改变细胞器定位,同时结合沉默抑制子以及抑制自噬途径等方式相结合,可能有效保证外源蛋白的稳定高效表达。
