高容量阴离子交换磁性微球的制备及其对蛋白质的吸附性能
2018-09-12贺茂芳唐一梅
贺茂芳 张 博 唐一梅 韩 禄
(西安医学院药学院,西安医学院药物研究所, 西安 710021)
1 引 言
离子交换色谱(Ion-exchange chromatography, IEC)是生物大分子最常用的分离纯化手段之一[1~3]。根据固定相表面离子交换基团的带电性质,可分为阳离子交换和阴离子交换固定相;根据官能团的解离能力,又可分为强阳/阴离子交换和弱阳/阴离子交换固定相[3]。蛋白质在离子交换固定相上的保留与固定相表面电荷的性质和数量密切相关。理论上,固定相表面的电荷数量越多,即离子交换容量越大,与之发生交换的反离子越多,因此柱容量越大,分离纯化的产量越高。
目前,固定相的制备大多是将小分子功能团直接键合在基质表面,该方法键合的配基密度小,造成固定相的离子交换容量低[4,5]。随着生物工程和生物制药的快速发展,现有固定相已经难以满足复杂生物样品的分离纯化要求。因此,制备新型高容量离子交换固定相具有重要意义。研究表明,向材料表面引入聚合物大分子是提高吸附容量的有效手段[6,7]。原子转移自由基聚合、超支化反应等是向材料表面引入聚合物的常用方法,然而,这些反应条件苛刻、过程复杂,限制了其在实际中的应用[8~10]。聚乙烯亚胺(Polyethyleneimine, PEI)是一种阳离子聚合物,其分子骨架和支链上都含有大量的氨基。在较低pH值时,高密度的氨基被质子化,可通过静电作用吸附带负电荷的物质。因此,PEI是一种理想的离子交换配体,将其用于固定相的制备,可有效提高固定相的离子交换容量[11]。目前,PEI主要用于制备离子交换树脂[12~15]。Hong 等[14]用PEI修饰琼脂糖凝胶,对BSA和γ-乳球蛋白的吸附容量分别达到(273±9) mg/mL和(192 ± 14) mg/mL。然而,PEI大分子容易阻塞树脂的多孔结构,增加传质阻力,不利于生物大分子的快速分离纯化。
Fe3O4磁性纳米粒子的生物相容性好、性质稳定、比表面积大,且具有易于分离、表面易修饰等优点,是十分理想的纳米载体[16,17]。目前,以Fe3O4为基质制备的磁性吸附剂广泛应用于蛋白质、多肽的分离富集[18]。例如将硼亲和磁性微球[19]、固定金属亲和磁性微球[20,21]用于糖蛋白/糖肽、磷酸化蛋白/磷酸化肽的分离富集,不仅操作简便,而且具有较高的吸附容量和选择性。本研究将Fe3O4与PEI结合,制备新型高容量阴离子交换磁性吸附剂用于蛋白质的分离纯化,反应条件温和无毒,分离过程简便易操作,提高了蛋白质分离纯化的效率,具有良好的实际应用前景。
2 实验部分
2.1 仪器与试剂
Cary 60紫外可见分光光度计(美国安捷伦公司);Hitachi H600透射电子显微镜(日本日立公司);STA600热重分析仪(美国Perkin-Elmer仪器公司);TENSOR 27傅立叶红外光谱仪(德国布鲁克公司);TS-211BQ型恒温振荡器 (上海岛析实业有限公司);SB-5200DT型超声清洗仪(宁波新芝生物科技股份有限公司)。
多巴胺盐酸盐(分析纯,北京百灵威科技有限公司);PEI (Mr=1800,98%,上海纯晶实业有限公司); 牛血清白蛋白(BSA)、β-酪蛋白、溶菌酶、核糖核酸酶A(纯度>98%, 美国Sigma-Aldrich公司);其余试剂均为分析纯。
2.2 实验方法
2.2.1阴离子交换磁性微球的制备(1) Fe3O4的制备 参照文献[22],采用水热法制备Fe3O4磁性纳米粒子: 将1.3 g FeCl3、0.4 g柠檬酸酸钠、2.0 g无水乙酸钠溶于30 mL 乙二醇中,搅拌30 min后转移至聚四氟乙烯反应釜,200℃反应12 h。反应结束后,磁分离移去上层溶液,所得磁性微球用水、乙醇依次洗涤。(2) Fe3O4表面包覆聚多巴胺 参照文献[23],将1.0 g Fe3O4分散于500 mL 10 mmol/L Tris-HCl (pH8.5),向其中加入1.0 g多巴胺,超声分散2 min,常温下机械搅拌反应12 h后,得到聚多巴胺包覆的Fe3O4(Fe3O4@pDA),依次用Tris-HCl缓冲液、水和乙醇多次洗涤产物,备用。(3) PEI的接枝 将Fe3O4@pDA分散于30 mL 磷酸盐缓冲液(PBS, pH 8.5),加入PEI 1.0 mL,60℃反应12 h,得到PEI型阴离子交换磁性微球(Fe3O4@pDA@PEI),用水和乙醇交替洗涤多次,45℃真空干燥后,备用。
2.2.2离子交换容量的测定Fe3O4@pDA@PEI的离子交换容量采用AgCl沉淀滴定法测定[13]。0.5 g Fe3O4@pDA@PEI分散于20 mL 1.0 mol/L NaCl溶液中,振荡30 min,倾去上清液,再加入NaCl溶液,振荡,如此重复3次,以使Fe3O4@pDA@PEI与Cl——充分交换。用50 mL 0.1 mol/L HCl和 200 mL 0.1 mmol/L HCl依次洗涤微球,除去游离的Cl——。最后,将磁性微球分散于20 mL 10% Na2SO4溶液中,振荡1h,将上清液全部合并,用0.1 mol/L AgNO3溶液滴定其中的Cl——浓度,即可计算离子交换容量。
2.2.3吸附时间的优化称取10.0 mg Fe3O4@pDA@PEI于离心管中,加入3.0 mL 浓度为0.5 mg/mL的蛋白质溶液 (用pH=7.0, PBS配制),置于25℃恒温摇床中振荡(150 r/min),设定振荡时间为1、2、4、8和12 h (平行3次实验)。振荡结束后,用紫外可见分光光度法(λ=280 nm)测定上层溶液的浓度,按公式(1)计算吸附量。
Q=(C0-Ce)×V/m
(1)
式中,Q为吸附量(μg/mg),C0为吸附前蛋白质溶液的初始浓度(mg/mL),Ce为吸附后蛋白质溶液的平衡浓度(mg/mL),V为溶液的体积(mL),m为吸附剂的质量(mg)。
2.3.4吸附pH值的优化称取10.0 mg Fe3O4@pDA@PEI于离心管中,加入3.0 mL 0.5 mg/mL的蛋白质溶液(分别配制于pH=6.0、7.0、8.0、9.0的缓冲液中),在25℃以150 r/min振荡2 h后,测定上清液的浓度,按公式(1)计算吸附量。
2.3.5静态吸附等温线的测定将10.0 mg Fe3O4@pDA@PEI分散于一系列不同浓度的蛋白质溶液 (pH=7.0 PBS) 中,在25℃以150 r/min振荡2 h后,测定上清液的浓度,按式(1)计算吸附量并绘制吸附等温线。以同样的方法测定Fe3O4@pDA@PEI对β-酪蛋白、溶菌酶和核糖核酸酶A的静态等温吸附线。
利用Langmuir方程(公式(2))对吸附等温线进行拟合[24],以计算饱和吸附容量。
(2)
式中,Q为吸附量(μg/mg),C0为蛋白质溶液的起始浓度(mg/mL),Ce为吸附平衡时蛋白质溶液的浓度(mg/mL),Kd是解离常数(mg /mL),Qm是饱和吸附容量(μg/mg)。
3 结果与讨论
3.1 Fe3O4@pDA@PEI的制备与表征
Fe3O4@pDA@PEI的制备路线如图1所示。根据文献[25]报道,多巴胺在碱性条件(pH>7.5)下易被氧化,从而发生自聚反应,生成聚多巴胺,聚多巴胺可通过儿茶酚基自发地吸附在材料表面,形成聚多巴胺涂层。因此,本研究将Fe3O4纳米粒子分散于2.0 mg/mL的多巴胺溶液中,调节溶液至pH 8.5,在常温下搅拌反应12 h,使聚多巴胺吸附在Fe3O4表面,得到Fe3O4@pDA。一方面,聚多巴胺涂层增加了材料的稳定性和亲水性,有利于磁性微球在水溶液中均匀稳定地分散,增加了表面功能团与溶质分子接触的机会;另一方面,聚多巴胺分子中含有丰富的儿茶酚基,在碱性条件下,儿茶酚氧化形成苯醌,与氨基发生席夫碱反应或迈克尔加成反应,将PEI大分子直接键合在Fe3O4@pDA表面[26],得到Fe3O4@pDA@PEI。经测定,Fe3O4@pDA@PEI的阴离子交换容量为9.1 mmol/g。

图1 阴离子交换磁性微球的制备路线(Fe3O4@pDA:聚多巴胺包覆的Fe3O4,Fe3O4@pDA@PEI: PEI型阴离子交换磁性微球)Fig.1 Synthetic route of anion exchange magnetic microspheres (Fe3O4@pDA: polydopamine coated Fe3O4; Fe3O4@pDA@PEI: polyethyleneimine (PEI)-type anion exchange magnetic microspheres)
通过透射电子显微镜对磁性微球的形貌和尺寸进行了表征。如图2所示,Fe3O4的分散性好、表面粗糙,直径约300 nm (图2A);经过聚多巴胺包覆后(图2B),材料表面平滑且可观察到明显的“核壳”结构,微球的直径增至350 nm左右,说明在Fe3O4表面包覆了一层厚度约50 nm的聚多巴胺。

图2 Fe3O4(A)和Fe3O4@pDA(B)的透射电镜(TEM)图Fig.2 Transmission electron microscopy (TEM) images of (A) Fe3O4 and (B) Fe3O4@pDA
利用热重分析法测定了Fe3O4表面聚合物的含量,如图4所示。当温度由25℃升高到200℃时,Fe3O4(图4a)、Fe3O4@pDA(图4b)和Fe3O4@pDA@PEI(图4c)的质量损失率分别为6.2%、8.5%和10.3%,可能是材料中残余溶剂的挥发所致;当温度继续升高时,Fe3O4在200℃~400℃间质量下降12.4%,为其表面沉积的乙酸钠所致[27],Fe3O4@pDA和Fe3O4@pDA@PEI在200℃~600℃间质量分别下降了24.8%和30.4%,说明Fe3O4表面聚多巴胺的含量约为24.8%,PEI的含量约为5.6%。
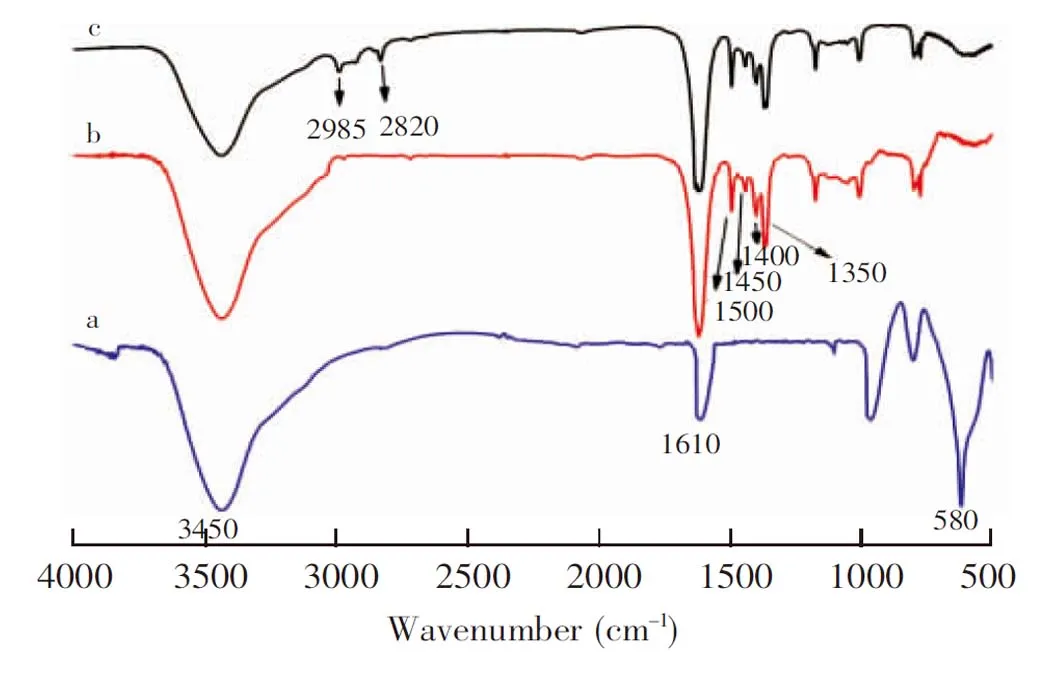
图3 傅里叶变换红外光谱图:(a)Fe3O4, (b)Fe3O4@pDA, (c)Fe3O4@pDA@PEIFig.3 Fourier transform infrared (FT-IR) spectra of (a) Fe3O4, (b)Fe3O4@pDA and (c) Fe3O4@pDA@PEI
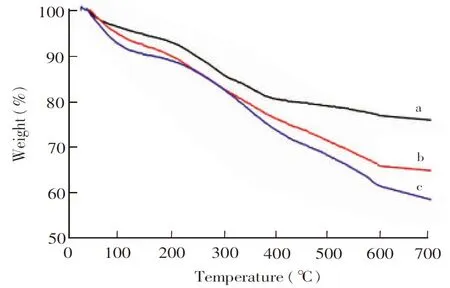
图4 热重分析曲线:(a)Fe3O4, (b)Fe3O4@pDA, (c)Fe3O4@pDA@PEIFig.4 Thermogravimetric analysis (TGA) of (a)Fe3O4, (b)Fe3O4@pDA and (c)Fe3O4@pDA@PEI
3.2 Fe3O4@pDA@PEI对蛋白质的吸附性能
3.2.1吸附时间的优化为了提高分离纯化效率,以β-酪蛋白和BSA为模型蛋白对吸附时间进行研究。如图5所示,吸附时间达到2 h以上时,吸附量升高不再明显。此微球对蛋白质的最佳吸附时间为2 h。
3.2.2pH值的影响在离子交换色谱中,pH值对吸附容量的影响是pH值对蛋白质和吸附剂表面电荷共同作用的结果。本研究以β-酪蛋白和BSA为模型蛋白,研究了Fe3O4@pDA@PEI对蛋白质的吸附量随pH值的变化情况。β-酪蛋白的等电点为4.0,BSA 的等电点为4.9,理论上,当溶液的pH值大于蛋白质的等电点时,蛋白质表面带净的负电荷,并且随着pH值的升高,所带电荷量增多;而Fe3O4@pDA@PEI微球表面含有伯胺、叔胺和仲胺,当溶液的pH值升高时,微球表面的正电荷逐渐减少,与蛋白质的作用减弱。如图6所示,当pH值从6.0增加到9.0时,Fe3O4@pDA@PEI对蛋白质吸附容量呈现先升高后降低的趋势,当pH=7.0时,吸附量为最大值。因此,Fe3O4@pDA@PEI对蛋白质吸附的最佳pH值为7.0。
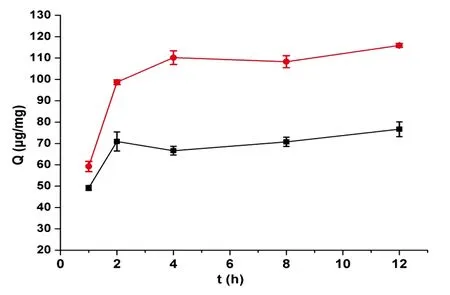
图5 吸附时间对蛋白质吸附量(Q)的影响: a, β-酪蛋白; b,牛血清白蛋白Fig.5 Effect of adsorption time on adsorption amount (Q) of protein: a, β-casein; b, bovine serum albumin (BSA)
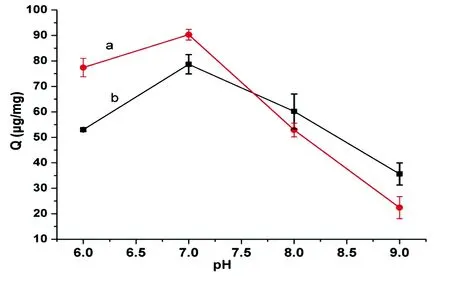
图6 pH值对蛋白质吸附量(Q)的影响: a, β-酪蛋白; b, BSAFig.6 Effect of pH on the adsorption amount (Q) for protein: a, β-casein; b, BSA
3.2.3静态吸附等温线在最佳吸附时间和pH值条件下,首先测定了Fe3O4、Fe3O4@pDA和Fe3O4@pDA@PEI对BSA的静态吸附等温线(图7)。Fe3O4@pDA@PEI对BSA的吸附量远高于Fe3O4和Fe3O4@pDA对BSA的吸附量,说明PEI的引入大大提高了磁性微球的离子交换容量,从而有效提高了对蛋白质的吸附能力。为了进一步考察Fe3O4@pDA@PEI的选择性,实验测定了Fe3O4@pDA@PEI对两种酸性蛋白(BSA、β-酪蛋白)和两种碱性蛋白(溶菌酶、核糖核酸酶A)的静态吸附等温线(图8)。Fe3O4@pDA@PEI对蛋白质的吸附量随着蛋白质溶液浓度的增加而逐渐增大,最后达到饱和。但是,Fe3O4@pDA@PEI对β-酪蛋白和BSA吸附量要远高于溶菌酶和核糖核酸酶,这与微球表面的电荷性质以及蛋白质的等电点有关。当溶液的pH=7时,β-酪蛋白和BSA带净的负电荷,与Fe3O4@pDA@PEI发生静电吸引作用,因而微球对它们具有较高的吸附容量;而溶菌酶、核糖核酸酶带净的正电荷,与Fe3O4@pDA@PEI发生静电排斥作用,因此微球对它们基本不产生吸附。因此,Fe3O4@pDA@PEI对酸性蛋白具有良好的选择性。
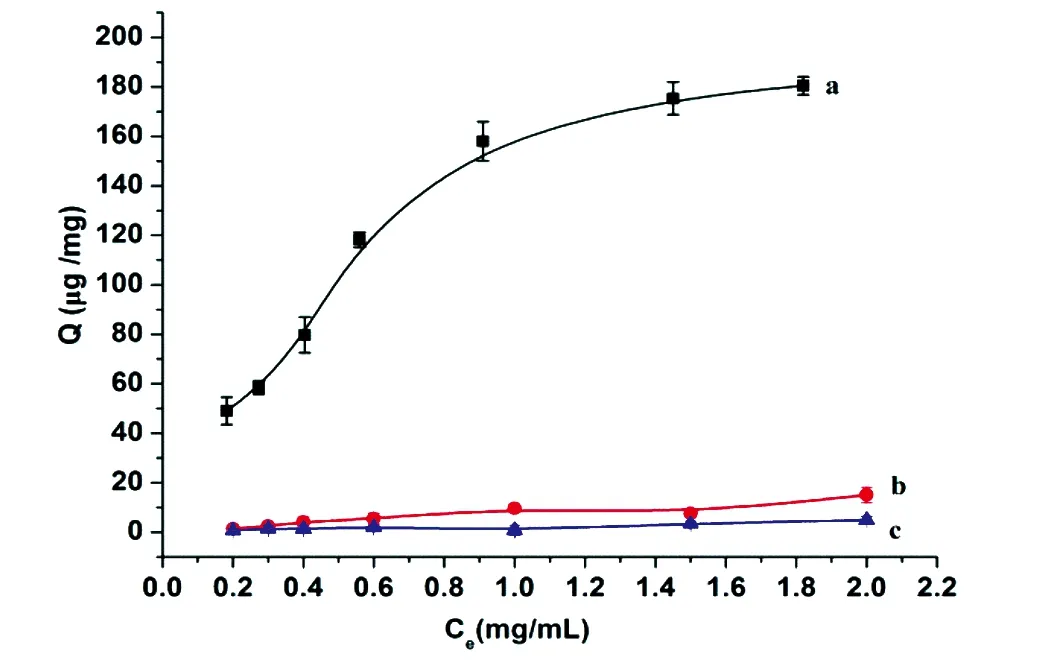
图7 不同材料对BSA的静态吸附等温线: a, Fe3O4@pDA@PEI;b,Fe3O4@pDA;c,Fe3O4Fig.7 Static adsorption isotherm of (a) Fe3O4@pDA@PEI, (b) Fe3O4@pDA and (c) Fe3O4 for BSA
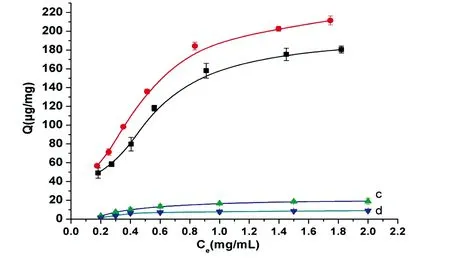
图8 Fe3O4@pDA@PEI对不同蛋白质的静态吸附等温线:a,β-酪蛋白;b,BSA;c,溶菌酶;d,核糖核酸酶AFig.8 Static adsorption isotherm of Fe3O4@pDA@PEI for different proteins: a, β-casein; b, BSA; c, Lysozyme; d, Rnase A
经Langmuir拟合发现,对于β-酪蛋白和BSA,其Ce/Q与Ce之间存在良好的线性关系,线性方程分别为Ce/Q=0.00421Ce+0.36(r=0.993)和Ce/Q=0.00489Ce+0.52(r=0.985),因此β-酪蛋白和BSA在Fe3O4@pDA@PEI微球上的吸附属于典型的Langmuir单分子层吸附[24]。经计算,β-酪蛋白和BSA的最大吸附容量分别为237.5和204.5 μg/mg。与文献[28~30]报道的阴离子交换吸附剂相比(表1),Fe3O4@pDA@PEI不仅具有较高的吸附容量,而且具有较快的吸附动力学,能够在较短时间内达到吸附平衡,提高了蛋白质分离纯化效率。
表1 不同阴离子交换吸附剂的性能比较
Table 1 Comparison of different anion exchange absorbents
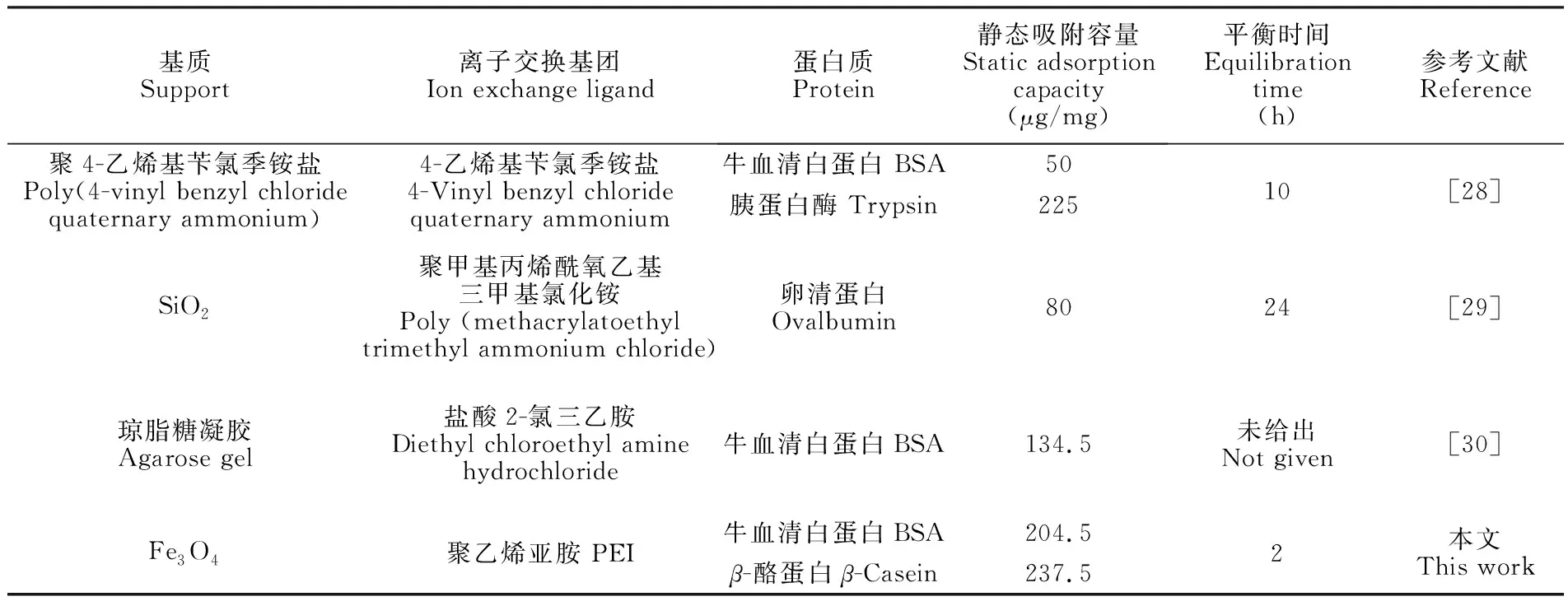
基质Support离子交换基团Ion exchange ligand蛋白质Protein静态吸附容量Static adsorptioncapacity(μg/mg)平衡时间Equilibrationtime(h)参考文献Reference聚4-乙烯基苄氯季铵盐Poly(4-vinyl benzyl chloridequaternary ammonium) 4-乙烯基苄氯季铵盐4-Vinyl benzyl chloridequaternary ammonium 牛血清白蛋白 BSA50胰蛋白酶 Trypsin22510[28]SiO2聚甲基丙烯酰氧乙基三甲基氯化铵Poly (methacrylatoethyltrimethyl ammonium chloride) 卵清蛋白Ovalbumin8024[29]琼脂糖凝胶Agarose gel盐酸2-氯三乙胺Diethyl chloroethyl aminehydrochloride 牛血清白蛋白BSA134.5未给出Not given[30]Fe3O4聚乙烯亚胺 PEI牛血清白蛋白BSA204.5β-酪蛋白β-Casein237.52本文This work
3.3 重复利用性能
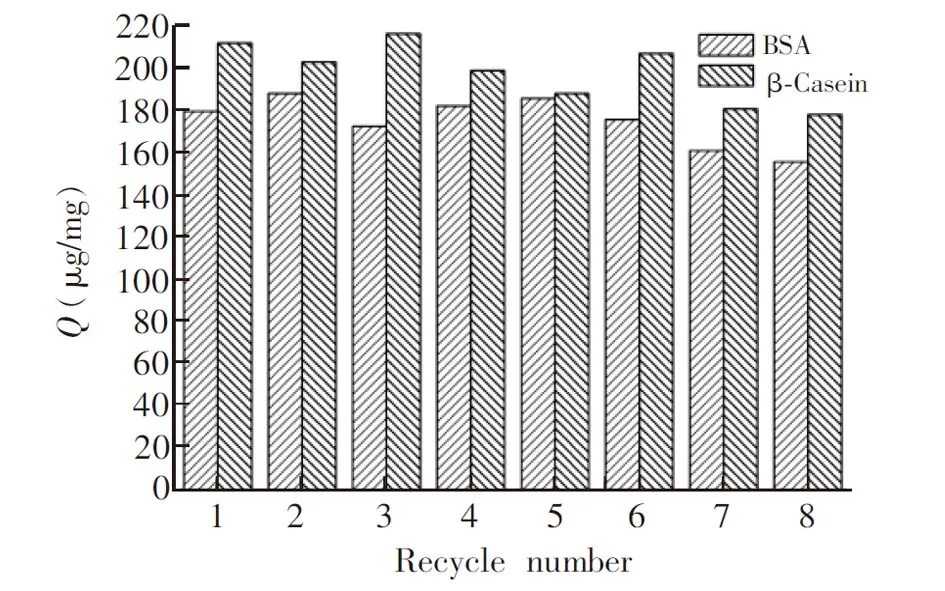
图9 重复利用次数对吸附容量的影响Fig.9 Effect of recycle times on adsorption capacity
将50.0 mg Fe3O4@pDA@PEI 微球重复进行吸附-洗脱-吸附实验,重复8次,测定吸附容量。如图9所示,重复利用7次后,吸附容量有所下降,但仍保持在初始容量的75%左右。因此,Fe3O4@pDA@PEI 具有较好的重复利用性能和稳定性。
4 结 论
将树枝状阳离子聚合物PEI成功键合在Fe3O4@pDA表面,制备了一种新型高容量阴离子交换磁性吸附剂。此材料制备方法简单,反应条件温和无毒,具有较高的阴离子交换容量和蛋白质吸附容量;同时,磁性纳米吸附剂在分离纯化过程中具有操作简便、快速等优点。制备的此阴离子交换磁性吸附剂在生物大分子的分离纯化方面具有良好的应用前景。
