核酸荧光探针在单细胞成像中的应用研究
2018-09-11贾永梅娄筱叮
贾永梅 娄筱叮 夏 帆*,3
1(岭南师范学院化学化工学院, 湛江 524048) 2(中国地质大学(武汉)材料与化学学院, 武汉 430074)3(华中科技大学化学与化工学院, 武汉 430074)
1 引 言
细胞是生命的基本单位,其中包含各种生物活性物质,如核酸(DNA、RNA)、蛋白质、离子、生物小分子等。对这些生物活性物质进行准确、实时、原位监测,可详细阐述它们在生命过程中的作用、引发的生物学效应及生物学功能,对生命科学研究、重大疾病诊断和个性化治疗具有重要意义[1]。在对这些生物活性物质进行研究的众多方法技术中,细胞成像研究技术由于具有观测定位精准的特点、独特的时间和空间分辨率高的性质,成为分子水平上准确、实时、原位监测细胞内生物活性物质信号变化及观测细胞形态的重要手段[2]。
在进行单细胞成像研究时,细胞内大多数生物活性物质自身无法产生易被仪器或肉眼所捕获的信号,通常需使用生物探针进入细胞内特异性识别生物活性物质,并与特定的生物活性物质结合,形成稳定的复合物,产生相应信号变化,通过监测生物探针信号变化,实现对细胞内生物活性物质准确、实时、原位监测[3]。生物探针的响应信号有多种,其中荧光信号在用于单细胞成像研究时,具有直观[4]、操作简单[5]、选择性好[6]、灵敏度高[7]、无需参比、不受电磁场的影响、可远程实时在线自动监测等特性[8],还具备对细胞进行静态观察、对细胞内分子动力学进行动态监测、对亚细胞结构进行定位和对蛋白质分子的相互作用进行研究等优点[9],在单细胞成像技术研究中发挥了重要作用。
近年来,研究者设计并合成出一系列荧光探针,如核酸荧光探针[10]、多肽荧光探针[11]、纳米荧光探针[12]等,利用荧光探针与目标分子之间的特异性识别作用,成功地将其引入到单细胞成像研究中,使得该研究领域进入一个全新阶段。本文重点介绍近五年来核酸荧光探针在单细胞成像中的研究进展。
2 核酸荧光探针应用于细胞成像
2.1 双标记核酸荧光探针
自1996年Tyagi等[13]首次提出分子信标(MB)探针以来,由于其相比DNA线性探针具有较高的特异性、价格低廉、设计及合成简单等优点,在生物传感器中被广泛应用。通常MB探针在设计和应用时,需标记荧光基团和淬灭基团。无目标分子存在时,MB探针自身形成特定的空间结构,荧光基团和淬灭基团在空间上靠近,所以MB探针自身不发射荧光; 当目标分子存在时,它和MB探针的环状部分结合,打开MB探针,使得荧光基团远离淬灭基团,因此发射出荧光信号[14]。通过监测探针荧光信号变化,实现对目标分子检测(图1)。
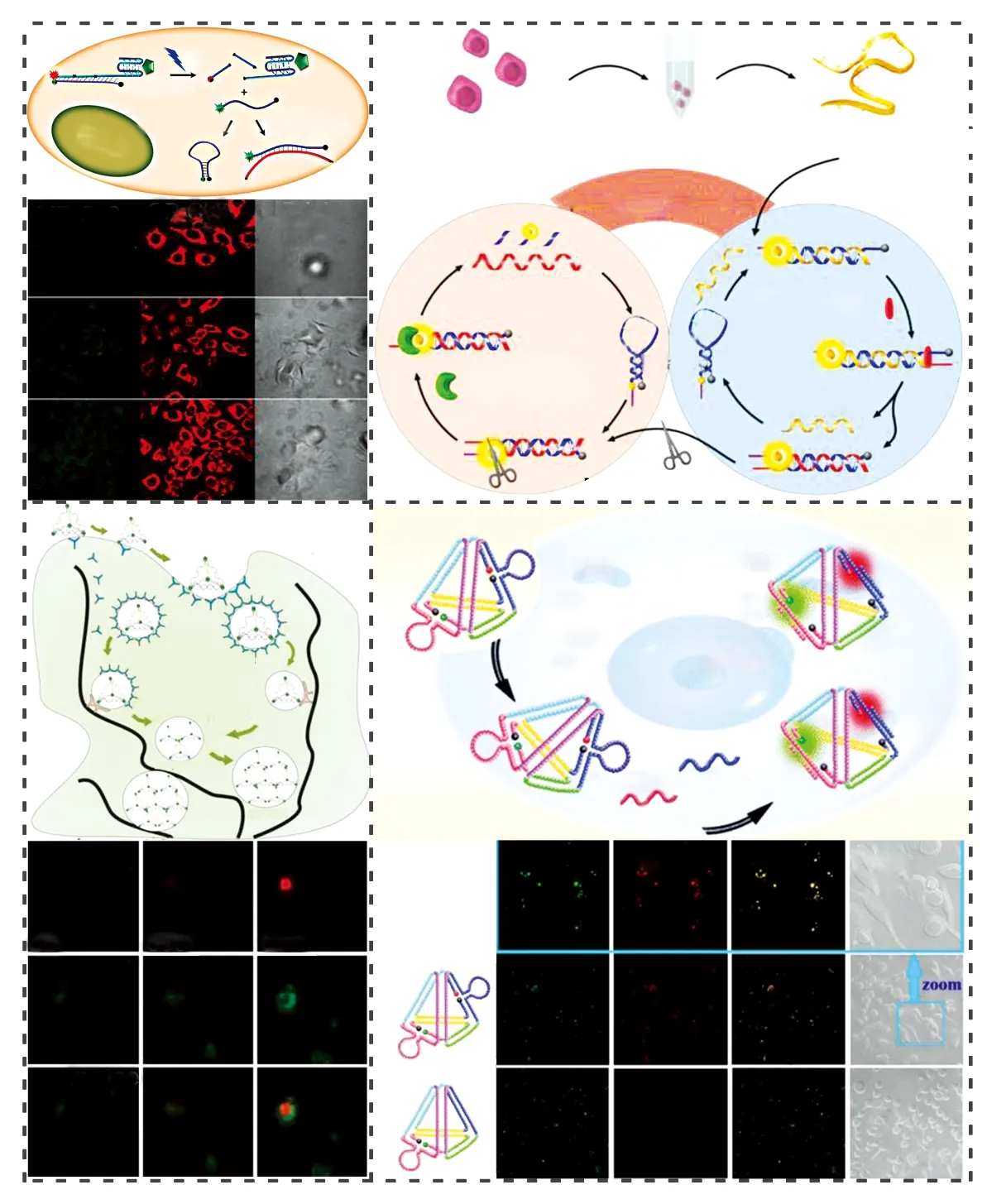
图1 分子信标荧光探针在细胞成像中的应用:(A) 分子信标探针识别DNA分子检测原理[15]; (B) 基于Bst聚合酶诱导的链置换反应和核酸外切酶辅助的循环反应的二次酶放大策略检测miRNA[16]; (C) DNA四面体结构探针在细胞内摄取与转运过程[19]; (D) 利用双色DNA四面体纳米结构检测细胞内miRNA-21和miRNA-155[21]。Fig.1 Molecular beacons (MB) used for intracellular imaging: (A) Schematic representation of recognition mechanism for random DNA[15]; (B) Schematic illustration of HQEA strategy for miRNA detection based on Bst polymerase induced strand displacement reaction and a lambda exonuclease-aided recycling reaction[16]; (C) Schematic of cellular uptake, transport and fate of DNA tetrahedral[19]; (D) Dual-color DNA TetrNano for simultaneous detection of intracellular miRNA-21 and miRNA-155[21]
细胞膜带有大量负电荷,通常会将同样带有负电荷的核酸分子屏蔽在膜外,而MB探针是带负电荷的亲水性大分子化合物,因此不能自由地穿过细胞膜的磷脂层。Qiu等[15]利用可细胞内化的核酸适配体和MB探针的杂交结构,开发了一种自输送、光激活的分子信标MB探针,用于实时检测活细胞内miRNA (图1A)。利用标记Cy5荧光基团的核酸适配体AS1411作为载体探针,MB探针可以被高效地输送到指定细胞的细胞质,而其细胞内化的量及其在细胞内的分布均可依据光照射前后Cy5的荧光共振能量转移(FRET)信号变化进行实时跟踪。利用切割反应,有效控制MB探针的检测行为,实现在单细胞体系中检测目标RNA,时空分辨率高。
虽然MB探针非常适合在均质及活细胞体系中检测目标分子,但是MB探针和靶分子DNA以1∶1的比例结合,利用碱基配对作用力对目标分子进行检测,通常检测灵敏度低。为了克服这一技术难题,Duan等[16]设计了一种一步法、超灵敏的二次循环扩增检测方法用于MCF-7细胞系中miR-21和PC3细胞系中miR-221的检测。利用缺刻内切酶、DNA聚合酶和消化酶以及一条改进的分子信标探针,设计了一个双循环反应,实现了靶标分子和信号探针的比例为1∶N2的超灵敏反应策略,通过检测miR-21在乳腺癌组织和正常组织中的表达量,表明该方法可以很好地区分乳腺癌组织及正常组织(图1B)。
传统的DNA探针常用一维(单链DNA)或二维结构(如发夹结构)作为识别元件,其传感界面的均一性在制备过程中难以得到有效控制,影响实际应用中检测的稳定性和重复性。而三维结构的DNA探针具有高结构稳定性和刚性,可以有效提高DNA探针在表面分布排列的均一性,并精确调控探针之间的距离,显著提高对目标分子检测的灵敏度和特异性。自2011年Li等[17]首次利用DNA四面体作为一种纳米尺度的药物载体,将具有免疫刺激效应的CpG寡核苷酸转运进入细胞并刺激产生特定的细胞因子以来,DNA四面体结构在生物传感领域引起广泛关注。传统的单细胞成像技术利用共聚焦荧光显微镜进行表征,而超分辨率荧光显微镜可打破原有的光学远场衍射极限对光学系统极限分辨率的限制,很容易超过光学分辨率的极限,达到纳米级分辨率[18]。该课题组利用超分辨率荧光显微镜技术的这一优点,结合生物化学手段,清晰地展示了一类自组装DNA四面体结构在活细胞中的摄取与转运过程(图1C),并实现在活细胞体系中观察端粒酶的准确位置[19,20]。Zhou等[21]将DNA四面体结构和MB探针的优点结合起来,在DNA四面体结构的两条DNA链中分别标记对不同目标分子具有识别功能的MB探针,并标记不同荧光基团,通过监测不同发射波段的荧光信号变化,实现在单细胞体系中对miRNA-155和miRNA-21的检测(图1D)。而He等[22]利用两个DNA四面体结构之间的链置换反应,催化放大信号, 实现在单细胞体系中检测miRNA。
2.2 单标记核酸荧光探针
2.2.1基于FRET原理检测的单标记核酸荧光探针为了降低荧光探针的设计难度、设计成本并拓宽其应用范围,研究者们利用一些功能纳米材料的独特性质,构建单标记荧光探针[23],基于荧光共振能量转移(FRET)原理,实现对目标分子检测(图2)。

图2 (A) 利用适配体/氧化石墨烯的纳米复合物用于活细胞内分子及体外分子的原位探测过程[26]; (B)在二元体系中检测单细胞内miRNA[30]; (C) 利用AIE荧光探针原位监测细胞内端粒酶活性[34]; (D) 利用双荧光信号探针检测细胞内及细胞提取物中的端粒酶活性[36]Fig.2 (A) Schematic illustration of in vitro and in situ molecular probing in living cells by using aptamer/GO-nS nano complex[26]; (B) Schematic illustration of the binary system for miRNA tracking in the single cells[30]; (C) Schematic illustration of the aggregation-induced emission (AIE)-based in situ telomerase activity detection and imaging[34]; (D) Schematic illustration of double fluorescent signal bioprobe for detection of extracellular and intracellular telomerase activity[36]
基于FRET原理的检测中包括能量受体和能量给体两个部分。在能量受体方面,自2004年Novoselov等[24]发现石墨烯以来,石墨烯由于其独特的结构以及优异的电学、光学、力学和热学等性能,在催化、能源、防腐、电子器件和化学及生物传感等领域有着广泛的应用前景。其中氧化石墨烯由于其良好的分散性、水溶性以及生物相容性而在生物化学传感领域得到了较好的发展。作为一种二维碳纳米材料,石墨烯具有较大的比表面积和较强的荧光淬灭能力,可作为一种有效的生物载体将生物分子运输到细胞内部[25]。基于以上原理,Wang等[26]将标记有FAM荧光基团的核酸适配体和氧化石墨烯(GO)结合,构建纳米复合物,利用细胞的胞吞作用进入细胞内部。核酸适配体结合细胞质中的ATP而脱离GO表面,此时荧光基团FAM远离淬灭基团GO,因此发射荧光,利用激光共聚焦显微镜成像技术实现对细胞质中ATP的可视化成像分析(图2A)。Xing等[27]利用GO能强烈吸附荧光标记的单链DNA(ssDNA)并淬灭其荧光的能力,将GO引入单标记核酸荧光探针检测体系,实现对核酸序列、离子、蛋白质及小分子等目标分子的检测。
除GO外,还有一种功能纳米材料-纳米金在细胞成像中也被广泛应用。纳米金在可见光区有很强的吸收,且生物相容性好,表面易于功能化修饰,是优良的能量受体,同时还可以通过增强荧光分子吸收以及辐射衰减等途径增强荧光发射[28]。Qian等[29]设计一种基于带缺口MB探针构建而成的功能化纳米探针,用于原位检测单细胞内端粒酶活性。MB探针标记有端粒酶引物(TSP),有端粒酶时,端粒酶可引发TSP以重复片段扩增,导致内部链取代和杂交并打开MB探针的发卡结构,此时端粒酶被“点亮”,通过动态监测端粒酶活性在不同剂量与端粒酶活性相关药物作用下的变化,实现在单细胞体系内原位定量检测端粒酶活性并区分肿瘤细胞与正常细胞。该研究方法为端粒酶活性相关的生物学研究、肿瘤的临床诊断和治疗提供了潜在工具。Qian等[30]以纳米金为能量受体,荧光基团Cy5作为能量给体,将不同DNA序列的MB1探针和MB2探针分别标记在纳米金上。分子信标(MB1和MB2)探针的荧光基团和淬灭基团非常临近,所以分子信标(MB1和MB2)探针自身不发射荧光。 miRNA存在时,它和分子信标探针的环状部分结合,打开分子信标(MB1和MB2)探针,使得荧光基团和淬灭基团远离,因此发射荧光。通过监测荧光信号变化,实现在单细胞体系中对miRNA检测,同时纳米金聚集,其最大吸收峰向近红外波段移动,更有利于光热治疗,杀死癌细胞(图2B)。Pan等[31]将标记有Alexa Fluor 488的MB1探针和标记有Cy3的MB2探针同时标记在纳米金上,此时分子信标(MB1和MB2)探针的荧光基团和淬灭基团非常临近,因此分子信标(MB1和MB2)探针不发射荧光。当有Survivn RNA存在时,它和MB1探针的环状部分结合,打开MB1探针,使得荧光基团Alexa Fluor 488远离淬灭基团,因此Alexa Fluor 488发射荧光。当TK1Mrna存在时,它和MB2探针的环状部分结合,打开MB2探针,使得荧光基团Cy3远离淬灭基团,且此时荧光基团Alexa Fluor 488和荧光基团Cy3的距离较近,可有效发生FRET现象,通过监测FRET信号变化,实现在单细胞体系中检测多重mRNA。
在能量给体方面,随着新材料技术的发展,也取得了一些新的突破。传统的荧光染料在高浓度时或聚集状态下,荧光淬灭,即聚集诱导淬灭(ACQ)现象。2001年Tang等[32]发现一类分子在溶液中几乎不发光,而在聚集状态或固态会发出很强的荧光,即聚集诱导发光(AIE)现象,大大拓宽了荧光探针在生化传感领域中的应用范围。与传统的荧光探针相比,AIE探针具有优越的抗漂白能力和更高的可靠性[33]。基于AIE分子的独特发光效应,Zhuang等[34]在端粒酶引物5’端标记淬灭基团,无端粒酶时,引物无法扩增,带有正电荷的AIE分子与核酸分子通过静电作用力结合,形成稳定的复合物,此时AIE分子聚集状态弱,且AIE分子与淬灭基团非常临近,AIE分子的荧光被淬灭; 有端粒酶时,引物以重复片段扩增[35],扩增片段会继续与AIE分子通过静电作用力结合,形成稳定的复合物,此时AIE分子以聚集状态存在,且远离淬灭基团,因此AIE分子发射荧光。通过监测AIE分子荧光信号变化,实现在单细胞体系中检测端粒酶活性(图2C)。在单细胞成像时,该研究方法大大降低了背景荧光信号干扰,增加了检测方法的可靠性。同时,该课题组[36]在端粒酶引物标记淬灭基团可降低背景荧光信号干扰的基础上,还利用最大发射波长为蓝光波段的AIE分子和红光波段的AIE分子彼此之间可产生FRET现象,实现在单细胞体系中检测端粒酶活性,大大拓宽检测范围(图2D)。
2.2.2基于亲疏水作用力检测的单标记核酸荧光探针传统核酸荧光探针在设计和应用时,需要标记荧光基团和辅助基团(淬灭基团或能量匹配基团),另外还需考虑荧光基团的标记位置(末端或内部修饰),增加荧光探针的设计难度及应用成本、降低对生物活性物质检测灵敏度和特异性。利用传统核酸荧光探针进行单细胞成像研究时,需反复洗涤,除去未与目标分子结合的荧光探针,以降低背景信号。该方法操作步骤繁琐,限制了其实际应用。近年来,研究者在开发新型荧光探针时,越来越关注物质的本源特性[37],如吸光性、亲疏水性等物理化学性质,其中亲疏水作用力作为生命活动两大作用力之一,具有响应迅速、特异性识别目标分子能力强、无需额外引入辅助物质等特性,引起研究者关注 (图3)。
图3 (A) 基于端粒酶引物延长和Exo Ⅲ辅助的二次放大策略示意图[40]; (B) 基于DSN酶的催化放大策略和利用AIE功能核酸分子探针检测单细胞体系中汞离子[41]; (C) 利用复合探针CF-DNA的亲疏水可调控性能,检测细胞内端粒酶活性[42]; (D) 基于共轭聚合物的荧光探针CP-DNA,应用于端粒酶活性检测中[43]Fig.3 (A) Schematic illustration of quadratic amplification strategy based on telomerase elongation reaction and Exo Ⅲ-aided reaction[40]; (B) Schematic illustration of DSN enzyme based catalytic amplification analysis of Hg2+ ions in living cells using AIEgens functional nucleic acids probe[41]; (C) Conjugated fluorene-DNA composite probe (CF-DNA) for sensitive detection of telomerase activity in living cells by turning the hydropathical profile of bipolar probes[42]; (D) Conjugated polymers-DNA for sensitive detection of telomerase activity in living cells[43]
Min等[38]利用TPE分子的聚集诱导发光特性,及核酸DNA分子在蛋白酶的作用下的结构可精确调控性能,对TPE分子进行特殊修饰。通过Click反应,将TPE分子与DNA分子共价键结合,构建具有亲疏水可调控性能的单标记核酸荧光探针TPE-DNA。miRNA存在时,miRNA与核酸荧光探针TPE-DNA通过碱基互补配对作用,形成双链结构,利用核酸外切酶Ⅲ识别DNA双链结构的3’凹陷端并将其降解的特性,实现对miRNA的循环检测,进一步调节反应温度,可将检测限降低到10 amol/L。但是TPE分子在紫外光照射下,发射蓝色荧光,在进行单细胞成像研究时,易受生物自体荧光信号干扰。该课题组继而对TPE分子进行特殊修饰,使其在紫外光照射下发射黄色荧光,并将其与DNA共价键结合,形成具有亲疏水性可调控的单标记核酸荧光探针TPEPy-DNA,并利用该探针监测活细胞内miRNA[39]和端粒酶活性[40](图3A)。与传统的单标记核酸荧光探针相比,该探针在进行单细胞成像研究时,具有很好的光稳定性。此外,该课题组[41]还将TPE衍生物与DNA共价键结合,构建具有亲疏水可调控性能的单标记核酸荧光探针AFNAs,Hg2+可特异性识别碱基T,并形成稳定的复合物,通过调控单标记荧光探针AFNAs的聚集状态,实现在单细胞体系内检测Hg2+(图3B)。
Xia课题组根据生物活性物质调控单标记核酸荧光探针的亲疏水性质及聚集状态能力不同,利用共轭聚合物稳定的光电性质及光学信号倍增特性,开发出两种基于共轭芴分子的单标记核酸荧光探针。一种是基于分子量为700共轭芴的单标记核酸荧光探针 (图3C)[42]; 另一种为基于分子量>5000共轭聚合芴的单标记核酸荧光探针 (图3D)[43]。利用这两种具有亲疏水可调控性质的单标记核酸荧光探针所构建的生物/化学传感器,仅靠调控探针的亲疏水性,引起疏水基团“聚集”和“分散”两种状态变化,即可产生相应荧光信号变化,通过监测荧光信号变化,实现在缓冲溶液体系、复杂样本体系中对核酸(DNA、RNA)序列、蛋白质、离子及生物小分子等目标分子的高灵敏、高特异性、高效检测。另外将该探针引入到活细胞体系中,实现了在单细胞体系中端粒酶活性检测。
2.3 基于静电作用力检测的免标记核酸荧光探针
免标记荧光分析法,由于无需对探针进行标记,探针的设计与合成较简单,合成与纯化周期短。Qian等[44]以多孔硅纳米粒子(MSN)为载体,在MSN孔道内共价固定荧光淬灭剂BHQ和填充荧光素,通过静电吸附在其表面包裹含有端粒酶底物片段的DNA链,将荧光素封堵在孔道内。在端粒酶的作用下,端粒酶引物扩增,导致探针扩增产物的两端杂交形成环状结构而脱离MSN表面,从而打开孔道,释放荧光素,此时荧光素远离淬灭剂BHQ,因此发射荧光。通过检测荧光信号变化,实现在细胞内检测端粒酶活性(图4A)。
共轭聚合物由于具有独特的分子线效应、强光捕获以及信号放大的特性,引起研究者们关注[45]。但共轭聚合物为疏水材料,而生物分子通常需在均相水溶液体系中才可保持其生物活性。为将共轭聚合物引入荧光探针检测传感体系,Lv等[46]对共轭聚合物的支链进行特殊修饰,合成出水溶性共轭聚合物。同时利用水溶性共轭聚合物与生物活性分子间的静电作用力,实现在均相水溶液体系中对目标分子检测[47],并成功将该功能纳米材料引入活细胞中,实现在细胞内对目标分子准确、实时、原位监测[48](图4B)。但传统的水溶性共轭聚合物在对细胞内目标分子进行检测时,多使用近紫外或白光光源。每种光的组织穿透性与其波长密切相关,波长越短,组织穿透性越弱,而近紫外及白光的波长范围为200~780 nm, 表明组织穿透能力有限,当深层组织感染细菌的时候,近紫外及白光作光源的光动力疗法将无能为力。Li等[49]将水溶性共轭聚合物与上转换纳米材料结合起来,以980 nm的近红外光作为激发光源,激发上转换纳米材料,继而通过FRET原理激发水溶性共轭聚合物,利用水溶性共轭聚合物产生的单线态氧或活性氧物质达到杀菌目的。
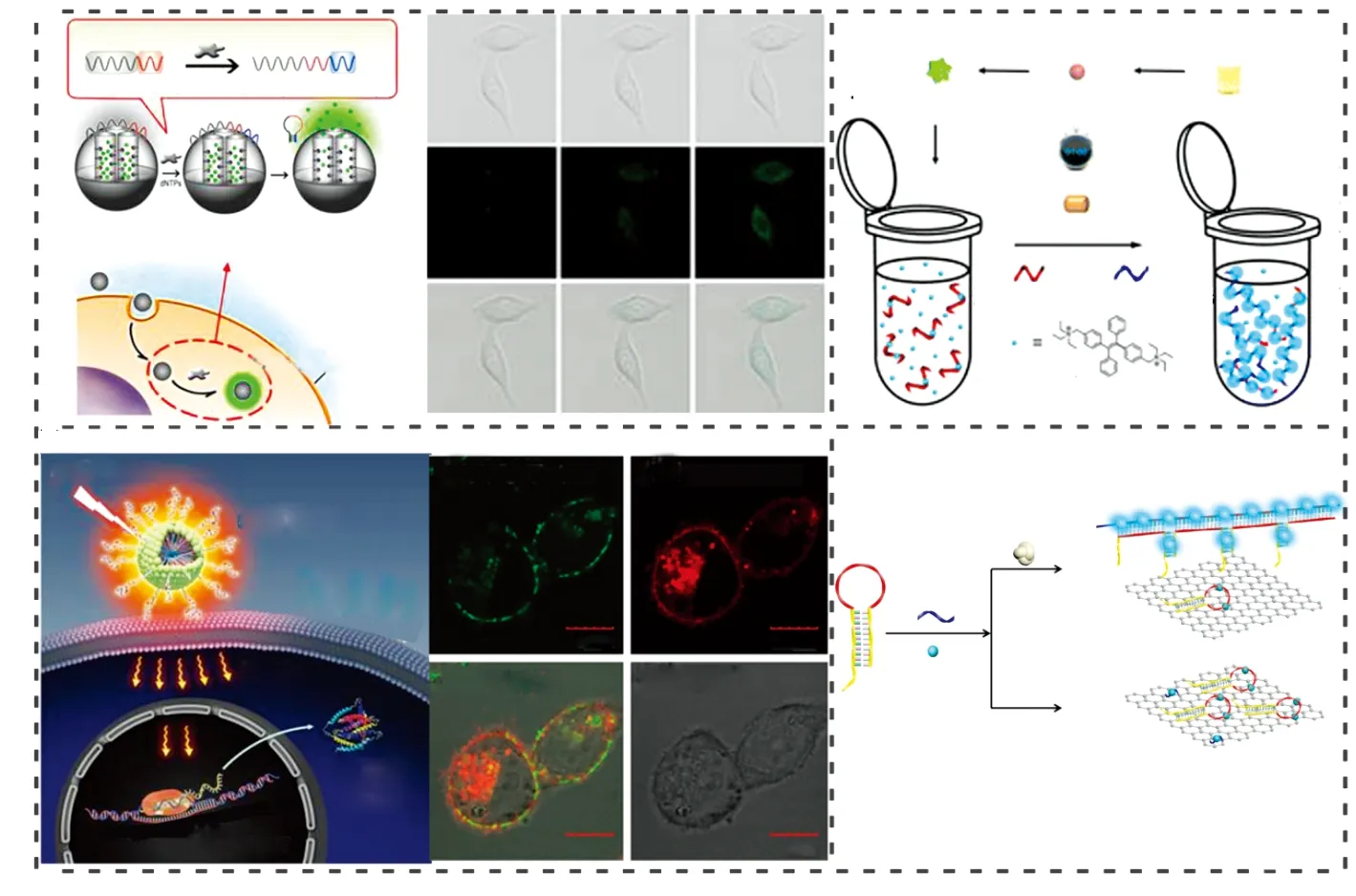
图4 (A) 免标记荧光分析法检测细胞内端粒酶活性[44]; (B) 在近红外光下,利用共轭聚合物微球作为光热转换器,监测活细胞内基因表达状况[48]; (C) 基于AIE分子的免标记法检测细胞提取物中端粒酶活性[50]; (D) 基于氧化石墨烯平台免标记的分子信标探针检测端粒酶活性[51]。Fig.4 (A) Label-free fluorescence assay used for detection of intracellular telomerase activity[44]; (B) strategy to remotely control the gene expression in living cells with CPNs-Tat as photothermal transducer under NIR light[48]; (C) label-free fluorescence assay for telomerase activity [50]; (D) schematic illustration of GO-based platform for telomerase activity detection using label-free beacon[51]
免标记荧光分析法中所用的荧光分子有很多种,其中AIE分子由于其独特的发光体系已经成为了一种强有力的分析工具,被广泛应用于设计高灵敏度和高选择性的“turn-on”型生物荧光探针和生物化学传感器。利用AIE分子的独特发光效应,核酸探针不再需要标记淬灭基团或者辅助基团,一条简单的免标记核酸探针即可高效地完成对目标物的检测,极大地简化了传统核酸探针的结构,降低探针的设计、合成成本及操作难度。基于静电吸引力,Lou等[50]设计了一种基于AIE效应的免标记核酸探针,用于检测单细胞体系和病人组织样本中端粒酶活性。无端粒酶时,端粒酶引物带有大量负电荷与带有正电荷的AIE分子通过静电作用力,形成复合物,此时AIE分子以分散态存在,荧光较弱; 有端粒酶时,端粒酶引物以重复片段扩增,扩增后产物可与大量AIE分子结合,形成复合物,此时AIE分子以聚集状态存在,荧光增强。通过监测AIE分子荧光信号的变化,实现对单细胞体系和病人组织样本中的端粒酶活性检测(图4C)。但是传统的AIE分子,如TPE-Z在紫外光的照射下,呈蓝色荧光,而生物材料的自体荧光也为蓝色,在进行单细胞成像研究时,检测信号易受背景信号干扰,产生假阳性结果。为了降低背景信号干扰,该课题组[51]利用GO吸附单链DNA、解吸附双链DNA的功能,设计一条MB探针,其环状部分可与端粒酶引物扩增片段互补配对。无端粒酶时,MB探针与AIE分子通过静电作用力结合并形成复合物,由于其环状部分为单链DNA,被吸附在GO表面,此时荧光基团AIE分子与GO距离较近,AIE分子的荧光被GO淬灭,因此不发射荧光; 有端粒酶时,端粒酶引物扩增,扩增片段与MB的环状部分通过碱基互补配对作用结合并形成复合物,打开MB探针,并从GO表面解吸附,此状态下,荧光基团AIE分子与GO远离,因此发射荧光。通过监测AIE分子荧光信号变化,实现对病人组织样本中端粒酶活性检测。该方法降低背景荧光信号干扰,提高检测信噪比,大大拓宽癌细胞端粒酶提取物检测的线性范围(图4D)。该课题组[52]还利用调控DNA链的长短调控AIE分子的聚集状态并产生相应荧光信号响应的特性,将线性肿瘤抑制基因p53片段通过连接酶的作用连接成环状DNA,一旦这些环状的p53片段被紫外辐射损伤,滚环扩增反应将不能顺利进行,荧光信号急剧下降,最终实现光损伤的超灵敏检测。该课题组[53]还将AIE分子应用于固体表面检测目标分子,通过调控芯片表面的亲疏水性,实现在固体芯片表面对miRNA高灵敏检测。
3 结 论
荧光分析法具有灵敏度高、无需参比、不受电磁场影响等优点,被广泛应用于细胞成像研究中。目前,新型核酸荧光探针应用于单细胞实时动态成像研究已取得显著成果,但也存在一些问题需,要进一步探索:(1)核酸荧光探针的稳定性及安全性。传统核酸荧光探针,尤其是有机荧光探针,在进行单细胞成像研究时,不稳定、易被漂白、生物毒性大。随着纳米材料的不断发展,功能核酸荧光探针取得了较好的发展,但仍需进一步改进,合成具有更好的生物相容性、更长的体内循环时间、更低的毒性、易代谢的荧光探针,以使核酸荧光探针更好地应用于单细胞成像研究及活体实时动态示踪和临床医学诊断及治疗。(2)近红外核酸荧光探针的制备。虽然在可见光条件下的核酸荧光探针应用于单细胞成像已经得到了一些满意的结果,但由于生物材料对可见光的强烈吸收和散射,使得单细胞成像尤其在活体示踪成像的深度仅局限在10-2m内,更深组织的成像还依赖于近红外荧光探针的发展。
