芹菜根细胞的超微结构与铅形态特征分析
2018-09-12罗立强
柳 检 罗立强
(国家地质实验测试中心, 北京 100037)
1 引 言
细胞是维持植物正常生命活动和功能的基本单元,是植物吸收和运输元素的必经之地,也是植物体内生物化学反应的主要场所。通常,重金属(HMs)能够通过细胞膜上的渗透通道、 ZIP等转运蛋白、 低特异性Ca2+、 Mg2+、 Fe2+和Zn2+等离子通道进入植物细胞,随后对细胞产生植物毒性[1~3]。在细胞水平上,HMs的植物毒性与细胞氧化还原稳态的破坏以及电子传递链的断裂等密切相关[4]。重金属胁迫会刺激叶绿体、 线粒体和过氧化物酶产生氧化应激反应,并过度生产和积累活性氧(ROS),ROS通过损害植物细胞的生物聚合物,进而引起细胞的功能障碍,过量的ROS还会激活质膜的Ca2+、 K+离子通道和膜联蛋白、 催化Ca2+信号传导、 K+渗漏,触发细胞程序性死亡[5]。但另一方面,植物细胞也会采取一些相关的应激机制来抵消HMs毒性。例如,通过在细胞内形成植物螯合肽(PCs)或金属硫蛋白(MTs),使游离的HMs与PCs或MTs形成螯合物,从而将其从敏感位置去除,或将HMs区隔至液泡[6]。因此,从细胞层级上研究毒性元素对其超微结构的破坏和元素形态的转化机制,对于揭示细胞生物过程和解毒与耐受机理具有十分重要的科学价值,这也是当前的研究热点之一。
近年来,植物细胞与重金属相互作用的研究主要聚焦于以下4个方向: (1)植物细胞吸收重金属的共质体吸收途径和细胞间隙的质外体途径[7]; (2)细胞膜上转运重金属的阳离子通道和转运蛋白的表征与鉴定[2,3]; (3)植物细胞对重金属的防御机制,如细胞超微结构改变[8]、 刺激细胞生产活性氧物质[9]等; (4)植物细胞或亚细胞中重金属的分布和形态特征[10,11]。其中,在毒性元素Pb的植物细胞分布和形态研究方面主要有3类报道: 一是Pb与磷酸盐络合,形成磷酸铅或磷氯铅矿沉积在细胞壁[12,13],或与植物螯合肽(PC)络合,以Pb-PC形式区隔于液泡[14]; 二是Pb与纳米羟磷灰石结合沉积于细胞壁和液泡,如水稻根细胞[15]; 三是直接以Pb纳米颗粒(PbNPs)的形式沉积于细胞壁,如在水生蕨类植物的细胞壁中观察到直径为(17.2 ± 4.2) nm的PbNPs[16]。出现这些差异的原因可能是由于植物种类的不同[17]。目前,对植物中Pb的超微结构和形态分析的研究大多集中在野生Pb富集植物,而对可食用植物关注得较少[18,19],尤其是蔬菜[15]。由于Pb以何种形式分布在植物细胞的位置决定了Pb被调动的潜力和产生植物毒性的高低,故开展植物组织和细胞内Pb的分布和形态转化机制的探索,是揭示Pb与植物的作用过程和解毒机理的重要途径。
本研究通过室内水培实验模拟芹菜根对Pb的吸收过程,结合TEM-EDS和XANES技术,观测芹菜根细胞超微结构和细胞内Pb分布,分析芹菜根、 茎和叶中Pb形态特征,从细胞层面上探索毒性元素对其超微结构的破坏和元素形态的转化机制,从而揭示Pb胁迫下的细胞生物过程和解毒与耐受机理。
2 实验部分
2.1 仪器与试剂
X射线吸收近边结构谱仪(XANES, 上海光源15U1); LRH-GSI智能型人工气候箱(韶关市泰宏医疗器械有限公司); 超薄切片机(LEICA UC 6); Hitachi H 9000高分辨透射电子显微镜(日本日立公司)。
Na2HPO4·2H2O (分析纯)、 无水乙醇和丙酮(北京化学试剂研究所); 25% 戊二醛、 1% 锇酸溶液和环氧树脂(北京中镜科仪技术有限公司)。Hoagland培养液所用试剂皆为分析纯。XANES标样: PbO、 PbSO4、 Pb(NO3)2、 Pb3O4、 2PbCO3·Pb(OH)2、 Pb(OH)2、 Pb(Ac)2·3H2O、 PbCO3均为国产分析纯; Pb(C17H35COO)2为国产化学纯; PbS为方铅矿标准样品(GBW07269); Pb(SC16H33)2(美国Sigma公司); C3H9ClPb(德国Ehrenstorfer公司); Pb3(PO4)2和Pb5(PO4)3Cl(实验室合成,并用XRD验证[20]); Pb溶液参考物质由Pb(NO3)2分别与柠檬酸 (10 mmol/L Pb(NO3)2+100 mmol/L 柠檬酸钠,pH 5.4)[21]、 富里酸(FA)(0.05 mol/L Pb(NO3)2+13.35 mg FA)[22]、 腐殖酸(HA)(0.3 mmol/L Pb(NO3)2+1 g/L HA, pH 5)[23]和谷胱甘肽(GSH)(1 mmol/L Pb(NO3)2+5 mmol/L GSH,pH 6)[24]络合。
2.2 植物培养
芹菜(ApiumgraveolensL.)种子购于中国农业科学院作物科学研究所,用0.07% NaClO浸泡30 min,再用蒸馏水冲洗3次后浸种5.5 h。挑选颗粒大小一致的种子置于铺有双层滤纸的培养皿中,保持滤纸湿润,并于培养箱中避光萌芽(温度25℃,湿度50%)。萌芽7 d后见光长苗,待长出一对子叶时,置于1/2 Hoagland营养液(HNS,pH=6.0)中培养,条件为: 25℃,16 h/8 h (光照/黑暗),光照强度4000 Lx。 HNS组成[25]: 1 mmol/L KH2PO4、 5 mmol/L KNO3、 5 mmol/L Ca(NO3)2·4H2O、 2 mmol/L MgSO4·7H2O、 46 μmol/L H3BO3、 6.7 μmol/L MnCl2·4H2O、 0.77 μmol/L ZnSO4·7H2O、 0.32 μmol/L CuSO4·5H2O、 0.11 μmol/L H2MoO4·H2O和20 μmol/L Fe-EDTA。至长出第二片真叶时,移苗至HNS中培养,每株苗用有孔的泡沫固定,使苗保持新芽向上,根浸在HNS中,培养至平均苗长15 cm,期间每3 d更换营养液。挑选长势一致的芹菜进行Pb胁迫实验,用两种方式胁迫培养5 d: 一种用含1000 μg/mL Pb(Pb(NO3)2)的蒸馏水溶液; 另一种用含1000 μg/mL Pb(Pb(NO3)2)的Hoagland营养液。收获的植株根于20 mmol/L EDTA-Na2浸泡15 min,再用自来水、 蒸馏水分别清洗3遍, 分根、 茎和叶3部分冷冻干燥后,用于XANES分析。
用同样的培养方法,将芹菜苗置于300 μg/mL Pb(Pb(NO3)2)的Hoagland营养液中胁迫培养7 d,再用同样的清洗方法洗净根系,用于TEM-EDS分析。
2.3 TEM-EDS分析根细胞中Pb的分布
用双面刀片从根尖处切取2 mm长的根段,离体样品迅速浸入2.5%戊二醛中固定2~4 h,再用0.1 mol/L磷酸盐缓冲溶液洗涤3次,每次20 min,随后转移至1%锇酸中固定过夜。接着用0.1 mol/L磷酸盐缓冲溶液洗涤3次后,用30%、 50%、 70%、 80%和95%乙醇逐级脱水,然后在100%乙醇中脱水3次。 用丙酮置换乙醇3次后,依次用丙酮与树脂2∶1、 1∶1和1∶3比例渗透处理,每次2~3 h,再用纯树脂包埋过夜。放入60℃烘箱聚合24 h后,使用超薄切片机切成60 nm厚的薄片,在高分辨透射电子显微镜下观察、 照相,并进行能谱分析,能谱测量计数时间为30 s,每一个细胞的微区检测至少3次。
2.4 芹菜根、 茎和叶的XANES分析
芹菜的Pb-L3边XANES实验在上海同步辐射BL15U1线站完成。冷冻干燥的芹菜根、 茎和叶研磨至粒径<74 μm,压制成直径为10 mm的样片在常温常压下进行测试。测试前用Pb箔进行Pb-L3边(13035 eV)能量校准。储存环能量为3.5 GeV,环电流为250~260 mA。应用Si(111)双晶单色器获得的能量分辨率为0.05 eV,光路采用K-B镜聚焦,并使用Si漂移探测器检测X射线荧光信号。实验使用的光斑尺寸为300 μm×300 μm,采谱范围为12.985~13.235 keV,能量步长为0.5 eV。标样中Pb含量高,在透射模式下测定,样品中Pb含量较低,在荧光模式下测定。
2.5 XANES谱图的数据处理
采用Athena软件进行数据处理,主要通过未知样品与标准样品的线性拟合获得元素的组分(形态)信息。在线性拟合前,还需进行一些关键的步骤,如能量漂移校正、 标样与未知样的统一归一化、 主成分分析(PCA)、 重建数据和目标转换(TT)等,这些步骤也常被忽略,从而导致拟合的结果差异很大, 从而影响相关的机理阐释。本实验对6个植物样品的Pb L3-XANES谱图进行PCA步骤,发现样品中PCA提取的第一个组分对总体变异的贡献为99.22%, 第二和三组分分别占0.46%和0.24%,而第四组分仅占0.07%,因此植物样品主要由3种成分组成。随后,设置主成分个数,对未知样进行重建数据,并选择Pb标样进行目标转换,通过最大残渣的绝对值(|RMD|)判断含有该标样的可能性。当|RMD|≤5%时, 表明该标样存在的可能性最大; 当5%<|RMD|≤10%时,表明可能存在该标样; 当10%<|RMD|≤15%时,表明存在该标样的可能性不大; 当15%<|RMD|时,表明不可能存在该标样。最后,让未知样与初步判断的标样进行线性拟合,获得每种标样的所占比例,并通过评估因子R-factor 进行评估,R-factor根据公式(1)计算, 其值越小,表明拟合误差越小,结果越准确[26]。
R-factor=∑((y-yfit)2)/∑(y2)
(1)
式中,y为样品归一化后的吸收系数,yfit为标样拟合后的吸收系数。
3 结果与讨论
3.1 芹菜根细胞的超微结构损伤和Pb的分布
Pb胁迫会损伤植物根细胞的细胞壁和质膜结构。利用透射电子显微镜(TEM)观察对照组的根尖细胞,发现细胞壁的表面清晰、 光滑和连续,而且细胞与细胞紧密相连,无细胞间隙(图1A)。当芹菜根暴露于300 μg/mL Pb2+环境中,根尖细胞壁出现了明显的增厚和变形现象,而且质膜也变得粗糙或模糊(图1B、 1C)。同时,Pb胁迫下根尖细胞之间还出现了细胞间隙(图1D),这与Pb暴露下白杨根尖细胞的变化一致[27]。细胞超微结构的变化是由于Pb胁迫使细胞壁中形成了大量的能够结合金属离子的低甲酯化果胶,这种果胶的堆积使细胞壁变厚[27],同时Pb2+与膜蛋白结合使膜蛋白部分变性,从而改变了质膜的结构[28]。
在Pb暴露下,植物会驱使进入细胞内的Pb截留在特殊的细胞结构中。采用TEM观察芹菜根尖细胞中Pb的分布,与对照组(图1A)相比,Pb暴露组(图1B~1D)的根细胞壁有大量晶体状的黑色颗粒沉积,而根细胞质和细胞间隙基本无沉积。利用X射线能谱对比分析黑色颗粒处和细胞间隙中的特征元素,发现黑色颗粒处有Pb的特征峰(图1E),而细胞间隙和细胞质均无(图1F),表明根细胞壁能够截留进入芹菜根细胞的Pb,从而减少Pb进入原生质体,进而降低Pb对植物细胞的毒害。对比图1E和1F,黑色颗粒物中还存在磷元素的特征峰,而且氧元素的峰强度明显高于细胞间隙的元素强度,表明黑色颗粒物中的Pb可能与磷酸盐结合,但形成的Pb形态尚需进一步鉴定。TEM观察到进入植物根部的Pb基本都以沉淀的形式截留在细胞壁,有研究报道Pb污染环境中生长的植物的地上部也有Pb的积累[29],故植物根部应该还存在能被运输至植物地上部的可迁移态铅。
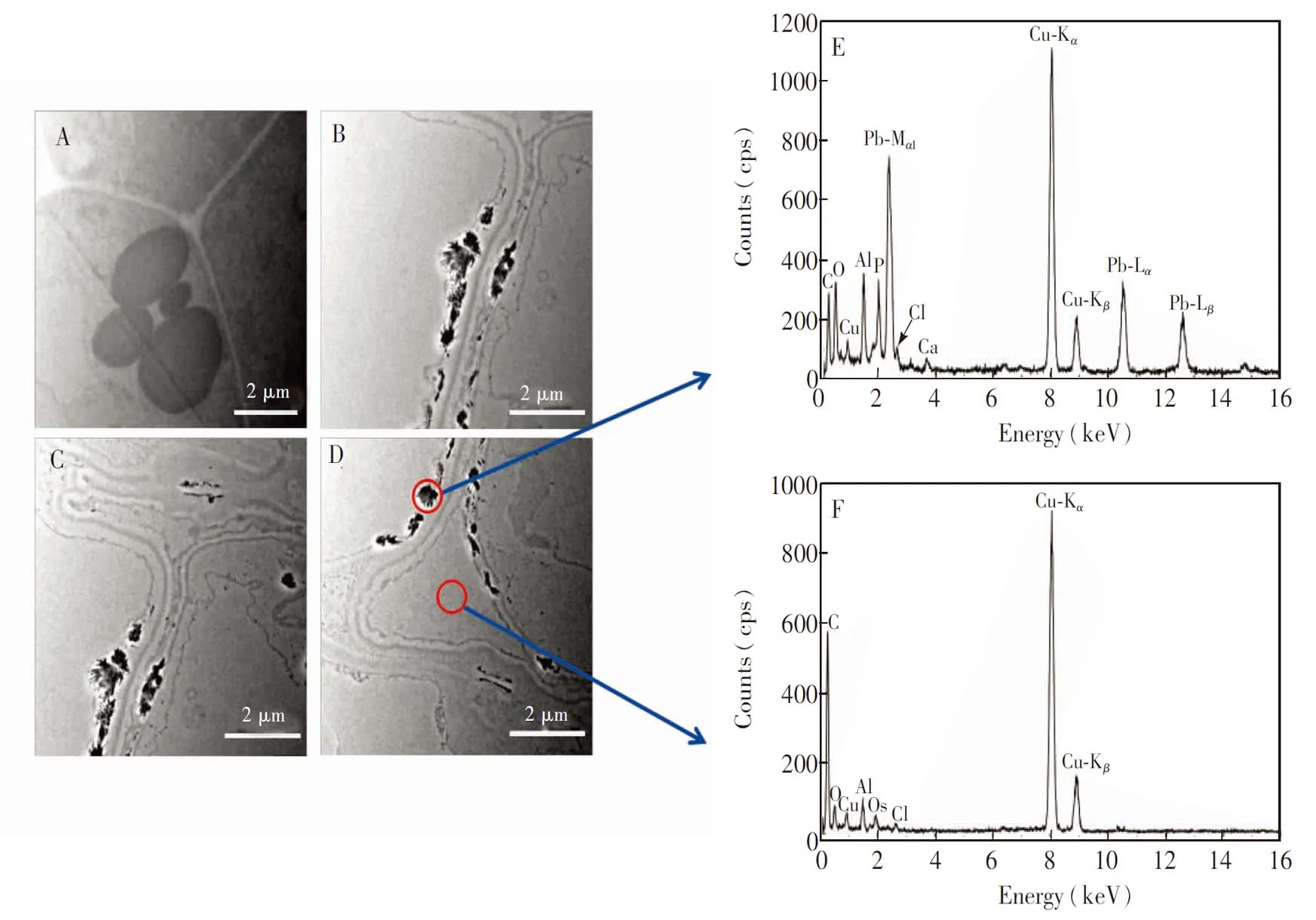
图1 Pb在芹菜根尖细胞壁的沉积: (A)对照组根细胞和 (B-D)Pb暴露组根细胞的透射电镜图; (E) 细胞壁沉积物和(F)细胞间隙的能量色散X射线光谱图Fig.1 Deposition of Pb in the cell wall of celery root tips cells. Transmission electron micrographs of (A) control and (B-D) Pb exposed root cells; (E) and (F)Results of energy dispersive X-ray spectroscopy (EDS) analyses performed at the positions indicated by the red circles
3.2 芹菜根中Pb的形态特征
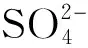
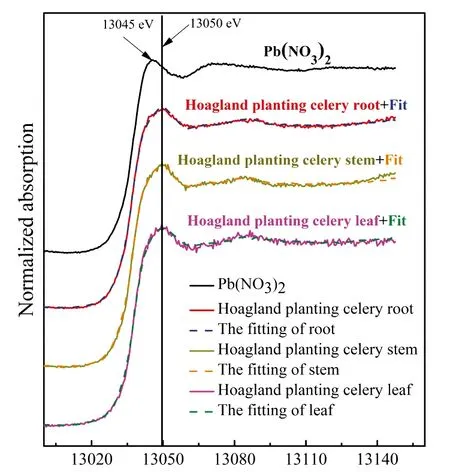
图2 Pb标样对芹菜根、 茎和叶中Pb-L3 XANES谱图的拟合Fig.2 Pb L3-edge X-ray absorption near edge spectra (XANES) of organs of celery, Pb(NO3)2 and their linear combination fitting results (dashed lines)
表1 Pb(NO3)2的营养液培养的芹菜根、 茎和叶中Pb形态的线性拟合结果
Table 1 Linear combination fitting results of root, stem and leaf of celery planting in Hogland nutrient solution with Pb(NO3)2

样品Sample化合物1 Compound 1(%, w/w)化合物2 Compound 2(%, w/w)化合物3 Compound 3(%, w/w)评估因子R-factor根 RootPb5(PO4)3Cl62.7Pb(Ac)2·3H2O37.3-0.000084茎 StemPb5(PO4)3Cl65.6Pb(Ac)2·3H2O34.4-0.000129叶 LeafPb(C17H35COO)247.8Pb5 (PO4) 3Cl36.7Pb(Ac)2·3H2O15.50.000212
3.3 芹菜茎和叶中Pb的形态特征
芹菜茎中Pb的形态与根部基本相似。XANES拟合结果显示,茎中Pb形态也主要为Pb5(PO4)3Cl,其次是Pb(Ac)2·3H2O(表1),表明Pb从根部迁移至茎部未发生形态的转化。茎中鉴定出的两种Pb形态,其中磷氯铅矿的溶解度比其它铅矿物至少低44个数量级[32],而只有Pb(Ac)2·3H2O能够被植物调动。这是由于醋酸是含有一个羧基的低分子有机酸,其与Pb结合形成的络合物易于在植物体内迁移[33]。在大多数植物中也发现了Pb-Ac络合物,如田菁[34]、 小麦[35]和拟南芥[36],表明可迁移的Pb-Ac是植物向地上部运输Pb的主要形式。
芹菜叶对Pb形态的转化功能与其它器官(茎、 根)不同。Pb-Ac络合物经茎部运输至叶片后,其形态发生了转化。芹菜叶片中Pb主要以Pb(C17H35COO)2的形式存在,其比例为47.8%,其次是36.7% Pb5(PO4)3Cl和15.5% Pb(Ac)2·3H2O(表1)。XANES形态的准确识别强烈依赖标样,虽然本研究选用了18种Pb标样,但植物样品比较复杂,使植物中大分子有机铅的准确鉴定仍存在困难。本结果初步表明,Pb-Ac络合物转运至叶片后,在叶片中转化为分子量较大的有机铅积累。据报道,植物体内带负电的羧基官能团通过螯合作用与游离的Pb结合后,形成的大分子有机铅是植物对Pb的一种积累和耐受机制[37]。有研究发现,在玉米根中也存在Pb(C17H35COO)2[38]。除了大分子有机酸铅外,Pb5(PO4)3Cl也是生物学上重要的化合物,它是一种极稳定的磷酸盐化合物(Ksp=10——84.4)[39],植物体内这种稳定的难溶物能够去除可迁移性的Pb,从而提高植物对Pb的耐受性[24]。因此,大分子有机铅和Pb-磷酸盐应是植物叶片贮存和耐受Pb的机制。
3.4 植物中Pb-磷酸盐的来源及形成机制
Pb是植物非必需元素,植物体内无专一运输Pb的膜转运蛋白质[40]。毒性元素可通过磷酸盐转运蛋白(Pi)吸收进入植物,如As(Ⅴ)[41]。由上可知,芹菜根、 茎和叶中均形成了Pb-磷酸盐(Pb5(PO4)3Cl),而且Pb-磷酸盐也是土壤中Pb的主要存在形态之一[39]。为探究芹菜中的Pb-磷酸盐是根际环境中Pb-P结合后依靠Pi进入植物的,还是根际Pb2+被根吸收后在植物体内转化成Pb5(PO4)3Cl,将芹菜暴露于Pb(NO3)2的水溶液中培养,鉴定植物体内是否有形成Pb-磷酸盐。如表2所示,在无P的根际环境中,Pb2+被芹菜吸收后,在根、 茎和叶中均有形成Pb5(PO4)3Cl,表明芹菜体内的Pb5(PO4)3Cl来源于植物自身的生物合成,而不是来源于外界根际环境。植物中Pb3(PO4)2的形成是一种植物响应外界Pb胁迫的解毒机制,其来源为Pb与细胞中多磷酸酯酶释放的磷酸盐形成的共沉淀[42],但是植物中Pb5(PO4)3Cl的形成是受解毒机制驱动或者是Pb、 P和Cl局部过饱和的结果[24],目前尚不清楚。
表2 Pb(NO3)2的蒸馏水溶液培养的芹菜根、 茎和叶中Pb形态的线性拟合结果
Table 2 Linear combination fitting results of root, stem and leaf of celery planting in distilled water solution with Pb(NO3)2

样品Sample化合物1Compound 1 (%, w/w)化合物2Compound 2 (%, w/w)化合物3Compound 3 (%, w/w)评估因子R-factor根 RootPb(C17H35COO)273.5Pb5(PO4)3Cl19.1Pb(Ac)2·3H2O7.40.000079茎 StemPb5(PO4)3Cl69.3Pb(Ac)2·3H2O30.7-0.000120叶 LeafPb5(PO4)3Cl50.7Pb(Ac)2·3H2O25.0Pb(C17H35COO)224.30.000157
4 结 论
本研究采用TEM-EDS和XANES分析技术,考察了芹菜根细胞内Pb的分布特征和植物体内Pb形态转化过程,揭示了可食用蔬菜与Pb作用的细胞机制及Pb的吸收和转运过程。研究发现,Pb胁迫会使芹菜根细胞壁明显增厚和变形,而且质膜也会变得粗糙或模糊,同时进入细胞的Pb能够以晶体状的Pb-磷酸盐沉积在细胞壁,以实现Pb的解毒和耐受。芹菜从根际微域吸收Pb的过程中,Pb形态发生了显著地的改变,植物能够将培养液中的无机铅转化为有机铅形态,进入根部的Pb主要以Pb5(PO4)3Cl的形式沉积于细胞壁,仅少部分Pb以Pb-Ac形式向地上部运输,至茎中以Pb5(PO4)3Cl的形式沉积,叶片以Pb(C17H35COO)2和Pb5(PO4)3Cl的形式储存,这揭示了芹菜对Pb的吸收、 转运和贮存机制,为准确评估食用蔬菜的健康风险提供了理论支撑。由于生物体的环境复杂,准确鉴定Pb形态还依赖合适的标样,故还需寻找更多的标样。关于植物对Pb的作用机理,未来还需借助其它分析手段在细胞层面探索植物细胞壁沉积Pb5(PO4)3Cl的形成机制。
致谢感谢上海光源14W1和BL15U1线站的黄宇营和李爱国老师在元素形态分析方面给予的指导与帮助; 感谢国家地质实验测试中心的沈亚婷老师、 曾远和孙晓艳在实验中给予的帮助。
