全杜仲胶囊对肾阳虚小鼠抗应激能力的影响及机制研究❋
2018-09-12王慧玲陈兰英周祎寒罗颖颖崔亚茹袁金凤李雪亮官紫祎
王慧玲,陈兰英,周祎寒,罗颖颖,崔亚茹,袁金凤,张 妮,李雪亮,官紫祎
(江西中医药大学中药固体制剂制造技术国家工程研究中心,南昌 330006)
杜仲科植物杜仲(EucommiaulmoidesOliv.)作为中药在我国已有2000多年的药用历史,中药著名古籍《神农本草经》中有记载:“杜仲,味辛平。主腰脊痛,补中,益精气,坚精骨,强志,除阴下痒湿,小便余沥。久服轻身耐老。[1]”全杜仲胶囊在2015版《中国药典》[2]也有记载:“补肝肾,强筋骨,降血压。用于肾虚腰痛,腰膝无力,高血压见上述症状者。”《素问·生气通天论》中“藏精而起亟”理论(肾藏先后天诸精,藏精而起亟,能应激、能应变、能调节,以适应外在变化),强调肾有调节机体与外界相适应、相平衡的作用,具有维护机体健康的功能,这表明杜仲的补肾作用也可能会体现在提高抗应激能力上。
目前关于杜仲提高抗应激能力的研究文献较少,且其提高抗应激能力作用机制也大多体现在提高抗氧化能力和促进胶原蛋白合成两方面,而关于抗应激能力是否与机体的能量代谢和免疫功能有关的研究则很少。肌肉注射氢化可的松是目前最常用的肾阳虚模型,该模型主要用于中药温肾壮阳功效的评价[3-5]。因此,本文通过肌肉注射氢化可的松复制肾阳虚小鼠模型,探讨全杜仲胶囊作为补肾中药对肾阳虚小鼠抗应激能力的影响及其与机体能量代谢和免疫功能相关的作用机制。
1 材料
1.1 实验动物
SPF级雄性KM小鼠314只,体质量16~18 g,购自湖南斯莱克景达实验动物有限公司(动物合格证号SCXK (湘)2016-0002),适应性饲养4 d,自由饮食。本研究获得江西中医药大学实验动物伦理委员会批准(SYXK (赣)2012-0005)。
1.2 药物与试剂
全杜仲胶囊为棕褐色粉末状,0.48 g粉末相当于原生药量的2.5 g,由江西普正制药有限公司提供(批号20140401);氢化可的松注射液(天津金耀药业有限公司,5 ml,25 mg,国药准字H12020886);0.5%羧甲基纤维素钠溶液(CMC-Na);生理盐水(0.9%氯化钠注射液);盐酸普萘洛尔片(山西云鹏制药有限公司,10 mg/片,国药准字H14020768);右归丸(购自河南宛西制药有限公司,每10丸重1.8 g,批号130802);小鼠cAMP ELISA试剂盒(北京华英生物技术研究所,批号20150301);小鼠cGMP ELISA试剂盒(北京华英生物技术研究所,批号20150301);超微量ATP酶试剂盒(南京凯基生物科技发展有限公司)。
1.3 主要仪器
MORRIS水迷宫恒温游泳池(淮北正华生物仪器设备有限公司),BS124S 型分析天平(美国Sartorius 公司),TDL-5C型低速台式大容量离心机(上海安亭科学仪器厂),Gallios流式细胞仪(BECKMAN COULTER)。
2 方法
2.1 药物的配制
全杜仲胶囊溶液的配制:临用时称取一定量的全杜仲粉末,加入适量0.5%CMC-Na溶液,研磨、混匀混悬,分别配制成全杜仲高(0.090 g/ml)、中(0.045 g/ml)、低(0.022 g/ml)浓度溶液。盐酸普萘洛尔溶液的配制:临用时取一定量研磨成粉,加入适量0.5% CMC-Na溶液,研磨、混匀配制成1 mg/ml的混悬液;右归丸溶液的配制:取一定量的右归丸研磨成粉,加入适量0.5%CMC-Na溶液,研磨、混匀、配制成0.3 g/ml的混悬液。所有药物溶液均4 ℃避光保存、备用。
2.2 模型建立、分组及给药
按随机数字表法将小鼠分为空白组、模型组、阳性药物组(普萘洛尔组20 mg/kg,右归丸组4.05 g/kg)及全杜仲高剂量组(1.80 g/kg)、全杜仲中剂量组(0.90 g/kg)、全杜仲低剂量组(0.45 g/kg)。模型组及药物组按25 mg/kg剂量后肢肌肉注射氢化可的松注射液,每天1次,连续10 d[5-7],空白组注射无菌生理盐水。造模1 h后,药物组按0.2 ml/10 g灌胃对应药物,空白组和模型组按0.2 ml/10 g灌胃0.5%CMC-Na溶液,所有小鼠均自由摄食饮水,每天1次,连续10 d。
2.3 一般情况观察
实验期间观察各组小鼠的精神状态、活动情况以及二便等变化情况,并记录各组小鼠体质量、饮水量以及进食量的变化情况。
2.4 抗应激能力(耐寒死亡率、耐缺氧时间及耐疲劳时间)[8-9]检测
2.4.1 耐寒死亡率检测 于末次给药1 h后,分别将小鼠放入-20 ℃的冰箱内,于40 min后每隔5 min观察小鼠存活情况,记录2.5 h内各组小鼠存活数并计算存活率,阳性药物为右归丸。
2.4.2 耐缺氧时间测定 于末次给药1 h后,将小鼠放入盛有5 g石灰、容积为250 ml的广口瓶中,每瓶1只,凡士林封住瓶口后立即计时,记录小鼠入瓶至呼吸停止的时间,即为耐缺氧存活时间,阳性药物为盐酸普萘洛尔。
2.4.3 耐疲劳时间测定 于末次给药1 h后,于小鼠尾部系以质量为小鼠体质量5%的重物放入水深30 cm、温度(25.0±1.0)℃的浴槽中游泳,以小鼠头部沉入水中10 s不能浮出水面者为体力耗竭,记录耗竭时间(min)即为小鼠耐疲劳时间。
2.5 血清cAMP/cGMP测定
小鼠取材前1 d晚上,动物禁食不禁水过夜,眼眶取血1~2 mL,静置30 min后于3000 r/min离心10 min取血清,分装后置于-80 ℃保存。测定前取血清,待解冻后分别按小鼠cAMP ELISA试剂盒和cGMP ELISA试剂盒说明书测定血清中cAMP、cGMP含量,再计算cAMP/cGMP比值[10]。
2.6 肝脏Na+-K+-ATP酶活性测定
肝组织中Na+-K+-ATP酶活性测定:颈椎脱臼处死动物,迅速取出肝脏放入预冷至4 ℃生理盐水中,洗去表面血迹,滤纸洗掉表面水分,称重分装后于-80 ℃保存。临用前称取肝组织0.3 g,加生理盐水制成10%的肝匀浆,3000 r/min离心15 min,按试剂盒说明方法测定肝组织中蛋白含量和Na+-K+-ATP酶的含量,按公式计算Na+-K+-ATP酶活性。
2.7 脾脏T淋巴细胞CD4+/CD8+测定
处死动物后迅速取出脾脏,PBS稍加冲洗放入70um尼龙膜过滤器中,置于装有4 ml淋巴细胞分离液的培养皿中,用注射器活塞轻轻按压脾脏直至细胞基本释放,只剩脾脏包膜。立即收集培养皿中的细胞悬液于10 ml离心管中,加入500 μl 1640培养基,2200rpm离心30 min,吸取下层白色细胞层于新的离心管中,加入3 ml的1640培养基混匀,1200rpm离心10 min弃上清,再加入1 ml 1640培养基混匀、计数。取约106细胞于流式管,分别加入CD4+-FITC、CD8+-PE抗体各5ul,室温避光孵育30 min,加入2 ml PBS,2000rpm离心5 min弃上清,再加入200ul PBS混匀,流式细胞仪检测。检测各组T淋巴细胞CD4+、CD8+百分比,并计算CD4+/CD8+。
2.8 统计学方法

3 结果
3.1 一般情况观察
实验过程中,空白组小鼠精神状态良好,活动量及大便质地正常,体质量、饮水量和进食量平稳;模型组小鼠出现喜扎堆、反应迟钝、少动、眯眼、大便溏稀、体质量下降、饮水量与进食量减少;全杜仲胶囊各剂量组小鼠精神状态良好,活动量及大便质地优于模型组但不及空白组,体质量、饮水量和进食量有所增加。
3.2 抗应激能力(耐寒死亡率、耐缺氧时间及耐疲劳时间)
3.2.1 全杜仲胶囊可降低耐寒死亡率 表1显示,模型组小鼠的耐寒死亡率较空白组小鼠极显著性升高(P<0.01);全杜仲低剂量组小鼠的耐寒死亡率较模型组显著性降低(P<0.05),右归丸组以及全杜仲高、中剂量组小鼠耐寒死亡率较模型组具有降低的趋势,但差异无统计学意义(P>0.05)。
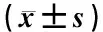
表1 全杜仲胶囊对肾阳虚模型小鼠耐寒死亡率的影响
3.2.2 全杜仲胶囊可延长耐缺氧时间及耐疲劳时间 表2显示,模型组小鼠的耐缺氧时间较空白组显著性减少(P<0.05);盐酸普萘洛尔组小鼠耐缺氧时间较模型组极显著性增加(P<0.01),全杜仲各剂量组小鼠耐缺氧时间较模型组均显著性增加(P<0.05)。分析比较各组小鼠的耐疲劳时间发现,模型组显著低于空白组(P<0.05),全杜仲中剂量组小鼠耐疲劳时间较模型组显著性增加(P<0.05),右归丸组以及全杜仲高、低剂量组小鼠耐疲劳时间都有所增加,但差异无统计学意义(P>0.05)。
3.3 全杜仲胶囊可升高血清cAMP/cGMP和肝脏Na+-K+-ATP酶活性
表3显示,模型组小鼠cAMP/cGMP较空白组显著性降低(P<0.05),全杜仲各剂量组cAMP/GMP较模型组均有显著性升高(P<0.05)。分析各组小鼠肝脏Na+-K+-ATP酶活性发现,模型组小鼠肝脏Na+-K+-ATP酶活性较空白组显著降低(P<0.05),全杜仲高、中剂量组小鼠肝脏Na+-K+-ATP酶活性较模型组显著性升高(P<0.05),全杜仲低剂量组小鼠肝脏Na+-K+-ATP酶活性较模型组具有升高趋势,但差异无统计学意义(P>0.05)。
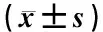
表2 全杜仲胶囊对肾阳虚模型小鼠耐缺氧时间及耐疲劳的影响

表3 全杜仲胶囊对肾阳虚小鼠血清cAMP/cGMP和肝脏Na+-K+-ATP酶活性的影响
3.4 全杜仲胶囊可升高脾脏淋巴细胞CD4+/CD8+
表4和图1显示,经流式细胞仪分析,模型组小鼠脾脏淋巴细胞CD4+/CD8+较空白组极显著性降低(P<0.01),全杜仲低剂量小鼠脾脏淋巴细胞CD4+/CD8+较模型组显著升高(P<0.05),全杜仲高、中剂量小鼠脾脏淋巴细胞CD4+/CD8+较模型组具有升高的趋势,但差异无统计学意义(P>0.05)。
4 讨论
氢化可的松复制肾阳虚动物模型的造模机理是用一定剂量的外源性糖皮质激素使垂体前叶释放的促肾上腺皮质激素(ACTH)受抑制,转而使肾上腺皮质分泌类固醇激素减少,使动物出现一系列“耗竭”现象。而且环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)也与中医的阴阳学说有关,阴虚时血清cAMP含量上升、cAMP/cGMP升高,阳虚时cGMP含量上升、cAMP/cGMP降低。实验中模型组小鼠不仅出现一系列肾阳虚动物体征,即喜扎堆、反应迟钝、少动、眯眼、大便溏稀、体质量下降、饮水量与进食量减少;还表现为血清cGMP含量显著上升,cAMP/cGMP显著降低,与文献报道肾阳虚结果一致。且研究发现,肾阳虚动物的抗应激能力减弱[11-12],抗应激能力反映了机体对不利环境的适应能力,抗应激实验一般以小鼠为研究对象,观察各种有害刺激(包括寒冷、缺氧、负重游泳)对小鼠生存时间的影响。本实验中,肾阳虚模型组小鼠的抗应激能力减弱,表现为耐寒死亡率显著升高,耐缺氧时间和耐疲劳负重游泳持续时间显著缩短,全杜仲胶囊可显著提高肾阳虚小鼠的抗应激能力,使其耐寒死亡率显著降低,耐缺氧时间和耐疲劳时间明显延长。

表4 全杜仲胶囊对肾阳虚小鼠脾脏淋巴细胞CD4+/CD8+的影响

图1 流式细胞仪分析各组脾脏淋巴细胞CD4+/CD8+T细胞的比例
抗应激能力与机体的能量代谢、免疫功能等因素有关[13-16]。其中ATP作为机体共有的能量供体与能量代谢密切相关,免疫功能与免疫细胞的功能密切相关。当ATP的生成和水解处于紊乱低下状态以及免疫细胞功能降低时,机体的抗应激能力也减弱。
能量代谢包括能量的生成和能量的水解两部分。ATP的生成与cAMP和cGMP有关,且cAMP与cGMP通常呈拮抗性地共同参与细胞反应的调节,cAMP可使ATP生成增多[10,17],cGMP则使ATP生成减少,cAMP/cGMP升高表示ATP生成增多,cAMP/cGMP降低表示ATP生成减少。ATP水解与Na+-K+ATP酶有关,Na+-K+ATP酶即Na+-K+泵,是广泛存在于细胞膜上的一种蛋白酶,可催化ATP水解,每水解一个ATP释放的能量输送3个Na+到胞外,同时摄取2个K+入胞。Na+泵活动造成的细胞内高K+环境,为胞质内许多代谢反应创造必备条件,同时Na+泵活动建立的膜内外Na+浓度梯度为继发性主动转运提供势能贮备。Na+-K+ATP酶的活性与其水解ATP的能力、释放的能量和转运Na+、K+的能力成正比。当Na+-K+ATP酶的活性降低时,水解的ATP减少,释放的能量也减少,使其转运Na+、K+的能力也降低,细胞乃至机体的许多代谢反应也减慢,进而影响正常的生命活动[18-19]。可见,机体的能量代谢与cAMP含量、cGMP含量、cAMP/cGMP比值和Na+-K+-ATP酶活性密切相关。
本实验中,选取cAMP含量、cGMP含量、cAMP/cGMP比值和Na+-K+-ATP酶活性这些指标来反映机体的能量代谢情况。造模后,与空白组比较,肾阳虚模型组小鼠血清cGMP含量显著升高,血清cAMP/cGMP比值和Na+-K+-ATP酶活性的显著降低,提示其ATP的生成和水解均显著减少,能量代谢处于紊乱低下状态。给予全杜仲胶囊后,血清cGMP含量显著降低,cAMP/cGMP比值和肝脏Na+-K+-ATP酶活性显著升高,提示ATP的生成和水解均显著增加,说明全杜仲胶囊可通过改善机体的能量代谢的紊乱低下状态,提高肾阳虚小鼠的抗应激能力。
免疫功能与免疫细胞的功能密切相关,其中CD4+T/CD8+T是成熟T淋巴细胞的2种亚群,它们具有不同的表面标记和功能。CD4+T细胞识别MHC-II类分子所提呈的外源性抗原肽,活化后主要分化为Th(辅助性T细胞),CD8+T细胞识别MHC-I类分子所提呈的外源性抗原肽,活化后主要分化为CTL(细胞毒性T细胞)。健康宿主中正常的CD4+/CD8+比值定义不明确,因为性别、年龄、种族、遗传、暴露和感染都可能影响其比例,但CD4+/CD8+比值低或反转是一种免疫风险表型。临床发现,CD4+/CD8+比值随着年龄的增长而降低,这与人群的免疫功能降低、免疫衰老有关[20-21]。
本实验中,选取小鼠脾脏T淋巴细胞CD4+/CD8+比值反映其免疫功能情况。造模后,与空白组比较,肾阳虚模型组小鼠脾脏T淋巴细胞CD4+/CD8+比值显著下降,提示其免疫功能下降。给予全杜仲胶囊后,脾脏T淋巴细胞CD4+/CD8+比值显著升高,说明全杜仲胶囊可通过增强机体的免疫功能提高肾阳虚小鼠的抗应激能力,与文献报道的杜仲具有提高免疫功能[22]的结果相一致。
综上所述,全杜仲胶囊不仅可通过降低血清cGMP含量、升高cAMP/cGMP比值、增强肝脏Na+-K+-ATP酶活性来改善机体的能量代谢紊乱低下状态,还可通过升高脾脏T淋巴细胞CD4+/CD8+比值来增强机体的免疫功能,进而发挥提高肾阳虚小鼠抗应激能力的作用。
