小小化学式 蕴含大文章
2018-09-11周家城
周家城
(古田县第一中学,福建 古田 352 2 0 0)
以下是化学式的自我表白:我是一个不显眼的小式子,化学学习的常用工具,是用元素符号与数字的组合表示物质组成的式子。顾名思义,我有许多定性知识与定量关系的文章可做。比如,我有两种宏观的定性描述:一是我叫什么物质;二是我由什么元素组成的。我还有多种微观的定量说法:若是由分子构成的物质则表示什么分子且该分子的原子数之比是多少;若是由离子或原子构成的物质则表示微粒(离子或原子)数比是多少。这些都是学生认识我并入门学化学的最起码要求,也正是学生必需具有的学科素养之一:宏观视野、微观分析和符号表征能力。[1]到了高中阶段,有了物质的量这一物理量,我的身价倍增,内涵更深刻,定量功能更丰富,化学学习中宏观与微观的结合与转化,我最靠谱,请多关注我的价值。
一、我是变形金刚,行家看我显神通
案例1已知固体PbO2能氧化浓盐酸并生成Cl2,加热分解生成+2价和+4价铅的混合氧化物。现加热一定量PbO2得到a mol氧气,再将剩余固体投入到足量浓盐酸中得到b mol氯气,若a:b=3:2,则剩余固体中各组成物质的量比是( )[2](双选)
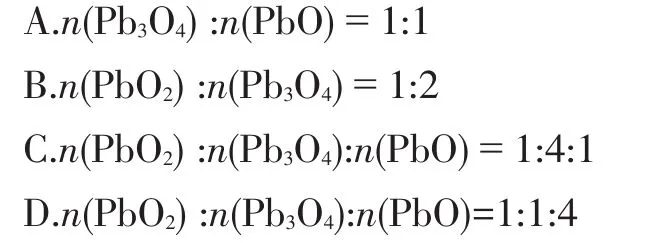
化学式拆分变形解题:题设剩余固体的组成是+2价PbO与未分解的+4价PbO2混合。根据Pb原子与O原子守恒思想,Pb3O4挺身而出:我是变形金刚,可变形为2PbO·PbO2。据此,减少了各选项分析Pb3O4的麻烦。O2和 Cl2的物质的量之比为 3:2,设 O2为3 mol,Cl2为 2 mol,由 PbO2→PbO+1/2O2知:生成 3 mol O2时,同时生成6 mol PbO;由电子守恒知:生成2 mol Cl2时,剩余固体中就含有2 mol PbO2,故剩余固体中n(PbO):n(PbO2)=6:2=3:1。通过对各选项化学式拆分变形求得:选项A、D正确。
常规解题:设原 PbO2为 1 mol,紧扣 O2和 Cl2的物质的量之比为3:2,再设O2为3a mol,Cl2为2a mol,由电子守恒知:3a×4+2a×2=1×2,a=0.125,n(O2)=0.375 mol;由原子守恒知:原PbO2为1 mol,剩余固体中n(Pb):n(O)=1:(2-2×0.375)=4:5。由各选项化学式及物质的量比知:满足要求的选项为A、D。
创新解题:题设为双选题,四选项均为Pb的混合氧化物,根据各化学式知Pb与O原子数比依次为:4:5、7:10、14:19、4:5,相同比值的A、D选项即为正确答案。
自我评价:常规解题绕弯、抽象且计算复杂,部分学生不易理解。化学式变形解题神通广大:思路清晰且顺理;直观易懂不抽象;算法简单不易错。创新解题则抓住命制双选题有两个答案且要一致的特点,结合化学式直入微观世界口算Pb与O原子数比相同的选项快准突破。不论哪一种解题方法,都离不开化学式中的定量关系,全面挖掘,快捷解题。
案例2往物质的量浓度相等的KCl溶液、ZnCl2溶液、AlCl3溶液中分别滴加相同浓度的AgNO3溶液,当Cl-恰好沉淀完全时,消耗AgNO3溶液的体积比为3:2:1,则 KCl溶液、ZnCl2溶液、AlCl3溶液的体积比是____。
化学式定量变形解题:AgNO3溶液分别与KCl、ZnCl2、AlCl3溶液反应均生成 AgCl,由 n(Ag+)=n(Cl-)知:KCl、ZnCl2、AlCl3溶液中n(Cl-)比为3:2:1时,三种氯化物的化学式只需变形为 3KCl、ZnCl2、1/3AlCl3,即3:1:1/3=9:3:1,这就是三种溶液的体积比。
自我评价:扣准离子反应的本质,深入化学式的微观世界,解题思路一目了然。
二、我是多面手,聪明能干有杰作
案例3往一定量水中投入W1g钠和铝的混合物,充分反应,金属完全溶解,得到澄清透明溶液并收集到V1L标准状况下的气体。再往所得溶液滴加a mol·L-1的盐酸,滴加过程中,先产生白色沉淀然后沉淀又溶解,当沉淀恰好消失时所加盐酸体积为V2L,再将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是( )[3]
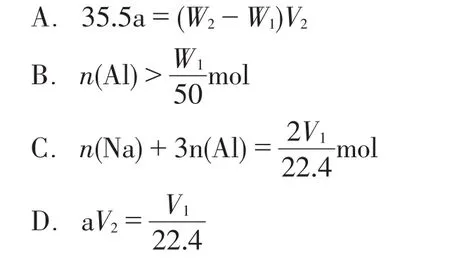
众多化学式解题:依题意知m(Na、Al)=W1g,m(NaCl、AlCl3)=W2g,由金属与金属氯化物的化学式知:m(Cl)=(W2-W1)g=aV2×35.5 g,选项A错。Na、Al与水充分反应得到的澄清溶液可能是NaAlO2溶液,也可能是NaAlO与NaOH混合溶液,若澄清溶液是NaAlO2溶液时,其化学式暗示Na与Al微粒数之比为1:1推知,n(Na)=n(Al),n(Na)×23 g·mol-1+n(Al)×27 g·mol-1=W1g,得n(Al)=W1/50 mol,但也可能是 NaAlO2与NaOH混合溶液,故n(Al)≤W1/50 mol,选项B错。由电子守恒知:n(Na)×1+n(Al)×3=(V1/22.4)×2,选项C正确。根据 NaCl、AlCl3、HCl三个化学式知 Cl-守恒:aV2=n(Na)×1+n(Al)×3=(V1/22.4)×2,选项D错。正确答案为C。
自我评价:关注宏微转化,弄清微粒间互相反应的来龙去脉,题设的众多化学式倾巢而出,定量关系巧妙转换,简化复杂问题,化解难题,巧得各量。
案例4.将Cu2S投入到一定浓度的HNO3溶液,反应生成 CuSO4、Cu(NO3)2、NO、NO2和 H2O。若n(NO):n(NO2)=3:1时,求参加反应的Cu2S与HNO3的物质的量比为_________。
始态化学式解题:将始态化学式Cu2S设为1 mol,推知CuSO4与Cu(NO3)2的物质的量比为1:1,且分别为1 mol,参与反应并体现酸性的硝酸为2 mol;由n(NO):n(NO2)=3:1,可将两种氮氧化物合并为N4O5,则还原产物中氮元素化合价为+2.5价,再根据始态化学式HNO3与电子守恒可求出参与反应且体现氧化性的硝酸的物质的量,n(Cu2S)× (1×2+8)=n(HNO3)× (5-2.5),n(HNO3)=4 mol,n(Cu2S):n(HNO3)=1:(2+4)=1:6。
常规解题:写出并配平该反应的化学方程式,根据方程式中Cu2S与HNO3相应的化学计量数之比求解,配平难度较大(略)。
自我评价:化学式中的定量关系要比化学方程式中的定量关系容易获得,利用化学式计算可以摆脱化学方程式的束缚,这就是化学式的优越性。解题过程要善于发现各化学式中各微粒间的定量关系,熟练使用工具,全面开发有用关系,促成定量计算水到渠成。
三、我是孪生兄弟,模样一致正好用
案例5NA表示阿伏加德罗常数,b g的C3H6和C4H8混合物中,下列说法正确的是( )
A.共用电子对总数为(b/7+1)NA
B.碳氢键总数为bNA/7
C.燃烧时消耗氧气体积为33.6b/14 L
D.原子总数为bNA/14
最简式解题:C3H6、C4H8及CnH2n均看成由最简结构单元“-CH2-”组成的化合物。读“-CH2-”知:每个结构单元中,3对共用电子对,3个原子,2个碳氢键,则b g混合物中共用电子对数与原子总数均为(b/14)×3×NA=3bNA/14,选项A、D错;碳氢键数目(b/14)×2×NA=bNA/7,选项B对。氧气未给标准状态,无法计算,选项C错。正确答案为B。
常规解题:C3H6和C4H8的微观构成分别为:1个C3H6分子中含9个原子、9对共用电子对、6个碳氢键,1个C4H8分子中含12个原子、12对共用电子对、8个碳氢键。设C3H6为x g,C4H8为(b-x)g,则含有共用电子对数目或含原子总数均为:{(x/42)×9+[(b-x)/56]×12}×NA=3bNA/14,选项A、D错;碳氢键总数为:{(x/42)×6+[(b-x)/56]×8}×NA=bNA/7,正确答案为B。
自我评价:一定质量、最简式相同的多种不同物质混合计算微粒数时,最简式有其用武之地——巧妙沟通不同宏观物质与相同微观粒子间的关系,宏微结合,简约计算。
