清肠温中方对溃疡性结肠炎模型大鼠炎性因子的影响*
2018-09-11韩亚飞贾博宜丁庞华谢添泓孙中美原文静李军祥
石 磊 ,韩亚飞 ,贾博宜 ,郭 一 ,丁庞华 ,谢添泓 ,孙中美 ,原文静 ,谭 祥 ,李军祥
1北京中医药大学,北京 10029;2北京中医药大学东方医院
溃疡性结肠炎(ulcerative colitis,UC)是属于炎症性肠病中最常见的一类疾病,好发于中青年,临床主要症状为腹痛、腹泻、排黏液脓血便,或伴随多系统的肠外表现,此外还具有病程长、易复发等特点,给患者造成身体、心理、社会和经济上的多重压力,严重者甚至威胁生命。目前,UC的确切发病机制仍不明确,相关研究[1]认为与肠屏障损伤、肠道菌群失常、抗原识别和免疫应答的失常有关。其中,炎性细胞因子在UC的免疫发病机制中起到了重要作用,接导致组织损伤并影响其炎症程度[2]。因此,研究药物对炎性因子的具体作用,将会对UC的治疗起到一定提示作用。前期研究发现,清肠温中方可以明显改善UC患者的临床症状,降低疾病相关评分,促进镜下黏膜修复[3],并对 2,4,6- 三硝基苯磺酸(2,4,6-trinitroBenzenesulfonic acid,TNBS)诱导的肠炎大鼠肠黏膜有保护作用[4]。本研究试图观察清肠温中方对TNBS诱导的UC大鼠炎性因子的影响,寻找清肠温中方在UC中的可能作用靶点,为清肠温中方的临床使用提供更多的实验数据支持。
1 材料与方法
1.1 实验动物 SPF级健康雄性SD大鼠70只,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2016-0002,饲养于北京中医药大学SPF级动物房,12 h/12 h:光照 / 黑夜循环,温度(22±2)℃,湿度 50%~60%,自由饮食饮水。
1.2 试药与试剂 清肠温中浸膏方(黄连6 g,炮姜10 g,三七6 g,木香6 g等组成)由北京中医药大学中药学院提供;乌梅丸(由乌梅16 g,干姜10 g,黄柏6 g,桂枝6g等组成)购自北京中医药大学东方医院颗粒剂药房;美沙拉秦缓释颗粒(艾迪莎,中国上海爱的发制药有限公司,国药准字H20143164);5%TNBS(w/v)(P2297)(美国 Sigma 公司);无水乙醇、便潜血试剂盒(中农博信(北京)科技有限公司;肿瘤坏死因子α(TNF-α)(EK0526)、白介素 6(IL-6)(EK0412)、干扰素(IFN-γ)(EK0374)、白介素13(IL-13)(EK0900)酶联免疫试剂盒(武汉博士德生物工程有限公司);抗Occludin(ab31721)、抗 NF-κB p50(ab28849)抗体(美国Abcam公司)。
1.3 实验方法
1.3.1 分组与造模 SD大鼠适应性饲养1周,采用随机数字表法将70只大鼠随机分为空白组,模型组,清肠温中方高剂量组(2.0 g浸膏/kg)、中剂量组(1.0 g浸膏/kg)、低剂量组(0.5 g浸膏/kg),美沙拉秦组(400mg/kg)和乌梅丸组(8.4g生药/kg)共7组,每组各10只。采用TNBS/无水乙醇改良复合法复制UC模型[4]。除空白组外,所有大鼠禁食不禁水12小时,10%水合氯醛(0.003mL/g)腹腔注射以麻醉大鼠,将石蜡油浸润婴儿灌肠管10 cm圆头,由肛门缓慢插入8 cm,将终浓度33.3%无水乙醇的TNBS(100 mg/kg)溶液0.6 mL1分钟内一次性缓慢推注入内,每只大鼠使用新灌肠管。保持仰卧位15分钟后,放回笼内棉花保暖至清醒。第4天起所有大鼠行常规饮食,同时连续10天给予相应药物灌胃干预(0.01 mL/g),模型组用蒸馏水进行对照。实验期间每天记录大鼠体质量,观察一般情况和便质,化验便潜血。
1.3.2 标本采集处理 实验结束时以10%水合氯醛(0.4 mL/100 g)腹腔注射麻醉大鼠,腹主动脉采血,采血管静置2小时后,4℃离心15分钟(3 000 rpm)分离血清,分装后-80℃冷冻备用;分离远端结肠(距肛门10 cm)2 cm,于4%多聚甲醛溶液固定,石蜡切片包埋,4 μm切片,抗原修复后采用DAB显色法免疫组化染色观察核转录因子κB(NF-κB)p50蛋白表达。
1.3.3 疾病活动指数(Disease Activity Index,DAI)[5]体质量下降率:无下降 0 分;1%~5%记 1 分;5%~10%记 2 分;10%~15%记 3 分;大于 15%记 4 分。便质:正常0分,稀软便2分;水样便4分;便潜血:阴性0分;阳性2分;肉眼血便4分。DAI评分为3项评分的平均值。
1.3.4 免疫组化结果阳性表达 采用Image J软件(1.37c NIH,USA)对染色结果进行分析,用平均光密度值(AOD=IntDen/Area)表示目标蛋白染色强度。
1.4 统计学方法 采用SPSS 22.0软件对数据进行统计学分析。符合正态分布的计量资料用(±s)描述,用单因素方差分析进行检验,方差齐用LSD-t,不齐用Tamhane′s T2。不符合正态分布的计量资料及计数资料用中位数、p25和p75描述,用独立样本非参数检验的K-W检验,P<0.05表示差异有统计学意义。
2 结果
2.1 血清炎性因子 模型组大鼠血清TNF-α、IL-6及IFN-γ与空白组比较明显升高,经药物干预治疗后的大鼠血清含量均有所下降,其中以中剂量和美沙拉秦组下降最为明显。模型组血清IL-13含量比空白组明显降低,经药物治疗后,各组含量均明显增多。见表1。
表1 各组血清炎性因子含量比较(±s) pg/mL

表1 各组血清炎性因子含量比较(±s) pg/mL
注:*表示与空白组比较,P<0.01;#表示与模型组比较,P<0.01;##表示与模型组比较,P<0.05
组别 只数 TNF-α IL-6 IFN-γ IL-13空白组 10 67.53±14.88 90.49±5.08 21.64±2.46 44.49±7.15模型组 6 98.38±23.06* 181.39±58.67* 69.12±10.26* 21.01±4.87*高剂量组 7 79.97±6.05 117.65±32.21## 39.86±5.70## 35.80±3.61#中剂量组 8 73.93±10.04## 99.93±19.50# 26.61±6.47# 40.31±5.79#低剂量组 7 79.59±21.52 154.30±80.55 50.06±6.95 34.92±2.60#美沙拉秦组 8 73.01±5.33## 92.73±14.10# 23.49±2.27# 42.15±1.46#乌梅丸组 8 78.38±16.44## 115.02±27.52## 34.89±4.69## 39.68±2.82#
2.2 D A I及一般情况 造模过程中,空白组大鼠表现正常,造模大鼠出现活动度下降、进食饮水量减少、喜蜷缩静卧,毛发缺乏光泽、大便稀软甚至出现黏液状粪便等表现并逐渐加重。造模期间除空白组外,每组均死亡1只大鼠。用药干预期间,模型组大鼠一般状态仍然较差,进食量和体质量持续下降,部分大鼠一直存在便潜血阳性甚至可见肉眼血便,治疗期间死亡3只。其余大鼠整体状态均有所好转,随着药物干预,进食和体质量均逐渐增加,部分大鼠在治疗结束前便潜血可转阴性。治疗期间,高剂量、低剂量组各死亡2只,中剂量、美沙拉秦组和乌梅丸组各死亡1只。最后1天DAI结果提示,与空白组相比,模型组评分显著升高(P<0.01);与模型组比较,清肠温中方中剂量、美沙拉秦和乌梅丸组评分下降(P<0.05)。见图1。

图1 DAI评分图
2.3 N F-κBp50 免疫组化染色后发现,UC模型组大鼠肠道NF-κB p50表达量明显高于空白组(P<0.01),阳性蛋白的表达范围和染色强度均明显升高。与模型组比较,清肠温中方中剂量、美沙拉秦组和乌梅丸组,其阳性蛋白表达均有明显下调(P<0.01)。蛋白表达含量见图2,免疫组化染色见图3。
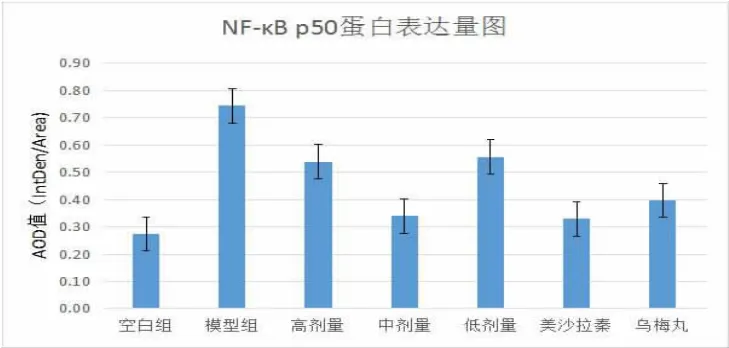
图2 NF-κB p50蛋白表达含量差异图

图3 NF-κB p50蛋白免疫组化染色图(x200)
3 讨论
本实验采用TNBS/无水乙醇复合法建立UC模型,前期我们已经发现TNBS/无水乙醇复合法可以成功诱导大鼠实验性肠炎[6]。UC的发病机制中,异常活化的免疫应答一直是研究的热点。其免疫学紊乱的特征在于:1)肠上皮损伤,包括黏液的异常生成和修复机制缺陷;2)由肠道菌群驱使的炎症扩大和大量的细胞浸润到固有层中;3)控制炎症反应的免疫调节失常,使炎症级联反应进一步加大。因此,细胞因子在肠道炎症的起始、介导、持续、控制和组织损伤方面不容忽视,而转录因子NF-κB的异常活化就会引起炎性因子的大量激活和释放,引起一系列过激的免疫应答和炎症反应[7]。
生理情况下,细胞质中的NF-κB与抑制蛋白IκB以无活性的复合物形式存在于细胞中。内在膜受体的介导会使一些胞外信号激活IκB激酶,使IκB磷酸化而发生解离,导致NF-κB活化;活化的 NF-κB 会参与 TNF-α、诱生型 NO、IL-1β、血管细胞黏附分子-1、IL-6、IL-8等多种炎症因子或介质的分泌,而这些细胞因子与UC的各个阶段密切相关[8]。本实验通过免疫组化染色发现:模型组大鼠结肠黏膜层NF-κB p50表达明显增多,这可能与NF-κB的异常激活有关,而后者的激活会直接导致促炎因子、IFN-γ等表达上调,同时又直接参与到了TNF-α信号通路。
TNF-α通过旁分泌和自分泌形式在UC肠黏膜局部发挥作用,一方面活化内皮细胞表面整联素的表达、募集中性粒细胞、诱导NO合酶异构体产生大量NO直接损伤细胞;另一方面与IFN-γ共同作用于肠屏障,破坏肠屏障完整,增加其通透性。此外也能促使IL-6等炎性因子的释放,后者通过STAT-3途径进一步激活NF-κB诱导黏附因子等的表达[9]。而IL-13作为具有抗炎效应的一种Th2细胞因子,能从转录水平对G-CSF产生抑制,调节中性粒细胞的存活、增生和分化,并能增强成熟中性粒细胞功能,在抗感染的细胞免疫中起重要作用[10]。
清肠温中方是北京中医药大学东方医院李军祥教授总结多年临床的经验方,在UC治疗中取得了很好的效果。李教授认为UC活动期属于中医的“肠澼”范畴,此病病位在肠,与脾胃关系密切;病性为本虚标实,寒热错杂;本虚为脾虚、脾阳不足,标实为湿热内蕴,夹有瘀血。治疗当以清肠温中、化瘀止血,用于寒热错杂,湿热瘀阻证。症见腹泻黏液脓血便,腹部冷痛,里急后重,口干口苦,小便短赤,肛门灼热,苔黄厚腻,脉滑数或濡数。该方主要由黄连、炮姜、三七、木香等组成。研究显示木香能够下调大鼠血浆中前列腺素E2表达水平,而抑制炎性细胞,减轻肠道炎症,通过启动UC肠黏膜组织的防御机制,从而增强结肠黏膜屏障的防御机能[11]。黄连的主要成分黄连素可以通过抑制IL-6/STAT3信号通路而起到了缓解症状、减轻炎症程度的治疗作用[12]。而炮姜的有效成分6-姜酚对脾胃虚寒模型大鼠具有显著的温中散寒作用。本实验发现,模型组大鼠以上促炎因子表达都明显高于空白组,而当药物治疗后,表达都能有所下降;因此推测炎性因子可能是清肠温中方治疗UC的作用靶点之一。清肠温中方可能通过抑制TNF-α分泌激活和NF-κB的转录,减少了IFN-γ、IL-6等促炎因子表达,并上调IL-13这类抗炎因子,从而通过减轻和维持正常炎症反应,起到治疗UC的作用。此外我们还发现,清肠温中方中剂量和美沙拉秦组在所有药物治疗组中,对炎性因子的作用最为明显,这也为清肠温中方的使用剂量和有效性提供了一定的实验室数据支持。但本实验样本例数较少,有待进一步研究。
综上所述,促炎因子相互间作用形成网络,而抗炎因子的表达受抑制,使整体上扩大了炎症级联反应,导致UC的发生。
