定清片对人急性髓系白血病HL-60细胞侵袭力的影响*
2018-09-11孙伟玲郑丹丹周永明
孙伟玲,郑丹丹,周永明
上海中医药大学附属岳阳中西医结合医院,上海 200437
急性髓系白血病(acute myeloid leukemia,AML)是一类常见的造血系统恶性增殖性疾病,在成人急性白血病中最为多见[1-2]。白血病细胞具有较强的浸润和转移能力,此类细胞大量增生,侵犯髓外器官及其他组织,是白血病临床缓解后复发的一个重要原因。基质金属蛋白酶[3-4](MMPs)是一类对锌有依赖的蛋白水解酶,可分为胶原酶、明胶酶、基质溶解酶和膜型基质金属蛋白酶4种。其中明胶酶(包括MMP-2、MMP-9)能降解细胞外基质IV型胶原,在恶性肿瘤的生长和转移过程中起着非常重要的作用。已有研究表明,急性髓系白血病细胞可分泌MMP-2和MMP-9[5-6],本实验研究用不同浓度定清片含药血清对急性髓系白血病HL-60细胞进行干预,观察定清片对HL-60细胞侵袭力的影响,以明确白血病发生及浸润转移的部分机理。
1 材料与方法
1.1 细胞株与实验动物 人急性髓系白血病细胞株HL-60购自中科院上海细胞生物研究所批号:CBP420247,20只成年雄性SD大鼠购自上海西普尔-必凯有限公司,实验动物合格证号:SCXK(沪)2013-001。
1.2 主要仪器与试剂 型细胞培养箱(ThermoForma 3311);超净台(浙江苏净净化设备有限公司,SA-960-2);Neofugel 5型高速冷冻离心机(Heal Force,Neofuge15);IX53 型 倒 置 显 微 镜(OLYMPUS,IX53);Mini P-4 电泳槽(Cavoy,MP-8120);MP-8120 型湿转电泳槽(Cavoy,MP-3030);MP-3030型电泳仪(Bio-Rad,CBJ-IMR2-001)。RPMI-1640培养液批号:(HyClone,AAJ206660)、小牛血清购自 HyClone公司批号:(HyClone,GXM0109);双抗溶 液 (MULTICELL,450201013);蛋 白 酶 抑 制 剂(sigma,T9128);蛋白抽提试剂(碧云天,P0028);BCA蛋白定量试剂盒(碧云天,批号:P0010)。
1.3 药物 定清片(我院院内制剂,主要由太子参、雄黄、栀子、陈皮、甘草等组成),批准文号:沪卫药剂98-090,规格:0.1 g/片。
1.4 含药血清的制备 定清片规格:0.1 g/片,成人(60 kg)日用临床剂量为4片/次,3次/d口服,相当于20 mg/kg·d-1。人和大鼠之间换算:20 mg/kg×60 kg×0.018/0.2 kg=108 mg/kg·d-1(大鼠),相当于成人每日剂量约6.2倍。故大鼠剂量按照人剂量的6.2倍来进行灌胃。将20只SD大鼠随机分为正常对照和定清片2组,对照组5只,定清片组15只。定清片组以定清片混悬液灌胃,空白组以同等量的生理盐水灌胃。每只大鼠每次灌胃容量为1mL/100g,各组连续给药3天,3次/d,于第4日晨末次给药后2 h,腹腔麻醉,无菌条件腹主动脉采血,3 000 r/min离心15分钟,56℃水浴灭活30分钟,-80℃冷藏备用,用前无菌过滤,使用时稀释至所需浓度。
1.5 实验分组 将上述制备的含药血清,分别稀释成5%、10%、20%3种不同浓度,并用这3种不同浓度的药物对急性髓系白血病HL-60细胞进行体外干预,另设一空白对照组(用培养液补足),培养48小时后行相关蛋白检测。
1.6 细胞培养 配制含10%小牛血清、1%双抗溶液的RPMI-1640培养基培养HL-60细胞株,细胞起始浓度1×105/mL,置于 37℃、5%CO2的培养箱中进行传代培养,取对数期细胞进行实验。
1.7 Transw el l实验 将4℃化解的基质胶用无血清培养基对倍稀释,均匀涂布于4℃预冷的Transwell培养小室膜的上表面,每孔加入100μL。置37℃培养箱30分钟,取出后用无菌PBS缓冲液洗3次。用无血清培养基调整细胞密度为5×105/mL,接种到Transwell培养板的上层小室中,每孔接种100μL,并加入无血清培养基200μL。Transwell培养板的下层小室中每孔加入500 μL含10%FBS的培养液,5%CO2、37℃培养箱24小时。将培养24小时的Transwell培养板的上层小室取出,收集培养板孔内细胞并计数。
1.8 W est ern Bl ot检测 向细胞沉淀中加入冷的RIPA裂解液500 μL裂解细胞,然后15 000 r/min 4℃离心30分钟,取上清于干净EP管中,使用BCA蛋白定量试剂盒测定蛋白浓度。取20 μg蛋白行SDS-PAGE电泳,用湿转将蛋白转移至PVDF膜上,然后将PVDF膜取下置于湿盒中用5%BSA封闭2小时,按1∶1 000加入一抗,4℃摇床过夜。用PBS将PVDF膜洗涤3次,每次15分钟,按1∶5 000比例加入二抗,室温反应1小时。再次用PBS将PVDF膜洗涤3次,每次15分钟,混合等体积化学发光剂AB液,与PVDF膜共孵育1分钟,放入Bio-Rad化学发光仪检测,并对检测结果进行定量分析。
1.9 统计学方法 采用SPSS 16.0软件进行分析,计量资料用(±s)表示,符合正态分布及方差齐性的使用t检验或方差分析,不符合正态分布及方差齐性的使用非参数检验,组间采用LSD-t检验进行多重比较;P<0.05表示差异有统计学意义。
2 结果
2.1 定清片对H L-60细胞侵袭力的影响 侵袭细胞数不同浓度定清片含药血清干预组均较空白组减少,差异有统计学意义(P<0.05);5%定清片血清组与10%定清片血清组比较,差异无统计学意义(P>0.05);20%定清片血清组与5%定清片血清组与10%定清片血清组比较,差异有统计学意义(P<0.05)。见表1。
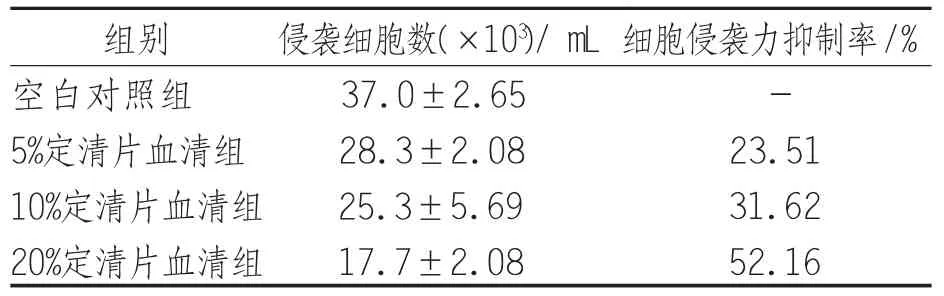
表1 定清片对H L-60细胞侵袭力的影响
2.2 定清片对HL-60细胞MMP-2、MMP-9蛋白表达的影响 HL-60细胞MMP-2、MMP-9蛋白表达水平不同浓度定清片含药血清干预组均较空白组减少,差异有统计学意义(P<0.05);5%定清片血清组与10%定清片血清组比较,差异无统计学意义(P>0.05);20%定清片血清组与5%定清片血清组与10%定清片血清组比较,差异有统计学意义(P<0.05)。见表 2、图 1。

表2 定清片对M M P-2、M M P-9蛋白表达量的影响

图1 不同浓度定清片含药血清对MMP-2、MMP-9蛋白表达的影响
3 讨论
浸润、转移是恶性肿瘤的常见生物学特性[7],也是造成患者死亡的重要原因之一。大量研究证实[8-11],MMPs在肿瘤浸润、转移过程中扮演着至关重要的角色。其促进肿瘤细胞侵袭增长的主要机制如下:1)促进肿瘤血管新生,为肿瘤生长提供营养物质;2)增强肿瘤细胞黏附力,促进其浸润生长;3)破坏周围正常细胞表面的基质屏障,以便肿瘤细胞对其进行侵袭;4)参与肿瘤的免疫应答过程,促进肿瘤细胞或诱导其他细胞产生MMP-2、MMP-9。
AML是一类具有高度异质性的造血系统恶性肿瘤,它的发生和髓外浸润都是多基因参与、多步骤、多因素的复杂过程[12]。有研究[5-6]显示,AML患者骨髓中大量原始及幼稚细胞异常增生,在MMP-2和MMP-9的作用下穿过血管内皮细胞的基底膜,从而对全身各器官、组织进行侵袭浸润,整个过程中MMP-2和MMP-9发挥着重要作用。
定清片是我院血液科黄振翘教授、周永明教授在“扶正祛邪”理论指导下,多年潜心研究、逐步改良而成的治疗白血病的有效制剂。其主要成分为太子参、雄黄、栀子、陈皮、甘草等。方中诸药配伍,清补兼施,补中有清,共奏益气养阴、清解邪毒之功。
本实验研究采用Transwell实验检测定清片含药血清对细胞侵袭力的影响,结果发现HL-60细胞可以穿过涂有基质胶的Transwell培养小室膜,具有一定的侵袭能力。且不同浓度定清片含药血清干预组侵袭细胞数较空白组减少,随着药物浓度的逐渐增加,定清片对HL-60细胞侵袭力的抑制作用越明显。研究进一步采用Western Blot检测MMP-2、MMP-9的蛋白表达量,发现定清片可以降低HL-60细胞MMP-2、MMP-9蛋白的表达水平,且随着药物浓度的升高,其下调MMP-2及MMP-9蛋白表达更为显著。通过以上结果可知,定清片可抑制细胞侵袭力、下调MMP-2和MMP-9蛋白表达,可能是定清片抑制HL-60细胞浸润、转移的一部分机制。
