荒漠草原中间锦鸡儿灌丛的土壤微生物多样性
2018-09-11王德凯王跃棠梅续芳解李娜李清芳马成仓
王德凯 ,李 颖 ,王跃棠 ,梅续芳 ,解李娜 ,李清芳 ,马成仓
(1.天津师范大学生命科学学院,天津300387;2.天津师范大学天津市动植物抗性重点实验室,天津300387)
土壤微生物是生活在土壤中的细菌、真菌、放线菌、藻类的总称.其组成和结构一方面受土壤性质的影响,如土壤水分、土壤温度、pH、土壤养分、土壤质地等[1-2];另一方面,土壤微生物群落与植物生长过程紧密相关,植物通过凋落物、根系分泌物、植物生产力等影响土壤微生物群落[3-4].灌木已成为全球草地生态系统的重要组成部分,其密度和盖度较大且呈逐年增加趋势.灌丛的形成改变了地表土壤资源的分配,使水分和养分较多地聚集在灌丛内,导致土壤资源具有空间异质性,形成“沃岛”[5].“沃岛”的形成又会引发土壤有机碳和其他成分的空间异质性,加剧了资源的异质化和斑块化[6],从而影响土壤微生物群落.灌丛土壤资源异质化又会引起灌丛内外植被的异质化,进一步影响土壤微生物群落[7-8].
锦鸡儿属(Caragana Fabr.)植物是内蒙古草原最常见的灌木,具有很强的适应干旱、寒冷环境和耐贫瘠能力,不仅是牲畜的优质牧草,还能够防风固沙、保持水土[9].本研究以内蒙古荒漠草原的中间锦鸡儿灌丛的土壤微生物为研究对象,通过传统培养法和分子生物学技术,比较灌丛内外土壤微生物群落的差异,探讨中间锦鸡儿灌丛形成导致的土壤资源异质化对土壤微生物的影响,进一步理解中间锦鸡儿灌丛的沃岛效应.
1 材料与方法
1.1 研究区概况
样地位于内蒙古鄂托克旗的乌兰镇(北纬39°1′,东经107°98′),该地区为典型的温带大陆性季风气候,日照充足,四季分明,年平均降水量约为250 mm,降水主要集中在7—9月份.年平均蒸发量为2 400~2 800 mm,是降水量的8到12倍.年平均气温为6.5℃,年日照时数约3 000 h.土壤质地以疏松的砂质壤土或沙土为主.
1.2 研究方法
1.2.1 土壤样品采集
2016年7月在鄂托克旗乌兰镇选取3个优势种为中间锦鸡儿的地区作为样地,每个样地随机选取3株中间锦鸡儿灌丛,在灌丛内和灌丛外(距离灌丛边缘 2 m)分别采集 0~10 cm(A 层)、10~20 cm(B 层)、30~40 cm(C层)的土壤样品约300 g,用自封袋密封.样品于4℃保存,一部分用于土壤理化性质的测定,一部分用于土壤微生物多样性的测定.
1.2.2 土壤理化性质的测定
采用水浸提电位法测定土壤pH值;采用烘干法测量含水量;采用重铬酸钾容量法测定有机质(Organic matter)含量;采用碳酸氢钠浸提-钼锑抗比色法测定速效磷(Available phosphorus)含量;采用醋酸铵浸提-火焰光度法测定速效钾(Available potassium)含量;使用流动分析仪测定硝态氮(Nitrate nitrogen)和铵态氮(Ammonium nitrogen)含量.将土样浸提,然后用DDS~LLA型电导仪测定电导率(Electricconductivity)[10].中间锦鸡儿灌丛内外的土壤理化性质如表1所示.
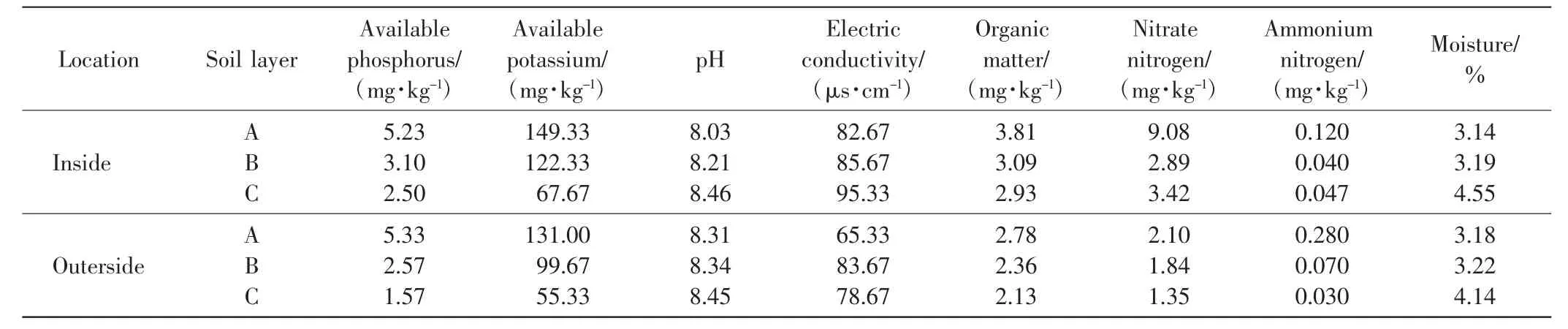
表1 中间锦鸡儿灌丛内外土壤理化性质Tab.1 Physical and chemical characteristics of soil inside and outside Caragana intermedia shrubs
1.2.3 土壤微生物群落的多样性测定
(1)土壤微生物培养:分别采用牛肉膏蛋白胨培养基、马丁氏培养基和高氏一号培养基法培养土壤中的细菌、真菌和放线菌,采用稀释平板计数法计数,结果以每克干土所含的微生物菌落数表示.用平板划线分离法分离纯化微生物菌落.
1g干土中的菌落数(cfu/g)=M×鲜土质量/干土质量式中:M=a×u/V,a为培养皿中的平均菌落数,u为稀释倍数,V为每个培养皿中加入的土壤悬液的体积(本实验中为0.2 mL).
(2)微生物的分子生物学鉴定:细菌和放线菌DNA采用生工Ezup柱式细菌基因组DNA抽提试剂盒进行提取,真菌DNA采用生工Ezup柱式真菌基因组DNA抽提试剂盒提取,按照试剂盒说明书进行操作.采用通用引物 1492R(5′-GGT TAC CTT GTT ACGACT T-3′)和 27F(5′-AGA GTT TGA TCC TGG CTCAG-3′)扩增细菌和放线菌16S rDNA片段,GeoA2(5′-CCA GTA GTC ATA TGC TTG TCT C-3′)和 Geo11(5′-ACC TTG TTA CTT TTA CTT CC-3′)扩增真菌18S rDNA片段.PCR扩增产物由北京华大基因公司测序,所得碱基序列提交至GenBank数据库,使用BLAST程序进行比对分析,将菌株鉴定到属.
采用Shannon-Wiener多样性指数(H′)分析评价土壤微生物群落的多样性[11].
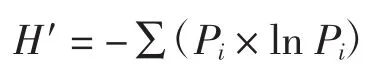
式中:Pi表示群落中第i个物种的个体数占群落中个体总数的比例.
1.3 数据分析
利用SPSS17.0软件进行单因素方差分析(One-way ANOVAs)(P<0.05),分析灌丛内外不同土层间微生物菌落数量和多样性的差异.用Tukey HSD做多重比较.采用独立样本t检验分析灌丛内外的差异.采用CANOCO 4.5软件对土壤微生物和环境因子之间的关系进行冗余分析.用Monte Carlo置换检验分析环境因子对土壤微生物群落影响的统计学意义(P<0.05).
2 结果与分析
2.1 中间锦鸡儿灌丛土壤微生物的数量
中间锦鸡儿灌丛内外不同土层的土壤微生物数量如图1所示.
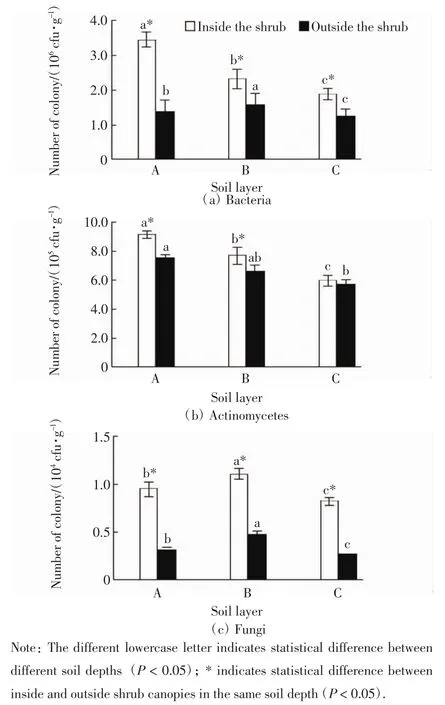
图1 灌丛内外土壤细菌、放线菌和真菌菌落总数Fig.1 Quantity of bacteria,actinomycetes and fungi inside and outside the shrubs
由图1可以看出,土壤微生物总数表现为:细菌>放线菌>真菌.灌丛内土壤细菌数随着土层深度的增加显著下降(P<0.05),而灌丛外则呈先缓慢增加后减少的趋势;同一土层灌丛内土壤细菌总数均显著高于灌丛外的数量(P<0.05).灌丛内外放线菌总数均表现为A层>B层>C层,且不同土层间的差异具有统计学意义(P<0.05);同一土层灌丛内的土壤放线菌总数均大于灌丛外的数量,A层和B层灌丛内外的差异具有统计学意义(P<0.05),C层灌丛内外数量相近(P>0.05).灌丛内外的土壤真菌数随着土层深度的增加均呈先增加后减少的趋势,不同土层之间的差异具有统计学意义(P<0.05);同一土层灌丛内土壤真菌总数均显著高于灌丛外的数量(P<0.05).
2.2 中间锦鸡儿灌丛土壤微生物的群落组成
2.2.1 细菌
本研究从中间锦鸡儿灌丛内外土壤中共分离出细菌13属,如表2所示.无论是灌丛内还是灌丛外,A层的优势属均为芽孢杆菌属(Bacillus)和短小杆菌属(Curtobacterium Yamada),B层和C层的优势属为芽孢杆菌属、短小杆菌属和类芽孢杆菌属(Paenibacillus Ash),优势属的相对丰度在不同土层间的差异具有统计学意义(P<0.05).在灌丛内,芽孢杆菌属的相对丰度随土层深度增加显著下降(P<0.05),灌丛外则无显著差异(P>0.05).无论是灌丛内还是灌丛外,类芽孢杆菌属的相对丰度均随土层深度的增加而显著升高(P<0.05).在灌丛内,短小杆菌属在B层的数量最多,在灌丛外则是A层数量最多.壤霉菌属(A-gromyces)、溶杆菌属(Lysobacter)、鞘氨醇杆菌属(Sphingobacterium sp)、嗜麦芽窄食单胞菌属(Stenotrophomonas maltophilia))、金黄杆菌属(Chryseobacterium))、假单胞菌属(Pseudoxanthomonas)为灌丛内特有属,且壤霉菌属、溶杆菌属、鞘氨醇杆菌属、金黄杆菌属均集中在灌丛内的A层.节杆菌属(Arthrobacter)仅在A层出现.葡萄球菌属(Staphylococcus)在各土层均能检测到,灌丛内各土层间的差异较小(P>0.05),灌丛外则随着土层深度的增加呈下降趋势(P<0.05).中华根瘤菌属(Sinorhizobium Chen)在灌丛内仅在A层检测到;灌丛外则分布于A层和B层.微杆菌属(Microbacterium)在灌丛内的各个土层均可检测到,且A层和C层数量相近,显著高于B层;灌丛外则出现于B层和C层,且后者数量显著高于前者(P<0.05).
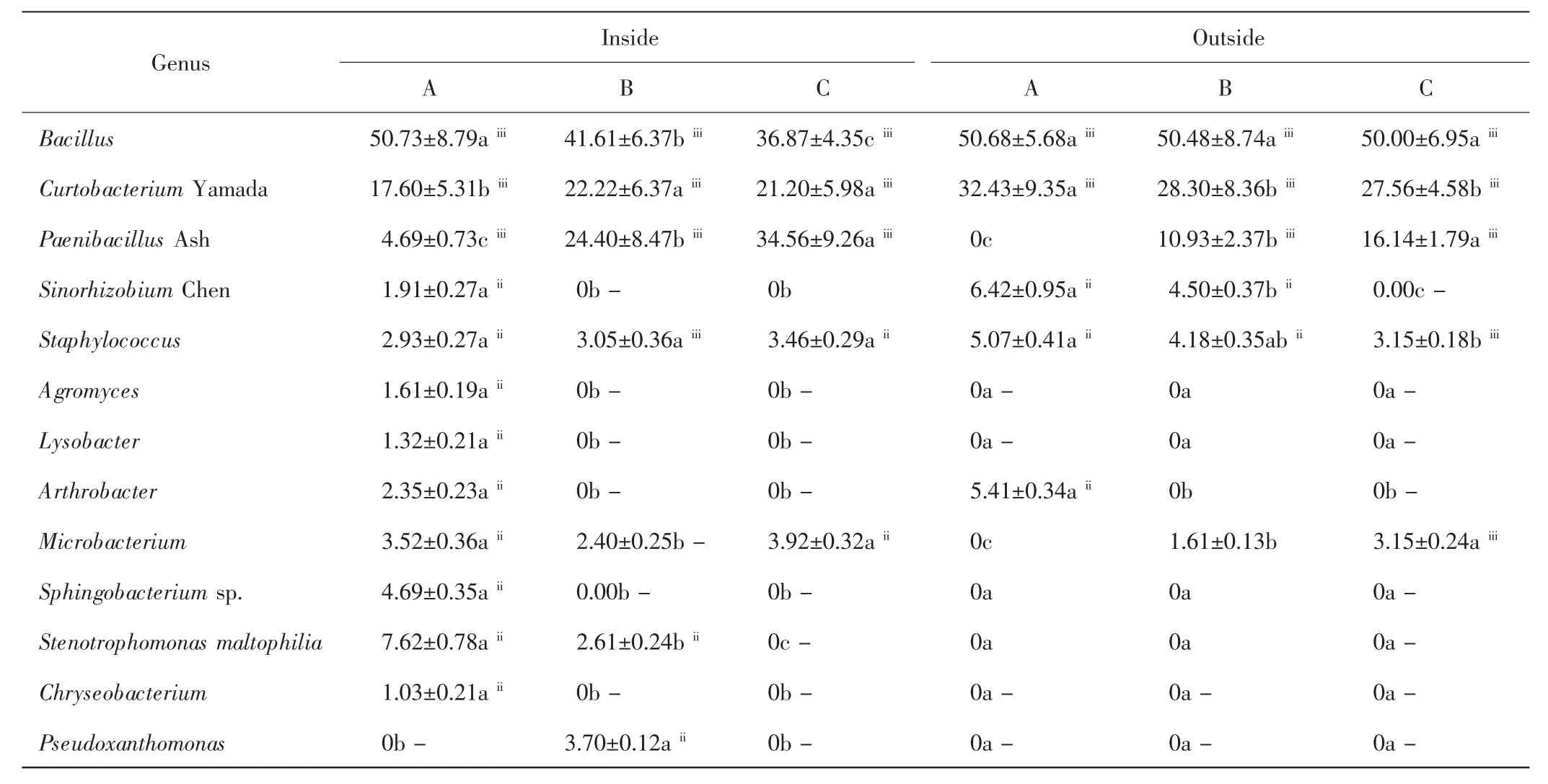
表2 灌丛内外土壤细菌群落组成及相对丰度Tab.2 Community composition and relative abundance of bacteria inside and outside shrubs %
2.2.2 真菌
中间锦鸡儿灌丛内外土壤中共分离出真菌12属,如表3所示.由表3可以看出,曲霉属(Aspergillus)为灌丛内外各土层的优势属,且相对丰度随着土层深度的增加显著增加(P<0.05).小囊菌(Microascaceae)为灌丛内B、C层和灌丛外C层的优势属.青霉属(Penicillium)主要集中在灌丛内的A层和灌丛外的B、C层,灌丛内的相对丰度随着土层深度的增加显著降低(P<0.05),灌丛外则是B层数量最多.茎点霉属(Phorna)和隐球菌属(Cryptococcus)均仅出现在灌丛内外的A层,而链格孢霉属(Alternaria)出现在A层和B层.木霉属(Trichoderma)、露漆湿斑菌属(Myrothecium roridum)和小麦叶枯病菌(Septoriatritici)均为灌丛内特有属,疣孢漆斑菌属(Myrothecium verrucaria)为灌丛外特有属.镰刀菌属(FusariumLink)、球毛壳菌属(Chaetomium)和小囊菌(Microascaceae)在灌丛内外的各个土层均能检测到,通常富集在B层和C层.
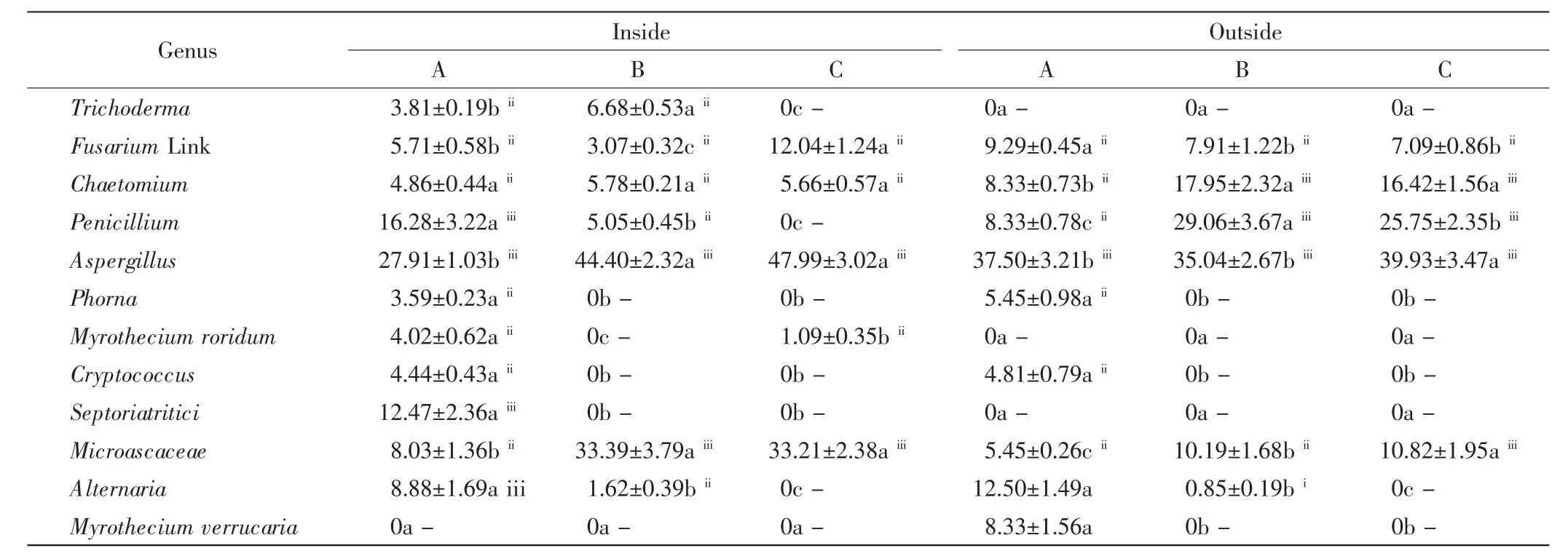
表3 灌丛内外土壤中真菌群落组成及相对丰度Tab.3 Community composition and relative abundance of fungi inside and outside shrubs %
2.2.3 放线菌
中间锦鸡儿灌丛内外土壤中共分离出了放线菌5属,如表4所示.灌丛内和灌丛外各土层的优势属均为链霉菌属(Streptomyces),相对丰度占各土层放线菌总数的83%~95%,B层的相对丰度显著高于A层和 C 层(P<0.05).小单孢菌属(Micromonospora)仅在灌丛内出现,为灌丛内A层的优势属.诺卡氏菌属(Nocardia)同样仅出现在灌丛内,为灌丛内C层的优势属,且相对丰度随着土壤深度增加显著升高(P<0.05).Dyadobacter属仅在灌丛内的A层检测到.

表4 灌丛内外土壤中放线菌群落的组成及相对丰度Tab.4 Community composition and relative abundance of actinomycetes inside and outside shrub canopies %
2.3 中间锦鸡儿灌丛土壤微生物多样性
中间锦鸡儿灌丛不同土层的土壤微生物多样性指数计算结果如表5所示.
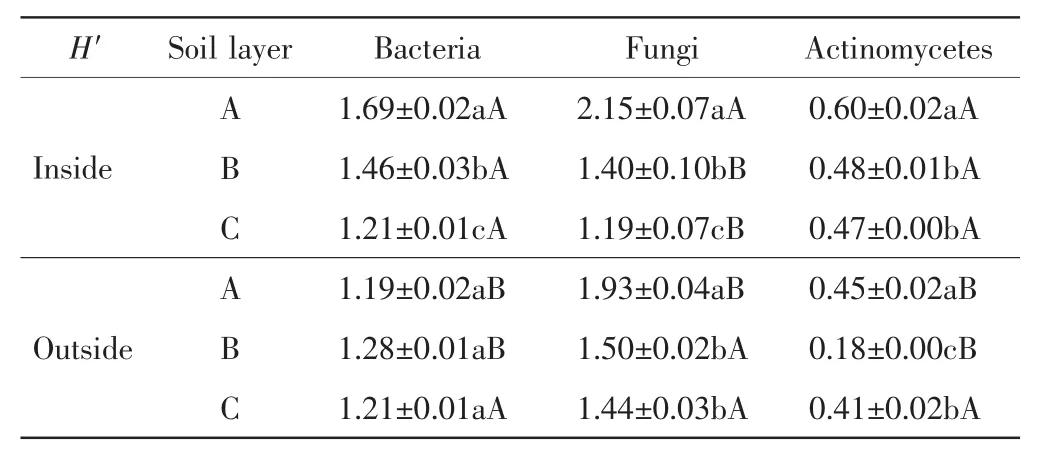
表5 灌丛内外土壤微生物的Shannon-Wiener指数Tab.5 Shannon-Wiener index(H′)of soil microorganisms inside and outside the shrubs
由表5可以看出,中间锦鸡儿灌丛内土壤细菌的H′指数随着土层深度的增加显著下降(P<0.05),灌丛外则随着土层深度的增加先增加后下降,但不同土层之间的差异不具有统计学意义(P>0.05);A层和B层灌丛内的细菌H′指数显著高于灌丛外的数值,C层灌丛内外的数值相同.土壤真菌的H′指数在灌丛内外均随着土层深度的增加呈下降趋势;A层灌丛内的数值显著高于灌丛外的数值,B层和C层则是显著低于灌丛外的数值(P<0.05).灌丛内土壤放线菌的H′随着土层深度的增加呈下降趋势(P<0.05),而灌丛外H′随着土层深度的增加先降低后增加(P<0.05);A层和B层灌丛内的放线菌H′指数显著高于灌丛外的数值(P<0.05),C层数值相近(P>0.05).
2.4 土壤微生物群落与环境之间的关系
2.4.1 土壤细菌群落与环境的关系
对中间锦鸡儿灌丛土壤细菌群落与环境之间的关系进行冗余分析,结果如图2所示.
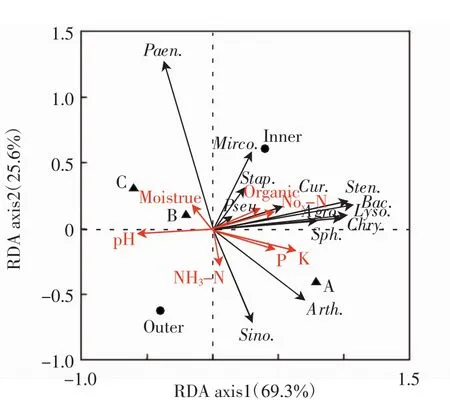
图2 土壤细菌群落和环境因子的冗余分析Fig.2 RDA diagram of the relationship between soil bacterial communities and environmental factors
RDA的直接排序图显示,第一轴、第二轴对响应变量的解释比例分别为56.7%和25.6%,Monte Carlo置换检验排序轴均达到显著水平(第一排序轴:F=9.156,P<0.05;所有排序轴:F=5.147,P=0.002),说明环境因子能够显著影响土壤细菌群落.与第一轴关系最密切的是速效钾(r=0.706 5),与第二轴关系最紧密的是灌丛(r=0.8467).RDA排序图结果表明,假单胞菌属、溶杆菌属、嗜麦芽窄食单胞菌属、芽胞杆菌属、壤霉菌属、溶杆菌属、金黄杆菌属和鞘氨醇杆菌属与土壤有机质、硝态氮含量呈显著正相关,但与土壤pH呈显著负相关.类芽孢杆菌属与土壤含水量呈显著正相关,与铵态氮含量呈显著负相关.中华根瘤菌属与铵态氮含量呈显著正相关,但与土壤含水量呈显著负相关.节杆菌属与速效磷、速效钾含量呈显著正相关,与土壤土壤含水量也呈显著负相关.
2.4.2 土壤真菌群落与环境的关系
对中间锦鸡儿灌丛土壤真菌群落与环境之间的关系进行冗余分析,结果如图3所示.
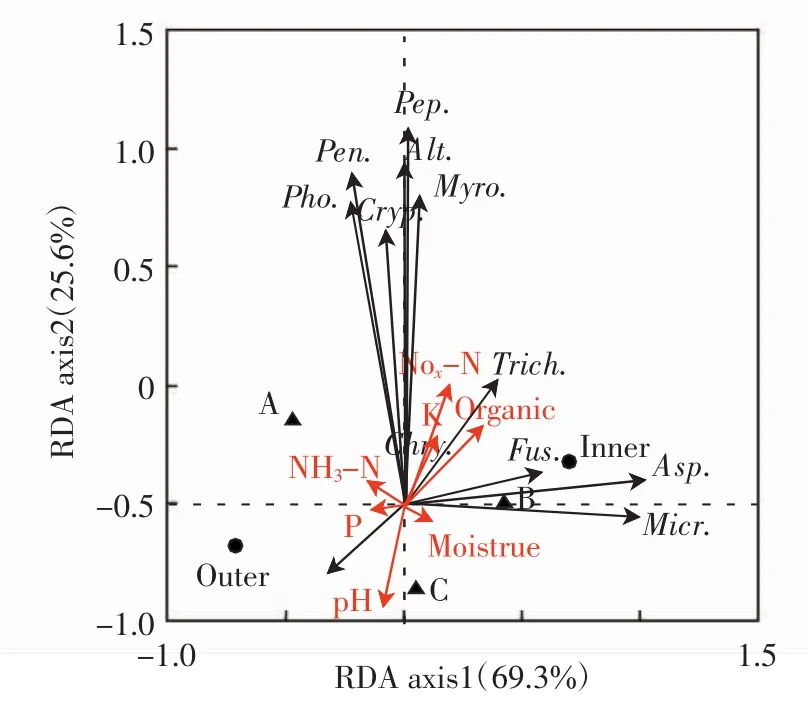
图3 土壤真菌群落和环境因子的冗余分析Fig.3 RDA diagram of the relationship between soil fungal communities and environmental factors
RDA直接排序图显示,第一轴、第二轴对响应变量的解释比例分别为69.3%和11.3%,Monte Carlo置换检验排序轴均达到显著水平(第一排序轴:F=15.825,P<0.05;所有排序轴:F=8.020,P<0.05).与第一轴关系最密切的是灌丛(r=0.754 7),与第二轴关系最紧密的是硝态氮含量(r=0.863 1).球毛壳菌属和木霉属与硝态氮含量、速效钾含量和有机质含量呈显著正相关,与土壤pH呈显著负相关(P<0.05).小囊菌属与土壤含水量呈显著正相关,与速效磷含量呈显著负相关(P<0.05).疣孢漆斑菌属与速效磷含量含量、土壤pH呈显著正相关,与土壤有机质含量呈显著负相关(P<0.05).
放线菌冗余分析Monte Carlo置换检验未达到显著水平,说明环境因子对放线菌的影响不显著.
3 讨论与结论
本研究对内蒙古荒漠草原中间锦鸡儿灌丛内外的微生物多样性进行调查,结果发现,土壤可培养细菌的数量最多,其次是放线菌,真菌数量最少,这与多数研究[12-13]结果一致.土壤微生物的数量和群落多样性存在明显的垂直分布异质性.如苦豆子、芨芨草、油蒿等的土壤微生物数量随土层加深呈下降趋势[14-16];小兴安岭的原始红松林、硬阔叶林和白桦林3种林地的土壤微生物多项多样性指数随着土层深度的增加显著下降[17].细菌和真菌的丰富度随土壤深度的增加而下降,而放线菌的丰富度随土壤深度的增加而增加[18-19].本研究结果表明,中间锦鸡儿灌丛的土壤可培养细菌、真菌和放线菌的数量及H′均表现为表层土或次表层土最大,这主要是因为土壤表层覆盖有较多的凋落物,凋落物的分解提高了土壤表层养分含量,有利于表层土中土壤微生物的生长.另外,土壤性质随着土层深度的变化而变化,从而影响土壤微生物群落.本研究通过RDA分析发现土壤速效钾和硝态氮均与土壤可培养细菌和真菌的关系密切,说明速效钾和硝态氮是影响中间锦鸡儿土壤细菌和真菌的主要环境因素.RDA分析还表明土壤可培养放线菌数量与环境因子之间的相关性不显著,说明环境变化对放线菌群落的影响不大.中间锦鸡儿灌丛内的土壤细菌、真菌、放线菌数量和多样性均大于灌丛外,这是由于中间锦鸡儿灌丛的生长发育引起土壤资源空间异质性,灌丛内土壤养分聚集,形成比周围环境更适宜的微生境[20-21],从而有利于土壤微生物生长.与灌丛外相比,灌丛内的植物多样性更高,这也会增加土壤有机质含量并调节土壤含水量,即改善了土壤微生物的生存环境[22-23].
在土壤细菌中,Lysobacter含有较高的G+C含量和生物分解活性,能分泌各种抗生素、酶和生物活性物质,并抑制有害细菌的滋生,控制植物疾病.中间锦鸡儿灌丛中,Lysobacter仅出现在灌丛内表层,这对中间锦鸡儿灌丛具有保护作用.诺卡氏菌能够在一定程度上指示土壤肥力的高低,诺卡氏菌越多,土壤肥力越高.本研究结果表明诺卡氏菌属只出现在灌丛内,也说明了灌丛内的土壤肥力高于灌丛外的肥力.
