广州地区福禄桐叶斑病病原鉴定
2018-09-11许俊宽游春平
傅 昱,许俊宽,游春平
(仲恺农业工程学院农业与生物学院,广东 广州 510225)
福禄桐(Polyscias guifoylei)又名南洋参,原产于太平洋诸岛,是五加科南洋参属(Polyscias)常绿灌木或小乔木。福禄桐株型柔美,枝繁叶茂,叶片与茎干独特优美,叶形多变,叶色也各具不同,生长速度快,耐整形修剪,耐旱耐阴,是近几年较为流行的高档室内盆栽观叶植物[1]。近年来福禄桐在我国福建、台湾及两广地区被广泛引种与栽培,目前在我国内地栽培的福禄桐有9种:羽叶福禄桐、南洋森、线叶南洋森、银边圆叶福禄桐、芹叶福禄桐、银边福禄桐、圆叶福禄桐、黄斑圆叶福禄桐和红叶圆叶福禄桐[2]。
随着福禄桐在内地市场的不断推广,其种植量也随之增加,在种植过程中一些病虫害也相继发生。2011年,Nelson等报道了美国夏威夷发生的福禄桐叶枯病,其症状特点是:叶片发病部位初期呈现不规则的半透明水渍状病斑并常有琥珀色的分泌液,病斑后期中部呈棕色,边缘为黑色,病健交界清晰;病斑沿叶脉发生,严重时导致叶片卷曲变黄后脱落[3]。2014年,广州市园艺苗圃场发现有症状类似的福禄桐叶斑病发生,发病率为10%~20%,严重时达30%~50%,广州园艺苗圃场作为广州市园艺植物盆栽的重要来源,福禄桐叶斑病的发生严重影响了该苗圃福禄桐植株的观赏性和经济价值。引起广州地区福禄桐叶斑病的病原与Nelson等报道的是否一致还不清楚。本研究通过对病原菌的形态特征、16S rRNA基因序列以及生理生化性状的分析,确定病原菌种类,为今后福禄桐叶斑病的防治以及病原菌的致病机理研究打下基础。
1 材料与方法
1.1 试验材料
植物材料:2015年6月于广州市园艺苗圃场采集具有典型症状的福禄桐叶斑病植株10株,用于病原菌的分离纯化和病害样本的保存,健康供试植株由广州市园艺苗圃场提供。
培养基:NA培养基、NB培养基和碳源利用培养基参照文献[4-6]配方配制。
试剂:Hucker草酸铵结晶紫溶液、Lugol染液、脱色剂、负染溶液、阳性缓冲液及Lugol’s I液等参照文献[6]配方配制。
1.2 试验方法
1.2.1 病原菌的分离纯化及致病性测定 使用平板划线分离法[7]对采集的福禄桐病叶进行病原菌的分离,将划线后的平板置于28℃培养箱黑暗培养48 h后,对平板上的单菌落进行3~5次纯化,直到得到一致的单菌落。致病性测定采用针刺法[7]进行接种:用灭菌的医用脱脂棉蘸取菌液覆盖在健康福禄桐植株叶片针刺部位,对照接种无菌水,每个处理5次重复,于28℃光照条件下培养,48 h后将覆盖叶片的菌液(或无菌水)去除,对叶片进行保湿培养,每天观察记录发病情况。叶片发病后,对发病叶组织再次进行病原菌的分离纯化,比较接种后分离菌株与原接种菌株的形态异同。
1.2.2 病原菌的分子鉴定 将分离到的菌株转接到NB培养液中,28℃、180 r/min震荡培养48 h,利用东盛生物科技有限公司的细菌基因组DNA快速提取试剂盒提取菌株总DNA。
PCR反应针对细菌的16S rRNA基因,扩增所用引物为 27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-CGGCTACCTTGTTACGAC-3’)[8]。PCR反应体系为25 μL:12.5 μL 的2×Taq PCR Green Mix、5 μL的DNA模板、1 μL的引物27F(5 μmol/L)、1 μL的引物1492R(5 μmol/L)、5.5 μL的ddH2O。扩增反应程序:94℃预热3 min;94℃变性30 s、55℃退火1 min、72℃延伸1 min,35个循环;72℃再延伸7 min;4℃保存。
扩增结束后将PCR产物送至上海英潍捷基贸易有限公司测序。测序结果利用NCBI进行序列对比,并运用MEGA6.0中的NJ(Neighbor-Joining)法构建系统发育树,自展支持率分析采用1 000次重复。
1.2.3 病原菌生理生化鉴定 参照文献[9]进行生理生化性状测定。配制碳源利用培养基,分装试管并灭菌,待培养基冷却到室温时加入经过滤灭菌的被测底物(糖醇类底物终浓度为0.5%~1%,其他底物浓度为0.1%~0.2%),再加入100 μL在NB培养液中培养18~24 h的细菌悬浮液。每种碳源试验设置3次重复,对照不加碳源,于28℃摇床培养48 h。连续接种3代,每一代从上一代的悬浮液吸取100 μL的菌液接种,于相同的条件培养,能生长者表示能利用该碳源。
2 结果与分析
2.1 福禄桐叶斑病症状特点及分离菌株的致病性测定
福禄桐叶斑病发病初期,病叶出现透明的水浸状小点,然后逐渐扩大成椭圆形或近圆形,中央褐色,边缘油渍状;病斑后期中部呈红褐色斑点,中部斑点周围呈黄褐色至黑褐色,病斑边缘有淡黄色晕圈,病斑直径约为4~6 mm,病健交界清晰。有些病斑发生在叶片边缘或叶片顶部,呈半月形或不规则病斑,随着病情加重,病斑继续扩大,叶片卷曲而掉落(图1,封三)。
通过划线分离法,从发病组织中分离出6个细菌菌株:FLT1-6,用针刺法将6个菌株分别回接到健康叶片中,保湿培养48 h后,只有分离物FLT4接种叶片出现水渍状透明病斑,与田间发病初期症状一致,分离物FLT1-3、FLT5-6和无菌水接种的叶片均不产生病斑(图2,封三)。从接种部位再次分离获得的分离物形态特征和分子特征与原接种体FLT4一致。

图1 福禄桐叶斑病田间发病症状

图2 分离物回接后福禄桐叶片发病症状

图3 叶斑病病原菌FLT菌落形态和革兰氏反应特征
2.2 病原菌株的形态特征
FLT4在NB平板上于28℃培养2 d后,菌落呈黄色并明显向上凸起,圆形,边缘光滑,表面湿润,易于挑取,不与培养基粘合,产生臭味,培养基无明显颜色变化,革兰氏阴性菌,单个菌体为杆状,菌体大小为1.4~5 μm×0.5~0.6 μm(图3,封三)。
2.3 病原菌的分子鉴定
利用细菌通用引物27F/1492R对病原菌株FLT4的16S rRNA基因进行PCR扩增,得到片段大小为1 415 bp的扩增产物。将扩增产物序列(GenBank 收录号:KY982974)在GenBank中进行BLAST比对,并用MEGA6.0按照NJ法构建系统发育树,结果(图4)显示,病原菌株FLT4 与X.campestrispv.vesicatoria(GenBank 收录号:AM039952.1)、X.axonopodispv.citrumeloF1(GenBank 收录号:CP002914.1)、X.citripv.strain jx-6(GenBank 收录号:CP011827.1)、X.citrisubsp.citristrain UI7(GenBank 收录号:CP008989.1) 和X.citrisubsp.citristrain NT17(GenBank 收录号:CP008995.1)在同一分支上。

图4 病原菌株FLT4及相关菌株基于16S rRNA序列的NJ系统发育树
根据伯杰氏系统鉴定手册(第2版)[8],柑橘黄单胞菌(X.citri)作为一个变种并入地毯草黄单胞菌(X.axonopodis),野油菜黄单胞菌辣椒斑点病致病变种(X.campestrispv.vesicatoria)也归入到地毯草黄单胞菌(X.axonopodis),既X.campestrispv.vesicatoria和X.citri均为X.axonipodis。
2.4 生理生化鉴定分析
根据病原菌的分子鉴定结果,再参照伯杰氏系统鉴定手册(第2版)[8]对病原菌FLT4的18项生理生化性状进行测定,结果(表1)显示:病原菌FLT4能利用糊精、纤维二糖、乳糖、麦芽糖、6-脱氧-L-半乳糖、D-半乳糖、蜜二糖、丙氨酸、L-丙氨酸和L-丙氨酰甘氨酸与地毯草黄单胞菌(X.axonopdis)一致,相似性达55.56%。
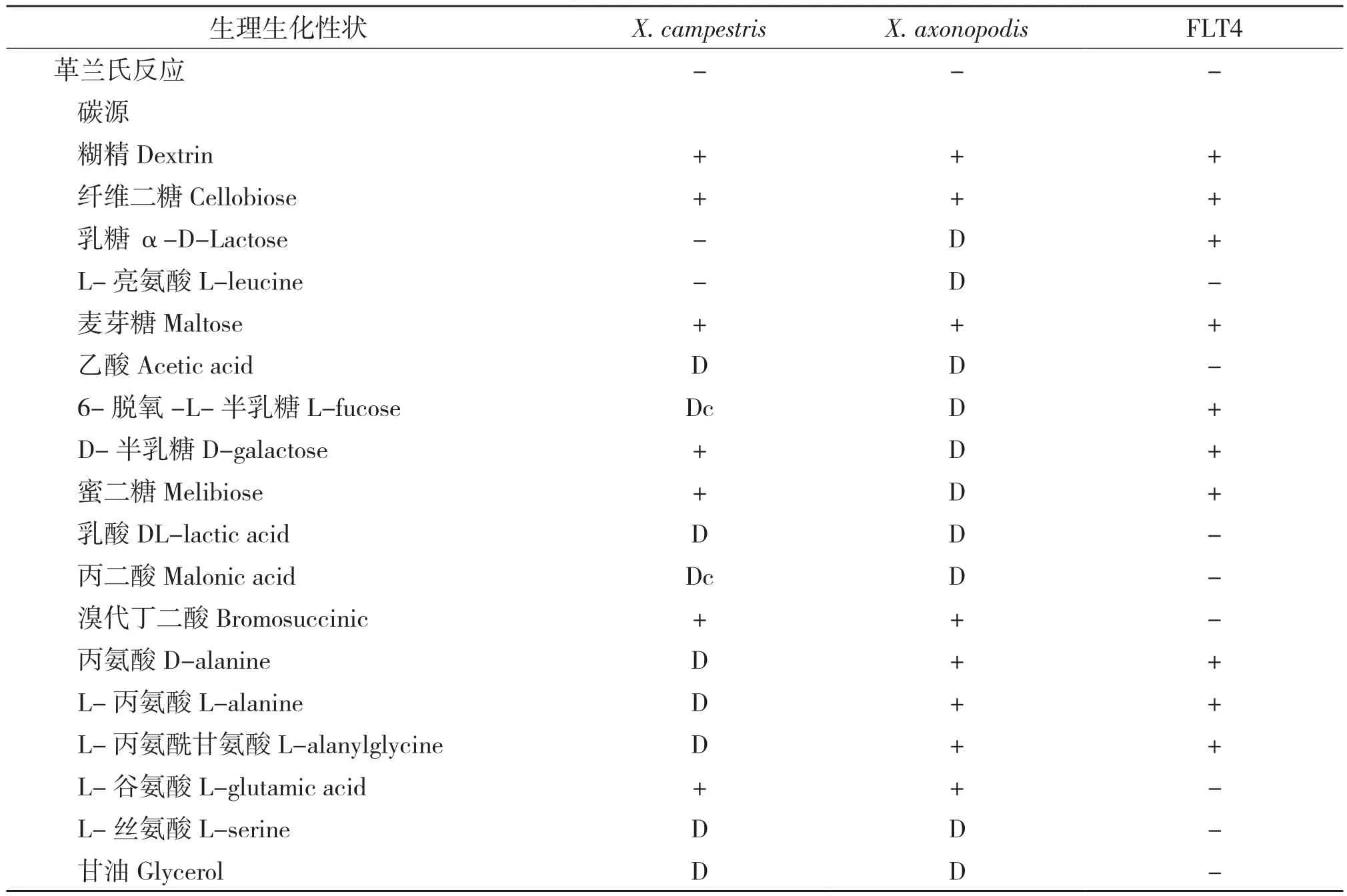
表1 病原菌FLT4生理生化测定结果
3 结论与讨论
叶斑病是植物叶部较为常见的病害,在粮食作物和经济作物上均有发生,但引起发病的病原物却不尽相同,细菌、真菌、病毒等都可能引起叶斑病[10]。本研究通过对病原菌株FLT4的分离纯化和致病性测定,并结合分子生物学鉴定和生理生化测定初步将引起福禄桐叶斑病的病原菌鉴定为地毯草黄单胞(X.axonopodis)。在本研究中,福禄桐叶斑病病斑为透明的水渍状,中央有褐色小点,这与Nelson等[3]所报道的夏威夷福禄桐叶枯病病症类似,但其病斑沿着叶脉发病和病原物为X.campestrispv.hederae,则与本研究不同,可能的原因是采样的地点、季节不同,或存在多种病原菌能引起福禄桐叶斑病的情况。迄今为止,暂未查询到在广州有相同或类似的有关地毯草黄单胞引起福禄桐产生叶斑病的报道,本研究为开展该病的致病机理和抗病机理研究奠定了基础,为该病的防治提供了参考。
据报道,X.axonopodis是多种经济作物和粮食作物的病原物,能引起柑橘溃疡病、木薯细菌性枯萎病、瓜尔豆细菌性疫病、红掌细菌性叶枯病以及绒果桕属植物Mabea fi stulifera和巴西胡椒木叶斑病等多种病害[11-16]。其中,由地毯草黄单胞菌万年青变种(X.axonopodispv.dieffenbachia)引起的红掌细菌性叶枯病在巴西、美国、荷兰、意大利、菲律宾以及我国的海南、广东和云南等地均有大面积发生,X.axonopodispv.dieffenbachia也被欧洲和地中海植物保护组织(European and Mediterranean Plant Protection Organization, EPPO)列入A2检疫生物名单之中[14,16-18];由地毯草黄单胞柑橘致病变种(X.axonopodispv.citri)引起的柑橘溃疡病是影响全球柑橘种植业发展的重大检疫性病害,其病原菌也是国内外的重大检疫性有害生物[19]。
16S rRNA序列在原核生物中高度保守,对该序列进行测定已被广泛应用于细菌的分类鉴定,其技术相对比较成熟,但在一些亲缘关系相近的种或同一种内不同致病变种的鉴定方面还存在一定的局限性[20-21]。本研究中,基于16S rRNA序列构建的系统发育树不能很好的区分黄单胞菌中不同致病变种的亲缘关系,需通过对病原菌生理生化性状的鉴定来进一步确定病原菌的种类。但生理生化鉴定结果很难具体确定到病原菌的致病变种,因此,需进一步对病原菌的特定序列进行测定,并对病原菌的种内遗传分化进行深入研究。
