农大5号钙果叶片芽诱导及其植株再生研究
2018-09-11韩向峰李志芳张海平程小爱
韩向峰,李志芳,曹 琴,张海平,程小爱
(1.佛山市农业科学研究所,广东 佛山 528145;2.山西农业大学园艺学院,山西 太谷 030800;3.定襄县国有林场,山西 定襄 035400;4.太谷县农业委员会,山西 太谷 030800)
钙果,种名欧李(Cerasus humilisBunge),果实中含有丰富的维生素、矿物质、蛋白质和各种氨基酸,每100 g含钙量达60 mg,被称为天然的补钙水果[1-6]。山西农业大学经过近30年的研究,已选育出农大4号、农大5号等系列优良品种,为钙果的人工栽培提供了丰富的良种资源。采用组织培养可以迅速扩大良种苗木,由于钙果树体矮小、结果早,离体再生技术不仅可以繁育良种苗木,还可作为基因转化、功能基因验证提供一种适宜于果树的模式植物,为果树的品种改良提供有效的生物技术途径。目前,关于钙果诱导器官分化、再生的研究已有一些报道[3,5],但在品种、外植体来源、辅助处理、炼苗移栽等方面还不够完整。本研究从钙果叶片诱导不定芽、芽的继代增值、生根和驯化移栽成苗到最终建立完整的无性繁殖体系进行试验,为完善钙果植株再生体系研究奠定理论基础。
1 材料与方法
1.1 试验材料
2011年将山西农业大学园艺研究所温室中的农大5号钙果2年生苗及其组培实验室中的组培继代苗、壮苗引种到佛山市农科所的温室和组培室。
1.2 试验方法
1.2.1 外植体的处理 从温室中取2年生农大5号钙果苗新梢顶端2~3片刚展开的嫩叶,放入烧杯。叶片经75%酒精30 s和2%次氯酸钠2 min消毒后,用无菌水再清洗3~4次,置于无菌滤纸吸干表面水分,叶片切去边缘,并切去与灭菌剂接触过的一段叶柄,接入培养基中。直接切取组培瓶中的继代苗和壮苗中上部已展开的叶片用于试验培养。
1.2.2 叶片诱导不定芽培养基的筛选 基本培养基为MS培养基,日常光照时间为14 h/d,光照强度2 000 lx左右,培养温度24(±2)℃。
(1)不同生长调节物的筛选。采用培养基 IAA(0、0.05、0.1 mg/L),NAA(0、0.05、0.1 mg/L),6-BA(0.8、1.0、1.2 mg/L), 培养基〔MS、1/2MS(半)、1/2MS(全)〕4因素3水平正交试验设计,共9个处理,每个处理接种5~6瓶,每瓶放3~4个叶片,两次重复,其中1/2MS(半)指MS的大量元素用量减半;1/2MS(全)指MS的全部元素用量减半。将叶片灭菌后去其边缘,在与叶片主脉垂直方向横切两刀,使其边缘相连,内部均分为3部分后叶背向上放置于培养基上。观察叶片的动态变化,调查发生愈伤组织和不定芽诱导的情况。
(2)AgNO3、照光、叶片放置方式、部位等因素筛选。以不定芽诱导率较高的8号和6号培养基为基础,将叶片去头去尾,再切掉边缘,将叶片均匀切成叶尖、叶中和带一点叶柄的叶基3部分。设置AgNO3(0、0.1、0.2 mg/L)、照光(全光照、暗培养、无光照)、放置方式(正放、反放、侧放)、部位(叶基、叶中、叶尖)4因素3水平正交试验,其中正放指叶背接触培养基;反放为指叶面接触培养基;侧放指与主脉相平行的叶缘一边垂直插入培养基中一半,共9个处理,每个处理两个重复,每个重复6瓶,接种30 d后,观察其诱导效果,计算诱导率。
芽诱导率(%)=再生出不定芽的外植体数/接种的外植体总数×100
1.2.3 叶片诱导出不定芽的继代培养 将叶片诱导出的不定芽先在MS+IAA 0.05 mg/L培养基中壮苗后,再接种到MS+6-BA 0.05 mg/L+IAA 0.05 mg/L培养基上循环壮苗,观察其芽苗生长状态。将经过壮苗的茎段和茎尖转接到MS+6-BA 0.2 mg/L培养基上分化培养,两次重复,每次重复接种30个高约1 cm的健壮继代茎段,20 d后调查其总增殖数、增殖率、分化芽的健壮情况及其可利用程度。

1.2.4 叶片再生不定芽的生根培养 叶片再生不定芽在MS+6-BA 0.05 mg/L+IAA 0.05 mg/L培养基上培养22 d后,选长势健壮的茎段部分进行继代培养,部分截取1.5 cm左右茎尖接种到生根培养基:1/2MS+IAA 1.2 mg/L,2次重复,每个重复接种5瓶,每18根一瓶,15 d后调查其生根率。

1.2.5 叶片再生植株的炼苗与移栽 (1)第一阶段:光培炼苗、闭瓶炼苗和开瓶炼苗。组培苗在生根培养基上培养约15 d后,根系长到0.5~1.0 cm,将生根苗玻璃瓶移入室温25~28℃、光照5 000~8 000 lx的温室进行光培闭瓶炼苗。10 d后生根苗有新叶长出,叶片变大增厚,根系长到约3 cm,植株已复壮。此时将封口膜打开进行开瓶炼苗。将1 000倍的多菌灵液加入生根苗瓶内,杀菌液的高度约0.5 cm,在室温25~28℃、光照5 000~8 000 lx条件下开瓶炼苗2~3 d。炼苗过程中,对炼苗温室也要进行杀菌消毒。
(2)第二阶段:基质炼苗。瓶内炼苗后,将生根苗轻轻从玻璃瓶取出,用1 000倍多菌灵液清洗消毒后移栽到消过毒的基质(深层土:泥炭:河沙:珍珠岩)中,浇透水,并扣小拱棚,上面加盖遮阳网,约40 d后,幼苗基本由异养为主变成自养能适应温室环境,完成驯化过程。
(3)第三阶段:营养杯炼苗。基质炼苗后,苗长5~8 cm,当基部开始半木质化,根系变为褐色,有大量的毛细跟产生时,将幼苗移栽到营养杯中,浇透水,并扣小拱棚缓苗一周。之后去掉小拱棚,小苗开始快速生长。约30 d炼苗生长后,去掉营养杯,带上土坨定植到大田中,进行正常的田间管理。最后调查炼苗移栽成活率。

试验数据采用邓肯方差分析进行处理。
2 结果与分析
2.1 叶片诱导不定芽的动态变化
钙果叶片在接种3 d弯曲隆起开始启动,叶柄部位开始逐渐膨大。培养10 d左右,叶柄伤口部位和主脉伤口部位产生少量愈伤,同时从叶柄的形成层处与产生愈伤的结合处出现绿色芽点,有的从膨大叶柄上分化出绿色芽点,有的从愈伤组织中分化出绿色芽点。3 d左右即可看到幼小的芽体长出,从小芽体周围分化出簇状幼芽,并不断增多,一个诱导部位最多可以分化30多个芽体,但芽的质量有强弱之分。其次产生芽的部位为叶片中部主脉伤口处,且几乎都是从叶背上诱导出芽。诱导出芽的时间主要集中在接种后10~15 d,约有90%的不定芽都在此时间段内诱导出来,且多数不定芽较壮,但部分芽出现了玻璃化现象(图1,封二)。此后仍有少量芽继续从叶片边缘或其他部位产生,但一般诱导出的不定芽较弱。
2.2 培养基和不同植物生长调节剂对叶片诱导芽再生的影响
2.2.1 温室叶片诱导芽 从表1可以看出,8号处理的不定芽再生诱导率平均达41.05%,6号处理次之,平均诱导率为31.6%,其他处理均较差。由极差分析可知,培养基是影响不定芽诱导的主要因子。各因素的主次关系为培养基>NAA>6-BA>IAA,最佳培养基及激素配比为1/2MS(全部元素减半)+IAA 0.1 mg/L+NAA 0.05 mg/L+6-BA 0.8 mg/L,即8号处理最佳。次之为1/2MS(大量元素减半)+IAA 0.05 mg/L+NAA 0.1 mg/L+6-BA 1.0 mg/L(与6号处理中的6-BA稍有差异)。
通过上述分析,筛选出钙果温室叶片诱导不定芽的最佳培养基为1/2MS(全部元素用量减半),其次为1/2MS(大量元素用量减半),生长调节剂配比为IAA 0.1 mg/L、NAA 0.05 mg/L和6-BA 0.8 mg/L,其次为IAA 0.05 mg/L、NAA 0.1 mg/L和 6-BA 1.0 mg/L。
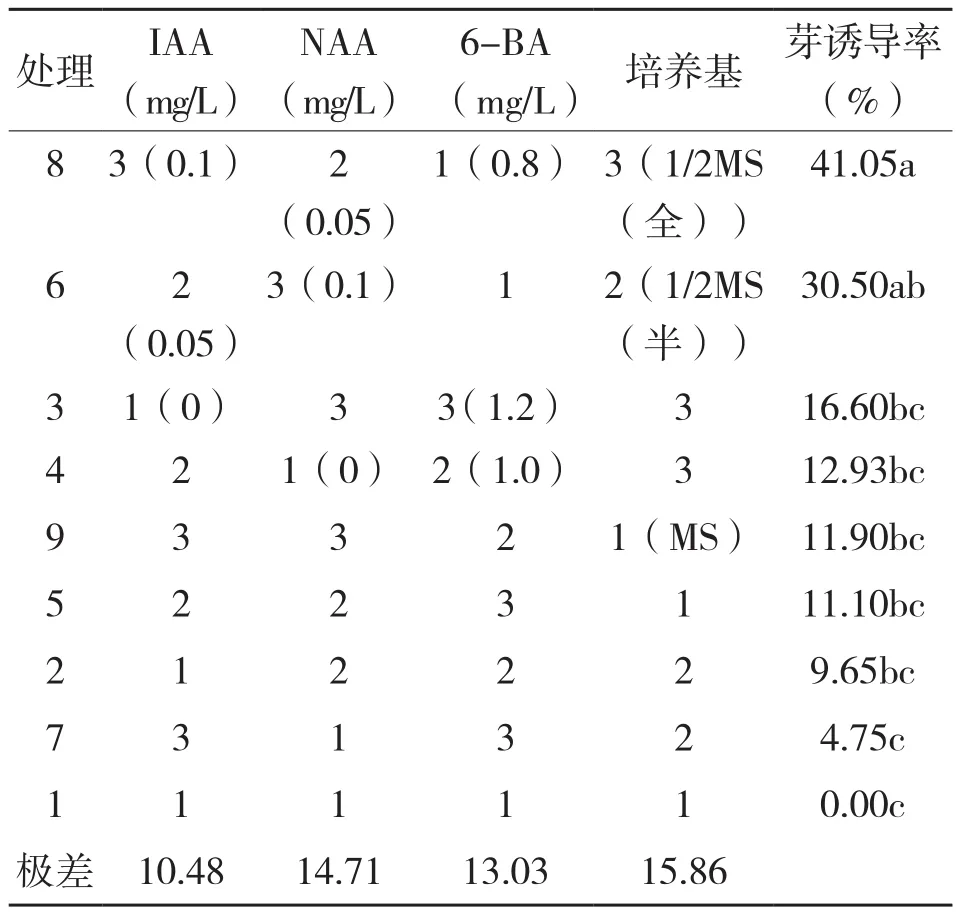
表1 培养基和植物生长调节剂对温室叶片的芽诱导
2.2.2 组培继代分化苗叶片诱导芽 从表2可以看出,9个处理组合的不定芽再生诱导中,6号处理最好、平均诱导率达44.38%,最高达68.75%。由极差比较可知,IAA的极差最大,是影响继代分化苗叶片不定芽再生的主要因子。各因素的主次关系为:IAA>培养基>NAA>6-BA,本试验中最佳培养基及植物生长调节剂配比为:1/2MS(大量元素用量减半)+ IAA 0.05 mg/L+ NAA 0.1 mg/L+6-BA 0.8 mg/L,即6号处理。

表2 培养基和植物生长调节剂组合对分化苗叶片的芽诱导
2.2.3 组培继代壮苗叶片诱导芽 从表3可以看出,9个处理组合的不定芽再生诱导中,6号处理最好,平均芽诱导率为25.66%。由极差比较可知,NAA的极差最大,是影响继代壮苗叶片不定芽再生的主要因子。各因素的主次关系为NAA>IAA>培养基>6-BA,本试验中最佳培养基及植物生长调节剂配比为:1/2 MS(大量元素减半)+IAA 0.05 mg/L+NAA 0.1 mg/L+6-BA 0.8 mg/L,即6号处理。
可见,尽管叶片来源不同均可以诱导出不定芽。适合于温室叶片诱导不定芽再生的最佳培养基为1/2MS(全部元素减半)+IAA 0.1 mg/L+NAA 0.05 mg/L+6-BA 0.8 mg/L,即8号处理。其最高诱导率为42.1%,影响此类叶片不定芽诱导因素的主次关系为培养基>NAA>6-BA>IAA,各因素水平影响诱导效果的顺序依次为NAA>培养基>6-BA>IAA。适合组培继代苗和壮苗叶片诱导不定芽再生的最佳培养基为1/2MS(大量元素减半)+IAA 0.05 mg/L+NAA 0.1 mg/L+6-BA 0.8 mg/L,即6号处理。不管分化苗还是壮苗,影响不定芽诱导的最主要因子均为生长素类,最次的因素为细胞分裂素6-BA。

表3 培养基和植物生长调节剂对壮苗叶片的芽诱导
2.3 AgNO3、光照、放置方式、部位等处理组合对诱导不定芽的影响
2.3.1 在6号培养基中对芽再生的影响 从表4可以看出,处理9的不定芽诱导率最好,即在培养基中添加0.2 mg/L AgNO3、用带一段叶柄的叶基部位、反放,无光条件下培养,平均诱导率达25%,其最高诱导率为35%;处理7次之,平均诱导率达20.0%;极差比较可知,AgNO3是影响6号培养基不定芽诱导率的主要因素。同时看出,影响因素的主次关系为:AgNO3>放置方式或叶片部位>光照。可见,处理组合为在全光照条件下,以带叶柄的叶基部分为材料,AgNO30.2 mg/L,将叶片反放在6号培养基上最佳。

表4 6号培养基不同处理组合对芽再生的影响
2.3.2 在8号培养基中对芽再生的影响 从表5可以看出,处理9组合的不定芽诱导率表现最好,即在培养基中添加0.2 mg/L AgNO3、采用无光、叶片反放、用带一段叶柄的叶基部位处理的平均诱导率达22.5%,其最高诱导率为25%;极差比较可知,叶片部位的极差最大,是影响8号培养基不定芽诱导率的主要因素。影响因素的主次关系表现为:叶片部位>放置方式>AgNO3>光照,最佳处理组合为:在暗培养条件下,以带叶柄的叶基部分为材料,AgNO30.2 mg/L,叶片反放在8号培养基上,与9个处理组合在6号培养基上的最佳组合结果基本一致,但不同的是在8号培养基上的芽诱导率整体上没有在6号培养基的高,可能是因为NAA对诱导芽的作用较IAA好。

表5 在8号培养基上不同处理组合对芽再生的影响
综上可知,4个影响不定芽诱导率的因素中,叶片部位、叶片放置方式和AgNO3均影响不定芽再生,且处理水平也一致,均为带叶柄叶基、叶片反放、AgNO3均为0.2 mg/L。而光照条件影响最小,各水平之间无显著性差异。
2.4 叶片再生不定芽的继代、生根培养与驯化培养
由试验结果可知,农大5号不定芽在继代培养中平均增殖率为2.97%,且芽苗多数都生长短粗、健壮,无玻璃苗产生;在生根培养中平均生根率为89.17%,最高生根率达到90%,生根条数均在2条以上,长势良好(图2,封二)。农大5号炼苗成活率高达到77.5%,可见钙果组培苗的适应性非常强。
3 结论与讨论
已有研究表明,硝酸银可抑制乙烯的合成,促进愈伤组织再生芽的能力,可以增加外植体产生不定芽的数目及提高植株再生频率[6-9]。本试验结果表明,相对于其他试验因素而言,硝酸银对不定芽再生有较大影响,这与前人分析结果一致,但对于不定芽诱导率的整体提升表现效果不明显。暗培养或弱光条件有利于诱导细胞分裂,可以提高叶片再生[5,10-11]。在叶片诱导愈伤组织的预实验中,也发现叶片在弱光或光暗培养下诱导愈伤组织产生的时间较全光照提前3~5 d,且愈伤组织在相同时间段产生的量也较全光照条件下多,这与多数报道的结论一致。本试验中用叶片直接诱导不定芽的试验结果表明,光照条件对叶片再生试验的影响都不显著,且不定芽的再生也未见明显提高。
本试验结果表明,带叶柄的叶基再生不定芽的能力最强,与师校欣等在樱桃砧木离体培养中得出的结论[12-20]一致。关于叶片的放置方式,一般认为双子叶植物叶背面有大量气孔,叶背面与培养基接触,有利于营养吸收,因此,采用叶背接触培养基较多。在本试验中,叶片正面接触培养基明显的较叶背面接触培养基效果好。因此叶片的放置方式对诱导不定芽的影响,也可能因不同的树种而有所差异。其他树种(如苹果、海棠、草莓、梨、黄杨等)上也有类似现象。
本试验仅对MS培养基元素添加的量进行了研究,未涉及其他类型的培养基,其后可以继续研究。就MS培养基来说,以全部元素或大量元素减半为好。就植物生长调节剂来看,生长素对芽的诱导要比细胞激动素更为重要,因此,对于钙果芽诱导,细胞激动素的浓度应相对固定,应更多考虑调配生长素如NAA、IAA的浓度。
组培苗是在人工控制条件下生长,移出试管后即由异养转为自养,环境条件的剧烈变化,影响着组培苗的成活率。组织培养苗能否大量应用于生产,特别是木本植物能否取得好的效益,取决于组培苗能否有高的成活率,对移栽的基质、温度、湿度及光照等都要加以严格控制。

图1 钙果叶片直接诱导不定芽

图2 钙果叶片诱导不定芽的增殖(A)、生根(B)与炼苗(C)
