miR-26a在溃疡性结肠炎中的表达及对自噬的影响
2018-09-11曹勇王东旭孙妍杨俊张营郑长清
曹勇,王东旭,孙妍,杨俊,张营,郑长清
(中国医科大学附属盛京医院第二消化内科,沈阳 110004)
炎症性肠病 (inflammatory bowel disease,IBD)是肠道的慢性非特异性炎症性疾病,主要包括2种独立性疾病,即克罗恩病和溃疡性结肠炎 (ulcerative colitis,UC) 。疾病以药物治疗和外科干预为主,但容易反复发作。如何干预其炎症的发生和进展,是目前临床研究的主要方向。肠黏膜屏障功能异常在IBD发生发展中起到至关重要的作用。肠黏膜屏障功能异常时,肠道上皮层缺损、肠道通透性增加、黏膜屏障破坏、损伤、溃疡。自噬作为真核细胞中高度保守的维持内环境稳态和适应微环境改变的一种方式,其改变与IBD息息相关。自噬是细胞在外界条件变化、各种理化因素改变及不利因素刺激时发生的一种保护性机制。自噬可将胞内“废物”如变性的蛋白质、老化及受损的细胞器、甚至病原微生物运输到溶酶体降解,实现物质的循环再利用,并维持细胞的稳态。目前有研究[1]表明,肠道上皮细胞自噬的降低可以导致自噬清除细胞内细菌的功能障碍,炎症环境下肠道上皮细胞的黏附能力下调,黏膜屏障功能受损。
随着基因组计划的完成,在人类基因中虽然非编码RNA并不参与蛋白编码,但却能够通过影响编码的过程调控蛋白的表达,从而影响各种生物学行为。microRNA (miRNA) 作为非编码RNA中的一员,可以从转录后水平影响蛋白的合成。近年来多项研究[2-4]表明,多种miRNA在UC患者的肠道组织、血清、粪便中异常表达。miRNA可通过对下游靶基因表达的调控,影响机体免疫系统的发育和分化,参与机体慢性炎症反应。此外,miRNA在细胞自噬发生过程的不同阶段中也起到重要的作用[5-7]。但miRNA是否参与UC的自噬异常,目前鲜有报道。本研究通过实时PCR、Western blotting、流式细胞技术以及细胞转染等实验手段,证实了miR-26a在UC组织中呈高表达趋势,且miR-26a能够促进UC细胞的自噬发生,从而为UC的病因预防、早期诊断、有效治疗提供理论依据及新的思路。
1 材料与方法
1.1 标本收集和研究对象
30例组织样本选取自2016年1月至2017年10月间于中国医科大学附属盛京医院诊断为UC的患者,其中男性19例,女性11例,年龄20~65岁,中位年龄39.4岁。同时选取相同时间段内结肠镜和显微镜检查排除UC的正常对照者30例,其中男17例,女13例,年龄23~67岁,中位年龄44.5岁。所有受试者均签署知情同意书,并通过医院伦理委员会审核。
1.2 细胞培养及转染
细胞选用人类结肠癌上皮细胞系Caco-2 (中国科学院细胞研究所) ,细胞密度保持在1×105/mL,培养基选用DMEM+10%胎牛血清,培养在37 ℃、5% CO2的条件下。将Caco-2细胞接种于6孔板,分为miR-26a mimics转染组、miR-26a inhibitors转染组及空载质粒组;待细胞融合至70%~80%,应用脂质体Lipofectamine 2000分别将空质粒和重组质粒转染入细胞。按照说明书,250 μ L无血清培养基分别加入5 μ g DNA及5 μ L脂质体Lipofectamine 2000,混匀室温静置5 min,混合2管溶液并室温放置10 min,加入细胞培养基中,孵箱培养4~6 h后更换为含10%胎牛血清培养液,继续培养24 h后进行后续实验。
1.3 实时PCR
按照Invitrogen公司的Trizol reagent说明书,从上述组织及培养的细胞中提取总RNA,应用cDNA反转录试剂盒反转录为cDNA。在ABI 7500实时荧光定量PCR仪中进行反应,反应条件:94 ℃ 10 s,60 ℃ 30 s,68 ℃ 2 min,共40个循环,以U6小核RNA为内参,采用 2-ΔΔCt方法定量,计算 miR-26a 的相对表达量。
1.4 流式细胞仪检测细胞凋亡
应用预冷PBS清洗上述各组细胞,用不含EDTA的胰酶消化细胞,收集5×106个细胞。加入500 μ L Binding Buffer悬浮细胞,加入5 μ L FITC标记的Annexin-V (20 μ g/mL) 混匀,加入5 μ L混匀;室温避光5~15 min,即进行流式细胞仪检测。
1.5 Western blotting
细胞蛋白提取使用M-PER哺乳动物蛋白提取试剂盒 (美国Pierce Biotechnology公司) 。蛋白浓度测定使用BCA 蛋白试剂盒 (美国Pierce Biotechnology公司) ,蛋白质 (100 μ g) 采用SDS-聚丙烯酰胺凝胶电泳分离,并转移到聚偏二氟乙烯膜上 (美国Millipore公司) 。然后5%脱脂牛奶和TBST室温下培育2 h,用封闭液封闭2 h或4 ℃封闭过夜;分别加入一抗LC3Ⅱ、 p62、 β-actin,4 ℃温育过夜,TBST 洗3次,每次10 min;加入辣根过氧化物酶标记的二抗 (1∶2 000) 室温孵育2 h;TBST洗3次,每次10 min;加入ECL化学发光试剂A、B各1 mL,暗室中进行显影。应用Image J软件分析图像。
1.6 统计学分析
2 结果
2.1 UC中miR-26a呈高表达
提取UC患者组织及血清中总RNA,以正常对照者为对照组,应用实时PCR检测miR-26a相对表达情况,结果显示,UC患者组织及血清中miR-26a表达明显高于正常对照者 (P < 0.05) 。见图1。
2.2 miR-26a对Caco-2细胞凋亡的影响
在Caco-2细胞系中应用miR-26a mimics及miR-26a inhibitors过表达/敲低miR-26a的表达,应用实时PCR检测转染效率 (P < 0.05,图2A) ,应用流式细胞技术检测 Caco-2细胞凋亡情况。Caco-2细胞转染miR-26a mimics 48 h后,细胞转染组凋亡率为(14.5±1.74) %,明显高于对照组的凋亡率 (5.2±1.1) %,差异有统计学意义 (P < 0.05,图2B) 。Caco-2细胞转染miR-26a inhibitors 48 h后,细胞转染组凋亡率为(3.1±0.87) %,明显低于对照组的凋亡率 (5.8±1.2) %,差异有统计学意义 (P < 0.05,图2C) 。实验结果表明,miR-26a过表达可明显促进Caco-2细胞凋亡。
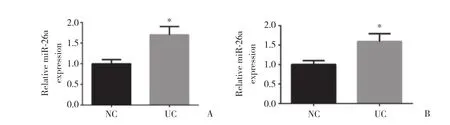
图1 实时PCR检测UC患者和正常对照者组织及血清中miR-26a的相对表达Fig.1 miR-26a expression in the tissue and serum samples of patients with ulcerative colitis and normal controls was determined using real-time PCR
2.3 miR-26a对Caco-2细胞自噬的影响
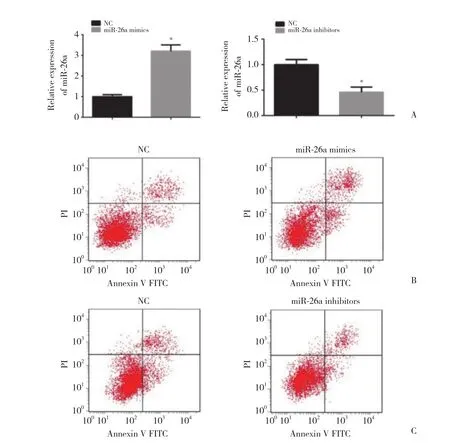
图2 流式细胞技术检测miR-26a对Caco-2细胞凋亡的影响Fig.2 Effect of miR-26a on apoptosis of Caco-2 cells was detected by flow cytometry
应用Western blotting分别检测过表达/敲低miR-26a的Caco-2细胞自噬标记蛋白LC3-Ⅱ/LC3-Ⅰ及p62。与空载质粒组相比,过表达miR-26a后,Caco-2细胞的LC3-Ⅱ表达明显降低,且p62表达明显升高,结果表明,过表达miR-26a抑制了Caco-2细胞自噬的发生 (P < 0.05,图3A) 。而敲低miR-26a表达后,Caco-2细胞的LC3-Ⅱ表达明显升高,且p62表达明显降低,结果表明,敲低miR-26a表达促进了Caco-2细胞自噬的发生 (P < 0.05,图3B) 。上述实验结果表明,miR-26a与Caco-2细胞自噬激活呈正相关。
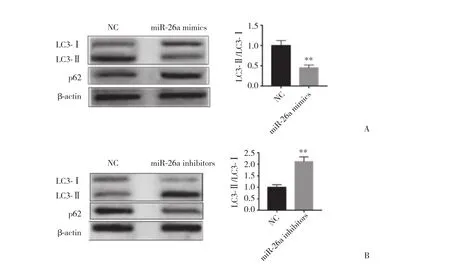
图3 Western blotting检测过表达/敲低miR-26a的Caco-2细胞中LC3-Ⅱ/LC3-Ⅰ及p62蛋白表达Fig.3 Effect of miR-26a overexpression/knockdown on LC3-II/LC3-I and p62 expression in Caco-2 cells was detected by Western blotting
3 讨论
UC是肠道的慢性非特异性炎症性疾病,属于IBD的一种。正常情况下,肠上皮细胞构成肠道物理屏障,上皮细胞间的紧密连接有助于肠道细胞的稳定并对抗共生细菌的可靠屏障。肠上皮细胞调节失调会损害屏障功能,导致细胞外渗增加和抗原暴露,继而造成持续有害刺激,急性炎症可能成为慢性炎症[8-9]。在此过程中,往往伴随着肠上皮细胞miRNA表达的改变,说明miRNA在此过程中起到了重要的作用[4,10-13]。SCHAEFER等[14]在IBD患者的唾液中测试了miRNA的概况,发现miR-101在克罗恩病患者唾液中表达升高,而miR-21、miR-31和miR-142在UC患者中升高。本研究发现,miR-26a的表达在UC患者组织及血清中明显升高。UC的肠黏膜屏障功能失调是多个环节、多个因素共同导致的,最终使肠道免疫失衡[15]。
目前的研究[16]表明,UC发生时,肠道上皮细胞往往伴随着凋亡增加,最终造成肠上皮通透性增加和肠上皮屏障损伤;而同属于程序性坏死形式的自噬,是细胞受到外界条件变化、各种理化因素改变及不利因素刺激时发生的一种保护性机制。在IBD患者肠道上皮的屏障功能失调过程中,自噬往往具有重要作用[17]。研究等[18]发现,在IBD患者的肠上皮细胞中,miR-196能够通过调节IRGM的表达,抑制自噬,最终导致肠道上皮屏障功能的失调。有研究[19]表明,自噬相关基因ATG16L1基因单核苷酸多肽性位点rs2241880 (T300A) 与欧美人群IBD发病相关。亦有研究[20-21]表明中国和韩国人群IBD发病亦与T300A相关,提示T300A可能在亚洲IBD患者的易感性中发挥作用。近期PAIVA等[22]发现,结肠组织中自噬相关蛋白LC3Ⅱ和p62的表达与UC患者行复原性全结直肠切除并回肠储袋肛管吻合术后并发储袋炎相关。上述研究均表明,肠上皮细胞自噬的异常与UC的黏膜屏障功能异常息息相关。
为了探究miR-29a是否参与了UC相关肠上皮细胞的自噬失调,本研究过表达/敲低Caco-2细胞的miR-29a的表达,应用流式细胞仪检测Caco-2细胞凋亡情况,应用Western blotting检测自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ及p62的表达情况。结果表明,过表达组Caco-2细胞的凋亡明显增加,而自噬明显减少;敲低组Caco-2细胞的凋亡明显减少,而自噬明显增加;这些结果表明,miR-26a确实能够抑制UC相关肠上皮细胞的自噬。而miR-26a是否通过抑制UC相关肠上皮细胞自噬进而使肠上皮细胞黏膜屏障功能失调,还需要进一步的研究验证。
综上所述,UC的发生、发展与miR-26a的表达上调密切相关,但其中具体的机制有待进一步研究证实,进而为UC的临床治疗提供潜在的理论支持。
