亚致死剂量高效氯氰菊酯对蚯蚓体内生化指标的影响
2018-09-10赵丽倩仇爱锋纪伟陈子雷庄惠生
赵丽倩, 仇爱锋, 纪伟, 陈子雷, 庄惠生
亚致死剂量高效氯氰菊酯对蚯蚓体内生化指标的影响
赵丽倩1, 2, 仇爱锋2, 纪伟2, 陈子雷3, 庄惠生1*
1. 上海交通大学环境科学与工程学院, 上海 200240 2. 浙江清华长三角研究院, 浙江,嘉兴 314006 3. 山东省农业科学院农业质量标准与检测技术研究所, 山东,济南 250100
采用接触滤纸法, 测定蚯蚓经亚致死剂量高效氯氰菊酯染毒24 h、48 h和72 h后其体内蛋白含量、超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力和丙二醛(MDA)含量的变化, 探讨不同染毒时间和暴露浓度对蚯蚓的毒性效应。结果表明, 在高效氯氰菊酯亚致死剂量下, 染毒24 h时蛋白含量在50 mg·L-1达到最大值, 而染毒72 h时蛋白含量在5 mg·L-1达到最大值, 表现为短时间内促进蛋白合成而长时间下抑制。高效氯氰菊酯对SOD和CAT活力的诱导作用明显, SOD活力在低浓度激活, 高浓度抑制; CAT活力呈现出先升高后降低的趋势; MDA含量诱导作用不明显, 短时间内随暴露浓度升高而升高, 但随染毒时间延长趋于正常水平。因此SOD和CAT可作为蚯蚓受到氧化胁迫的指示指标, 而MDA无法作为指示指标。此外, 各生化指标对高效氯氰菊酯毒性效应的敏感性存在差异, SOD活力影响最大, CAT次之, MDA最小。
高效氯氰菊酯; 蚯蚓; 蛋白含量; 抗氧化酶; 丙二醛含量
1 引言
农业生产中不可避免需要使用农药提高农作物产量, 农药残留是施用农药后的常见现象[1]。拟除虫菊酯是一类仿生合成的广谱杀虫剂, 能够防治多种害虫, 且杀虫毒效比有机磷、有机氯和氨基甲酸酯类高10—100倍[2]。高效氯氰菊酯(Beta-cypermethrin), 是一类典型的拟除虫菊酯类杀虫剂, 不溶于水, 但溶于有机溶剂, 对动物具有神经毒性。关于高效氯氰菊酯的毒性机制目前尚未完全了解, 国际上主要有两种观点, 一种认为拟除虫菊酯直接同神经膜上Na+通道相互作用而产生毒性[3]; 另一种认为存在其它的靶标或作用点。我国学者普遍认同第一种观点。相关研究表明, 施用拟除虫菊酯类农药后, 仅有1%—2%的药物发挥有效作用成分作用, 余下均进入环境中[4], 致使环境中农药的大量残留, 引起环境污染与食品安全等相关问题。
近年来, 农药对环境危害研究主要着眼于陆生和水生动物[5-8]。蚯蚓作为典型的土壤动物, 其活动可改善土壤结构, 提高土壤透气性及土壤中有机成分的降解转化, 还可作为土壤污染评价的指示生物[9]。此外, 蚯蚓处于陆生食物链底层, 可富集多种重金属和农药, 再通过食物链传递影响高营养级生物。在土壤毒理实验中, 试验蚯蚓的选择对于研究农药对蚯蚓毒性的强弱具有极其重要性[10]。关于高效氯氰菊酯对蚯蚓体内的蛋白质含量和抗氧化酶活力的研究鲜有报道。生物机体内自由基的氧化与抗氧化酶通常处于动平衡状态, 当体内自由基的清除酶和非酶系统被破坏, 这种动平衡失调时, 会导致机体损伤, 所以细胞内抗氧化酶活性改变与膜脂质过氧化损伤被认为是污染物作用的结果。因此, 抗氧化酶活力的变化是体现机体抗氧化能力的重要指标[11]。
本研究选取赤子爱胜蚓作为受试生物, 研究亚致死剂量下蚯蚓体内蛋白质含量、超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力和丙二醛(MDA)含量的变化, 探讨高效氯氰菊酯对蚯蚓的毒性效应, 以进一步认识高效氯氰菊酯的环境毒性, 为制定农药环境安全标准提供科学依据。
2 材料与方法
2.1 试验动物
赤子爱胜蚓(), 购自南京某专业蚯蚓养殖场, 对不同污染物具有中等敏感性(例: 铜染毒2 d、7 d和14 d后, 铜与MDA含量的相关系数分别为0.760、0.672和0.544)。试验前经实验室预培养一段时间, 选择2 月龄以上、体形相似、体重约为200—300 mg, 生殖环带明显的性成熟的成年蚯蚓用于毒性试验。试验正式开始前, 按OECD准则方法[12], 利用氯乙酰胺检查敏感性, 从中挑选14 d LC50值在10—50 mg·kg-1dw范围内的蚯蚓进行试验。
2.2 试验试剂
99.5% 丙酮, 购自杭州双林化工试剂厂, 分析纯; 99.1% 高效氯氰菊酯标准样品, 购自上海市农药研究所。考马斯亮兰蛋白测定试剂盒、SOD、MDA和CAT测定试剂盒, 均购自南京建成生物工程研究所。
2.3 实验仪器
玻璃培养皿(d=9 cm); 恒温培养箱(SPX-290, 上海比郎仪器有限公司); 冷冻离心机(H3018DR, 上海知信实验仪器技术有限公司); 紫外分光光度计(Cary 100 UV-Vis, 安捷伦(中国)有限公司); 均质搅拌机(FJ200-S, 杭州齐威仪器有限公司); 雪花制冰机(MINI 20, 上海比郎仪器有限公司); 恒温水浴锅(DKS-28, 嘉兴市中新医疗仪器有限公司); 超纯水器(UPWS-I-20T, 杭州永洁达净化科技有限公司)。
2.4 试验农药质量分数设计
由高效氯氰菊酯的急性毒性试验结果可得, 赤子爱胜蚓的72 h 最高不致死浓度为50 mg·L-1, 据此设定高效氯氰菊酯的浓度分别为 5 mg·L-1、10 mg·L-1、20 mg·L-1、40 mg·L-1、50 mg·L-1。
2.5 试验方法
2.5.1 样本预处理
选择性成熟的成年蚯蚓, 用超纯水洗净表面土壤后放入底部铺有滤纸并润湿的1 L烧杯中, 用保鲜膜封口并扎孔, 将烧杯置于(20 ± 1)℃, 湿度为80%—85%的恒温培养箱中, 于暗处培养一昼夜, 用于去除蚯蚓肠道内杂物等[13]。
2.5.2 染毒试验
在直径为9 cm的玻璃培养皿中垫入直径为9 cm双层双圈定性滤纸备用。试验时分别加入4 mL相应浓度的农药试验溶液, 需注意将其均匀淋洒于双层双圈定性滤纸上。将培养皿在通风橱中通风10 h, 待丙酮挥发后, 吸取4 mL的超纯水均匀地润湿滤纸。
染毒试验时, 用超纯水将清肠的蚯蚓冲洗干净, 并用滤纸吸干其表面水分。在每个添加好试验农药的玻璃培养皿中放入5条蚯蚓。然后在玻璃培养皿的盖子内侧垫入已用3 mL超纯水均匀润湿的直径为11 cm的双圈定性滤纸, 将玻璃培养皿盖好以保证在72 h的试验过程中蚯蚓生活在温度为20 ℃、湿度相对稳定的避光环境中。试验组分为5个试验梯度, 每个浓度做3次重复。试验过程中不投喂食物, 定期观察和记录蚯蚓的中毒症状和行为, 在24 h、48 h和72 h分别采集实验蚯蚓样本测定蛋白质的含量和酶活力。试验期间无蚯蚓死亡。
2.5.3 空白对照的试验方法
空白试验中, 吸取4 mL的丙酮溶液均匀淋洒于垫有双层双圈定性滤纸的玻璃培养皿中, 将其放入通风橱10 h, 待丙酮挥发后, 吸取4 mL的超纯水均匀地润湿滤纸。
2.6 蛋白含量及酶活力或含量测定
2.6.1 蛋白含量的测定
准确秤量待测样本的重量, 按1∶9的重量(g)∶体积(mL)比例加入生理盐水, 用冷冻离心机将冰水浴条件下机械匀浆好的蚯蚓组织样本在2500 r·min-1和 4 ℃条件下, 离心10 min。用生理盐水将离心后蚯蚓样本上清液再按1∶9稀释成1%的组织匀浆, 待测。
蚯蚓各样本蛋白含量的测定采用Bradford[14]方法, 以牛血清蛋白为标准蛋白, 利用分光光度计在595 nm处测定其吸光度。
2.6.2 SOD活力的测定
按照上述2.6.1 的方法进行样本前处理并制成10%的蚯蚓组织匀浆。取离心后的上清液待测。蚯蚓各样本SOD活力的测定采用黄嘌呤氧化法[15], 通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基, 使硝基蓝四氮唑被还原成紫红色的亚硝酸盐, 利用光分光光度计在550 nm处测定其吸光度。
2.6.3 CAT活力的测定
按照上述2.6.1 的方法进行样本前处理并制成5%的蚯蚓组织匀浆。蚯蚓各样本CAT活力的测定采用紫外分光法[16], 钼酸铵溶液和经CAT分解后残留的过氧化氢反应后产生的淡黄色络合物在紫外分光光度计405 nm处的吸收峰测定。
2.6.4 MDA含量的测定
按照上述2.6.1 的方法进行样本前处理并制成10%的蚯蚓组织匀浆。MDA含量的检测采用TBA法[17], 过氧化脂质降解产物中的MDA与硫代巴比妥酸(TBA)在酸性和高温条件下形成红色产物, 在532 nm处有紫外可见最大吸收峰。
2.7 数据处理
蚯蚓体内生化指标数值由多个蚯蚓试验样本的平均值得到。实验数据采用Excel 和SPSS 18.0 软件处理, 试验结果以平均值±标准偏差(Mean ± SD)表示, 且各数据之间相关性分析由SPSS 18.0 软件完成。
3 结果与讨论
3.1 高效氯氰菊酯对蚯蚓体内蛋白含量的影响
图1为蚯蚓经过5、10、20、40和50 mg·L-1高效氯氰菊酯溶液浓度梯度处理24 h、48 h和72 h后体内蛋白含量及变化。
高效氯氰菊酯单一染毒试验中, 同一试验处理组24 h、48 h和72 h之间有显著差异(<0.05)。与空白对照组相比, 部分处理组蛋白含量变化极显著(<0.01), 如染毒24 h和48 h(除50 mg·L-1)的各浓度处理组。染毒24 h时, 蚯蚓体内蛋白含量随着暴露浓度的增加而升高, 并在50 mg·L-1时达到最高值, 此时蚯蚓体内蛋白含量为空白对照组的1.68倍。染毒48 h时, 蚯蚓体内蛋白含量在40 mg·L-1时达到最高值, 为空白对照组的1.49倍, 随后蛋白含量降低。染毒72 h时, 蚯蚓体内蛋白含量随着暴露浓度的升高而降低, 且在暴露浓度为50 mg·L-1时低于空白对照组。此外, 由图1中蚯蚓体内蛋白含量的变化可以发现, 染毒24 h时, 在50 mg·L-1时出现蛋白含量最高值, 而在染毒72 h可以发现暴露浓度为5 mg·L-1时出现蛋白含量最高值, 可推断低浓度、长时间染毒对蚯蚓体内蛋白含量变化的影响与高浓度、短时间的染毒产生的影响类似, 即暴露污染物的浓度和染毒时间决定了蚯蚓受外来污染物胁迫的机体损伤程度, 此发现与孙仕仙等[18]研究结果类似。

图1 高效氯氰菊酯单一染毒24 h、48 h和72 h对蚯蚓体内蛋白含量的影响
染毒初期, 有毒物质经表皮大量进入蚯蚓体内, 破坏其机体功能和内分泌系统, 随着农药暴露浓度的升高, 短期内可能产生较多的应激蛋白, 从而引起其体内蛋白含量的升高[19]。高效氯氰菊酯暴露浓度和染毒时间延长, 可能增加蚯蚓其体内生产正常生理功能的蛋白质或者诱导产生一些可以与其络合的蛋白质去应对农药高效氯氰菊酯的污染负荷[20]。随着染毒时间进一步延长, 胃毒和经表皮毒性持续共同作用, 破坏其蛋白质的产生来源, 造成蛋白含量的降低[21]。
3.2 高效氯氰菊酯对蚯蚓体内SOD活力的影响
图2为蚯蚓经过5、10、20、40和50 mg·L-1高效氯氰菊酯溶液浓度梯度处理24 h、48 h和72 h后体内SOD活力及变化。
蚯蚓经高效氯氰菊酯处理后, 其体内SOD活力的变化基本一致, 不同试验浓度组间蚯蚓SOD活力差异显著(<0.05), 同一试验处理组24 h、48 h和72 h之间差异显著(<0.05)。主要表现为SOD活力与空白对照相比先降低, 然后逐渐升高, 再持续降低。与空白对照组相比, 各染毒处理组的SOD活力变化极显著(<0.01)。与空白对照组相比, 各染毒处理组的SOD活力变化幅度更大。在3个测定时段中, 蚯蚓体内SOD活力的高低顺序为: 48 h>24 h>72 h。染毒24 h, SOD活力在低浓度时升高, 在20 mg·L-1时达到最大值, 之后随浓度升高而降低, 出现催化剂量反应, 促进SOD的产生去承担农药负荷, 这与唐学玺和张培玉等的研究结果类似[22], 即生物体受到环境污染物少量胁迫时, 会促进SOD的产生, 使得SOD活力会升高, 而当其受到毒物重度胁迫时, SOD活力往往会降低。染毒48 h后, 蚯蚓体内SOD活力呈现下降趋势, 可能是SOD是蚯蚓进行抗氧化防御的第一道防御, 对氧化损伤比较敏感[23]。蚯蚓染毒后体内的SOD活力开始抵御氧化损伤并逐渐适应, 但随着染毒时间的延长, 过度的氧化应激反应超出机体的抗氧化能力, 导致SOD活力的降低[24]。
3.3 高效氯氰菊酯对蚯蚓体内CAT活力的影响
图3为蚯蚓经过5、10、20、40和50 mg·L-1高效氯氰菊酯溶液浓度梯度处理24 h、48 h和72 h后体内CAT活力及变化。
由图3可见, 在低浓度短时间内, 蚯蚓体内CAT活力逐渐升高, 而高浓度长时间下CAT活力抑制。与空白对照组相比, 试验周期内部分处理组CAT活力变化极显著(<0.01): 如染毒24 h的10、20和40 mg·L-1, 染毒48 h的 20 mg·L-1浓度组, 其CAT活力均显著高于空白对照组, 分别为对应空白对照组的1.23、1.24、1.24和1.16倍。而染毒48 h 的5和40 mg·L-1, 染毒72 h的50 mg·L-1浓度组, 其CAT活力显著低于空白对照组, 分别为对应空白对照组的0.74、 0.88和0.81倍。染毒24 h时, 10、20和40 mg·L-1的高效氯氰菊酯可诱导蚯蚓体内CAT活力上升; 染毒48 h时, 蚯蚓体内CAT活力逐渐降低。染毒72 h时, 对蚯蚓体内CAT活力产生诱导升高溶液的浓度随着染毒时间的延长而降低, 染毒48 h到72 h时, 处理组诱导作用浓度由20 mg·L-1降低到10 mg·L-1。蚯蚓抗氧化酶系统应对氧化损伤的主要机理是, SOD催化O2-和H+转化为H2O2和O2, 随后CAT又将H2O2转变为H2O和O2[25]。染毒24 h后, SOD活力的提高可能增加了H2O2的累积, 刺激CAT活力上升; 而随着染毒时间延长, 过量H2O2的积累也会抑制CAT活力, 从而造成CAT活力降低。
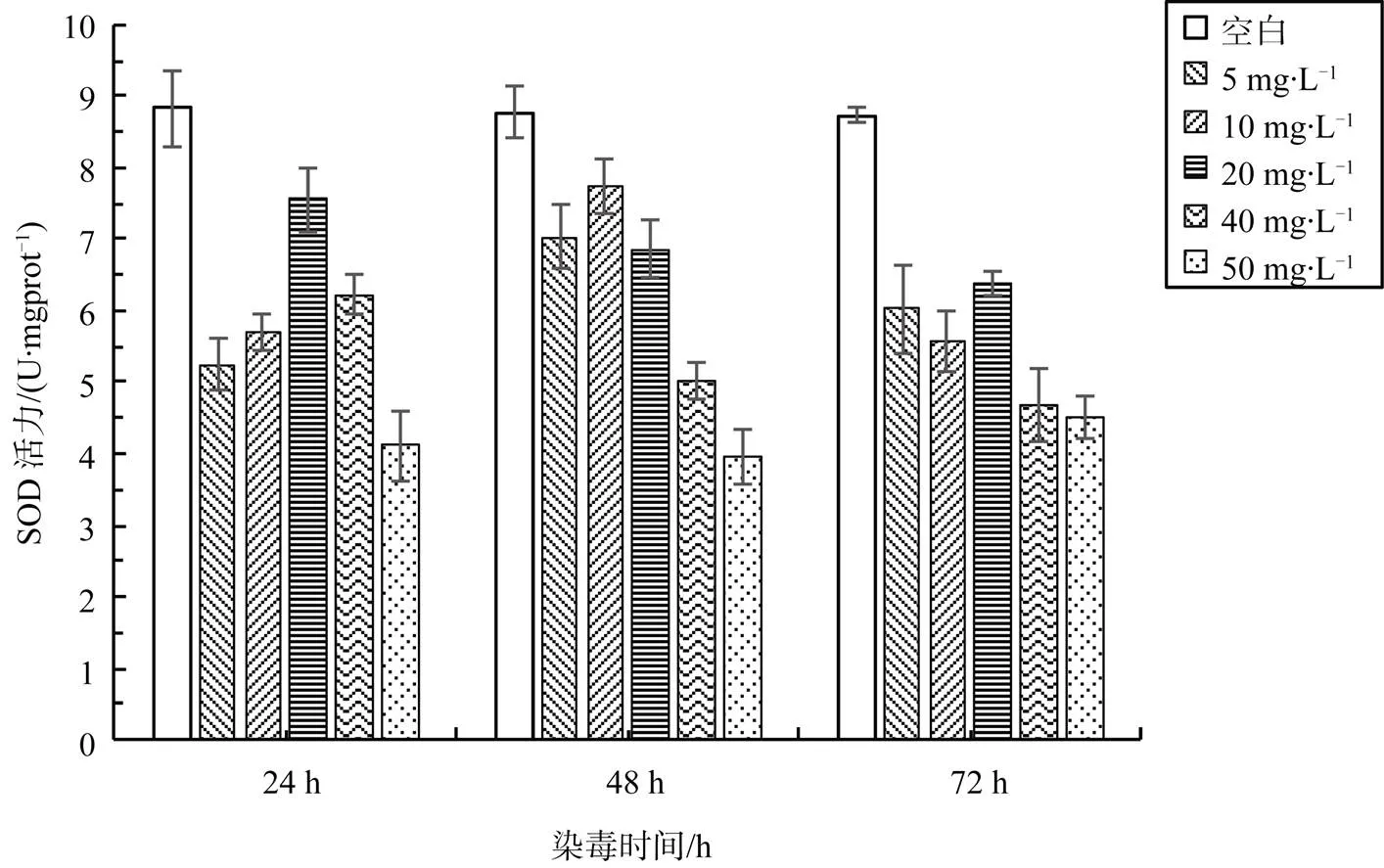
图2 高效氯氰菊酯单一染毒24 h、48 h和72 h对蚯蚓体内SOD活力的影响

图3 高效氯氰菊酯单一染毒24 h、48 h和72 h对蚯蚓体内CAT活力的影响
3.4 高效氯氰菊酯对蚯蚓体内MDA含量的影响
图4为蚯蚓经过5、10、20、40和50 mg·L-1高效氯氰菊酯溶液浓度梯度处理24 h、48 h和72 h后体内MDA含量及变化。

图4 高效氯氰菊酯单一染毒24 h、48 h和72 h对蚯蚓体内MDA含量的影响
MDA作为膜脂质过氧化的产物, 是细胞膜脂质过氧化程度及应激反应强弱的指示指标, MDA含量与机体损伤成正比[26]。由图4可见, 蚯蚓经高效氯氰菊酯单一染毒初期, 各试验处理组蚯蚓体内MDA含量出现明显上升: 如染毒24 h时10、20、40和50 mg·L-1试验处理组显著高于空白对照组(< 0.01), 分别为对应空白对照组的1.28、1.37、1.80和1.89倍, 且各蚯蚓试验浓度组间MDA含量变化幅度较大, 达17.84%—89.35%, 并在50 mg·L-1时达到最高值。这可能是由于污染物造成生物体内发生脂质过氧化和氧化应激效应, 但因其自身调节能力限制, 蚯蚓体内累积过量的氧化自由基, 引起其机体细胞功能缺失导致膜的过氧化, 并伴随MDA含量增加[27]。染毒48 h, 由于体内污染物代谢物质的累积, 导致其体内MDA含量略有所增加。此外, 随着染毒时间延长, 蚯蚓体内MDA含量变化幅度不大, 逐渐趋于平稳, 是因为多余的活性氧被抗氧化酶去除, 使得蚯蚓体内活性氧的产生和去除处于动平衡状态[26], 染毒72 h, 试验处理组和空白对照组的MDA含量均无明显差异(>0.05)。蚯蚓遭受环境胁迫严重时, 氧化应激反应能引起生物机体内脂质总量的下降, 并且成分发生改变, 造成生物膜发生脂质过氧化[28]。由整个染毒时间来看, 蚯蚓体内MDA含量在高浓度组的波动幅度明显大于低浓度组, 且MDA含量的变化是农药浓度和染毒时间的综合结果, 机体短时间内的自由基损伤可修复, 但长时间染毒造成的机体损伤无法修复。本试验结果也侧面表明外源污染物的加入可引起生物体内MDA含量增加的现象[29]。
4 结论
1)亚致死剂量高效氯氰菊酯染毒24 h, 蛋白含量在50 mg·L-1达到最大值, 而染毒72 h, 蛋白含量在5 mg·L-1达到最大值。可得出农药对蚯蚓体内蛋白含量的影响表现为低浓度、长时间暴露与高浓度、短时间暴露的作用类似, 即暴露污染物的浓度和染毒时间决定了蚯蚓受外来污染物胁迫的机体损伤程度。
2)高效氯氰菊酯对蚯蚓体内抗氧化酶活力有影响, SOD活力在低浓度激活, 高浓度抑制; CAT活力呈现出先升高后降低的趋势; MDA含量在短时间内随暴露浓度升高而升高, 而后恢复正常水平。
3)高效氯氰菊酯作用下, 蚯蚓体内SOD、CAT和MDA的敏感性不同, SOD活力影响最大, CAT次之, MDA最小。试验研究结果可为高效氯氰菊酯的土壤生态毒理诊断提供参考。
[1] CHEN Chen, WANG Yanhua, ZHAO Xueping, et al. Comparative and combined acute toxicity of butachlor, imidacloprid and chlorpyrifos on earthworm,[J]. Chemosphere, 2014, 100(3): 111.
[2] 王啸. 拟除虫菊酯离子液体固相微萃取技术的研究[D]. 天津: 天津科技大学, 2012.
[3] AEL, T N. Modification of sodium channel kinetics by the insecticide tetramethrin in crayfish giant axons[J]. Neurotoxicology, 1981(2): 213–219.
[4] 全国农药残留试验研究协作组. 农药残留量实用检测方法手册[M]. 北京: 化学工业出版社, 2001.
[5] 朱友芳, 洪万树. 敌百虫对中国花鲈的毒性效应[J]. 生态学杂志, 2011, 30(7): 1484–1490.
[6] 于伟丽, 杜军辉, 胡延萍, 等. 六种杀虫剂对小地老虎的毒力及对土壤生物安全性评价[J]. 植物保护学报, 2012, 39(3): 277–282.
[7] 李海波, 谢学文, 张国森, 等. 4种土壤处理剂对日光温室蚯蚓的防治效果[J]. 中国蔬菜, 2015, 1(9): 58–60.
[8] WANG Yanhua, CANG Tao, ZHAO Xueping, et al. Comparative acute toxicity of twenty-four insecticides to earthworm,[J]. Ecotoxicology and Environmental Safety, 2012, 79(6): 122–128.
[9] YASMIN S, D'SOUZA D. Effects of pesticides on the growth and reproduction of earthworm: a review [J]. Applied & Environmental Soil Science, 2010, 2010(3): 1–9.
[10] 姜锦林, 程燕, 卜元卿, 等. 农药对蚯蚓的生长和繁殖毒性及其在生态风险评价中的应用[J]. 农药科学与管理, 2014, 35(9): 23–32.
[11] 白桂芬, 曾小波. 敌百虫对蚯蚓体内3种抗氧化酶活性的影响[J]. 东北农业科学, 2013, (1): 22–26.
[12] GENERAL C. Test No.207: Earthworm, Acute Toxicity Tests[J]. Oecd Guidelines for the Testing of Chemicals, 1984, 1: 1–9.
[13] 王凯. 新烟碱类杀虫剂对蚯蚓毒性及作用机制研究[D]. 北京: 中国农业大学, 2015.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical biochemistry, 1976, 72(1-2): 248–254.
[15] 吕淑霞. 基础生物化学实验指导[M]. 北京: 中国农业出版社, 2003.
[16] 杨健, 赵丽敏, 陈巧燕, 等. 水力负荷对生物滤池中蚯蚓抗氧化酶和消化酶活性的影响[J]. 环境科学, 2009, 30(4): 1029–1035.
[17] BIGWOOD T, READ G. Pseudo malonaldehyde activity in the thiobarbituric acid test[J]. Free Radical Research, 1989, 6(6): 387.
[18] 孙仕仙, 陶瑞, 张庆蛟, 等. 乐果和杀虫双污染对蚯蚓体内蛋白质含量的影响[J]. 江西农业大学学报, 2012, 34(2): 298–303.
[19] 邰托娅. 土壤中重金属和农药复合污染对蚯蚓毒性效应的研究[D]. 南京: 南京农业大学, 2008.
[20] 何应森, 徐晓燕, 高晓玲. 土壤Cd污染与蚯蚓体内纤对纤维素酶活性变化的关系(英文)[J]. 农业科学与技术: 英文版, 2014, 15(12): 2156–2158.
[21] 冯磊. 三种新烟碱类杀虫剂对蚯蚓的影响[D]. 北京: 中国农业科学院, 2014.
[22] 唐学玺, 张培玉. 蒽对黑鲪超氧化物歧化酶活性的影响[J]. 水产学报, 2000, 24(3): 217–220.
[23] APEL K, HIRT H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55(1): 373–399.
[24] VIEIRA M C, TORRONTERAS R, CORDOBA F, et al. Acute toxicity of manganese in goldfish Carassius auratus is associated with oxidative stress and organ specific antioxidant responses[J]. Ecotoxicology & Environmental Safety, 2012, 78(3): 212–217.
[25] LI Ying, SHI Jiaqi, QU Ruijuan J, et al. Toxicity assessment on three direct dyes (D-BLL, D-GLN, D-3RNL) using oxidative stress bioassay and quantum parameter calculation[J]. Ecotoxicology & Environmental Safety, 2012, 86(4): 132–140.
[26] 吴尔苗, 王军良, 赵士良, 等. 菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J]. 环境科学学报, 2011, 31(5): 1077–1085.
[27] FENG Mingbao, QU Ruijuan, WANG Chao, et al. Comparative antioxidant status in freshwater fish Carassius auratus exposed to six current-use brominated flame retardants: A combined experimental and theoretical study[J]. Aquatic toxicology (Amsterdam, Netherlands), 2013, 140- 141(1): 314–323.
[28] LU Mang, ZHANG Zhongzhi, SU Xiaoli, et al. Effect of copper on in vivo fate of BDE-209 in pumpkin[J]. Journal of Hazardous Materials, 2013, 262C (8): 311–317.
[29]NOVAIS S C, GOMES S I, GRAVATO C, et al. Reproduction and biochemical responses in Enchytraeus albidus (Oligochaeta) to zinc or cadmium exposures[J]. Environmental Pollution, 2011, 159(7): 1836–1843.
Effects of beta-cypermethrin on the biochemical indices of earthworms under the sublethal dose
ZHAO Liqian1, 2, QIU Aifeng2, JI Wei2, CHEN Zilei3, ZHUANG Huisheng1*
1. School of Environmental Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China 2. Yangtze Delta Region Institute of Tsinghua University, Zhejiang, Jiaxing 314006, China 3. Institute of Quality Standard and Testing Technology for Agricultural Products, Shandong Academy of Agricultural Sciences, Jinan 250100, China
In this study, the filter paper contact method was conducted to investigate the toxic effects of beta-cypermethrin under the sublethal dose after 24 h, 48 h and 72 h to discuss the content of protein, superoxide dismutase (SOD) and catalase (CAT) activities and the content of Malondialdehyde (MDA) in earthworm () in different exposure time and concentration. Different changes in the tested earthworm of protein content, SOD, CAT activity and MDA content were observed for application of beta-cypermethrin. The results showed that the protein content reached the maximum at 50 mg·L-1in 24 h, while the protein content reached the maximum at 5 mg·L-1in 72 h under the sublethal dose of beta-cypermethrin. Protein content showed a time-dependent effect with the beta-cypermethrin: the protein content increased in short time, while it decreased in the long time compared to the controls. Results of exposure tests indicated that beta-cypermethrin had a promoting effect upon the induction of the activities of SOD and CAT in earthworm.The activity of SOD increased in the low concentration group, while it decreased in the high concentration group. The activity of CAT showed a trend of increasing at first and then decreasing during the exposure time. Nevertheless, it was not so obvious to the changes of MDA content, which increased with the exposure concentration in a short time and tended to normal level with the exposure time prolonged. Thus, SOD and CAT could be the indicators of oxidative stress in earthworm, and MDA could not. In addition, the biochemical indicators had different sensitivity to the toxic effects of beta-cypermethrin; SOD was the greatest, followed by CAT and MDA was the minimum.
beta-cypermethrin; earthworm; protein content; antioxidant enzymes; malondialdehyde content
10.14108/j.cnki.1008-8873.2018.04.008
X171.5
A
1008-8873(2018)04-065-07
2017-06-15;
2017-07-21
混合农药联合毒性效应与膳食摄入风险评估(ZR2016YL027); 生物标志物在杭州湾海域生态风险评估中的研究与示范(2016C34010)
赵丽倩(1988—), 女, 浙江嘉兴人, 硕士研究生, 主要从事环境污染风险研究, E-mail: liqian_zhao@hotmail.com
庄惠生, 男, 博士, 教授, 从事环境评价研究, E-mail: hszhuang@sjtu.edu.cn
赵丽倩, 仇爱锋, 纪伟, 等. 亚致死剂量高效氯氰菊酯对蚯蚓体内生化指标的影响[J]. 生态科学, 2018, 37(4): 65-71.
ZHAO Liqian, QIU Aifeng, JI Wei, et al. Effects of beta-cypermethrin on the biochemical indices of earthworms under the sublethal dose[J]. Ecological Science, 2018, 37(4): 65-71.
