桂林会仙喀斯特湿地不同植物群落土壤养分分布差异与微生物活性特征
2018-09-10李艳琼沈育伊黄玉清徐广平蒲高忠何成新王新桂莫凌
李艳琼, 沈育伊, 黄玉清, 徐广平,*, 蒲高忠, 何成新, 王新桂, 莫凌
桂林会仙喀斯特湿地不同植物群落土壤养分分布差异与微生物活性特征
李艳琼1, 沈育伊2, 黄玉清1, 徐广平1,*, 蒲高忠1, 何成新1, 王新桂1, 莫凌1
1. 广西喀斯特植物保育与恢复生态学重点实验室, 广西壮族自治区中国科学院广西植物研究所, 广西, 桂林 541006 2. 广西植物功能物质研究与利用重点实验室, 广西壮族自治区中国科学院广西植物研究所, 广西, 桂林 541006
以桂林会仙喀斯特湿地8种植物群落为研究对象, 分析了群落土壤含水率、pH、土壤养分(有机碳SOC、全氮TN、全钾TK、速效氮AN、速效钾AK)和微生物活性指标(微生物生物量碳MBC、微生物生物量氮MBN、土壤基础呼吸BR、土壤呼吸势PR、微生物熵qMB和代谢熵qCO2)的变化及其相互关系, 探讨水位梯度下不同植物群落类型对土壤养分和微生物活性特征的影响。结果表明: (1)会仙湿地大部分植物群落土壤pH呈弱碱性, 含水量随着土层的加深而降低, 且土壤pH值和含水量随着群落积水深度的增加而升高; (2)各植物群落土壤有机碳、全氮、速效氮和速效钾含量在垂直剖面上均表现出随土壤深度的增加而减少的趋势; 土壤微生物生物量碳氮含量(除铺地黍群落外)、土壤基础呼吸和呼吸势均随着土壤深度的增加而降低, 且各土层之间差异显著(<0.05), 而土壤微生物熵和代谢熵在垂直剖面的分布并无明显规律; (3)8个植物群落中, 华克拉莎群落的土壤有机碳、全氮、速效氮、速效钾和微生物生物量碳氮含量、土壤基础呼吸速率和呼吸势均最高; 田间鸭嘴草群落的土壤微生物熵显著高于其它群落(<0.05); (4)会仙湿地土壤微生物生物量碳氮、基础呼吸、呼吸势与土壤有机碳、全氮之间均呈极显著的正相关关系(<0.01), 微生物熵和全钾、速效氮均显著正相关(<0.05), 表明在水位梯度变化的驱动下, 会仙喀斯特湿地不同植物群落土壤养分和微生物活性特征存在差异, 土壤微生物活性特征反映了不同植物群落的环境适应和土壤质量的状况。
喀斯特湿地; 植物群落类型; 土壤微生物活性; 土壤养分
1 前言
湿地兼有水体和陆地的双重特征, 在抵御洪水、控制污染、调节径流、美化环境、改善气候及维护区域生态平衡等方面有着其它生态系统所不能替代的作用[1]。湿地对碳、氮等元素具有较强的截留和过滤作用[2], 湿地土壤养分的分布特征不仅可反映出湿地土壤的养分供给状况及其可利用水平, 而且还在一定程度上对湿地植物群落组成以及湿地系统的稳定与健康等产生深远影响[3], 已有研究表明, 湿地土壤养分的分布和变化受湿地生态系统的植物群落类型、土壤理化性质、水文过程和人类活动等多种因素的影响[4]。开展土壤养分布特征的研究对湿地环境的形成与演替等具有重要意义[5]。不同类型湿地的土壤肥力具有很大差异, 同一湿地内土壤肥力也具有高度的空间异质性[6]。土壤微生物是土壤生态系统中最具活力的组成部分, 是土壤中物质转化和养分循环的驱动者[7], 参与土壤碳、氮等元素的循环过程, 不仅推动着湿地生态系统的物质循环和能量流动[8], 还在湿地生物多样性维护、生态平衡等方面起着十分重要的作用[9], 土壤微生物量是土壤质量和生态系统功能变化的灵敏指标[10]。土壤基础呼吸可在一定程度上指示土壤养分转化和供应能力大小[11]; 代谢熵代表了微生物群落的维持能力大小和对基质的利用效率[12]。对天然湿地土壤养分及微生物活性特征进行研究, 可加强人类对天然湿地生态功能及其环境效应的正确认识, 同时能够为全球养分的生物地球化学循环提供基础数据[13]。目前, 我国学者从土壤物理、化学性质以及人为活动(如垦殖和不同土地利用方式)等角度对湿地开展了较系统的研究[14-15], 相关学者也对高原湿地[16]、河口湿地[17]、滨海湿地[18]等开展了相关研究工作, 涉及到不同植被类型下土壤养分分布以及土地利用变化的影响, 但对于中低海拔喀斯特湿地不同植物群落土壤养分及微生物活性特征的研究较少。桂林会仙湿地地处生态脆弱的喀斯特地区, 调节着地表径流和河流水量, 对漓江水位和水量均衡有着重要作用, 被誉为“桂林之肾”[19], 具有特殊的生态意义和科研价值。在气候变化和人类活动的影响下, 湿地水分条件(如土壤含水量、水位波动)等的变化, 可能会影响到植物群落土壤理化性质及土壤微生物活性的变化。因此, 本文通过探讨会仙喀斯特湿地沿水位梯度下广泛分布的8种优势植物群落土壤养分和微生物活性的特征差异, 不仅为喀斯特湿地生物地球化学循环研究提供基础数据, 也为喀斯特湿地的保护与系统管理以及退化湿地的植被恢复与保育等提供科学依据。
2 材料与方法
2.1 研究区概况
会仙岩溶湿地位于桂林市临桂县会仙镇, 东至雁山区, 西至四塘乡, 地理坐标为北纬 25°01′30″—25°11′15″, 东经110°08′15″—110°18′00″, 海拔150—160 m, 总面积约120 km2, 是以草本沼泽和湖泊为主的喀斯特湿地, 是国内为数不多的中低海拔大型喀斯特湿地之一[20]。该区属亚热带季风气候区, 年均气温16.5—20.5 ℃, 极高温度达38.8 ℃, 极低温度为–3.3 ℃, 年均降雨量为1890.4 mm。降雨多集中在每年的3—8月, 形成了春夏雨多而集中, 秋冬少雨干旱的特点。土壤以红黄壤和红壤为主, 集中分布于洼地、平原和缓坡, 山区土壤层薄甚至基岩裸露。湿地植被以挺水植被和沉水植被为主, 植物种类较多, 且生长茂盛, 盖度常可达80%—95%, 主要建群种有长苞香蒲()、芦苇()、华克拉莎()等[21]。
2.2 试验方法
2014年10月, 基于会仙喀斯特湿地水位梯度的变化, 从河岸附近到深水区设置采样区, 选取8个不同植物群落, 分别为柳叶箬群落(), LYR, 河岸附近; 铺地黍群落(), PDS, 河岸附近; 田间鸭嘴草群落(), YZC, 浅水区; 菰群落(), G, 浅水区; 长苞香蒲群落(), CBXB, 积水沼泽; 华克拉莎群落(), HKLS, 积水沼泽; 水毛花群落(), SMH, 深水区; 莲群落(), L, 深水区, 每个群落类型选取3个重复, 按照S型方法在各小区中选取5个代表性样点采样土壤样品, 按0—10 cm, 10—20 cm和20—30 cm 3个层次用土壤取样器(直径5 cm)分层取土, 同层土壤混匀为1个土样。将采集的土壤样品, 装在无菌自封袋中, 迅速置于密封冰袋容器中冷藏后带回实验室于4℃冰箱中保存, 然后备2 份处理(1 份鲜样, 1 份风干样)。鲜样用于土壤微生物生物量碳、氮指标的分析; 其余样品常规处理, 用于土壤理化性质的分析。
土壤有机碳(SOC)用总有机碳TOC仪测定(岛津5000A, 日本); 全氮(TN)用Vario ELIII元素分析仪(德国); 速效氮(AN)用碱解扩散法; 全钾(TK)用硫酸-高氯酸消煮, 火焰光度法; 速效钾(AK)用火焰光度法; pH值用酸度计测定(水土质量比为2.5:1); 土壤含水量采用烘干法进行测定[22], 计算方法为: 含水量=(样品鲜重-样品干重)/样品干重*100%。土壤微生物生物量碳(MBC)、氮(MBN)采用氯仿熏蒸浸提法测定[23], 其中熏蒸处理为25 ℃真空条件下培养24 h, 提取过程所用浸提液为0.5 mol·L–1K2SO4溶液, 浸提液中碳和氮的测定采用德国Multi N/C 3100 总有机碳/总氮分析仪, 计算公式: Mc=Ec/0.45, MN= EN/0.45, 式中MC和MN为土壤微生物量碳和土壤微生物量氮, EC和EN为熏蒸和未熏蒸土壤样品中浸提液中碳和氮含量的差值, 0.45为校正系数。称量20 g (干土重)鲜土放入500 mL培养瓶中, 调节其含水量为60%田间持水量, 20 ℃真空条件下培养48 h, CO2产生量作为土壤基础呼吸, CO2产生量在24 h内用HP6890气相色谱仪测定, 用单位时间内产生CO2- C的量表示基础呼吸大小[24]。土壤呼吸势(BR)通过基质诱导方法, 加1.0克葡萄糖溶液, 其它与土壤基础呼吸相同。微生物熵(qMB)=微生物量碳/土壤有机碳, 代谢熵(qCO2)=土壤基础呼吸/微生物量碳。
2.3 数据分析
利用Excel 2003和SPSS 18.0软件对数据进行统计分析。对不同土层土壤各指标进行单因素方差分析(One-way ANOVA)和LSD多重比较(α=0.05), 对土壤各养分含量进行Pearson相关性分析。图表中数据为平均值±标准差(mean ± SD)。
3 结果与分析
3.1 不同植物群落土壤pH和含水量分布差异
会仙湿地不同植物群落土壤pH和含水量如图1所示。pH随土层深度的增加并无明显规律。就不同群落而言, 河岸附近的铺地黍(PDS)和柳叶箬(LYR)群落土壤偏酸性, pH平均值分别为5.90和6.47; 田间鸭嘴草群落(YZC)土壤呈中性到弱碱性, pH平均值为7.02; 其它群落土壤pH呈弱碱性, 菰(G)、长苞香蒲(CBXP)、华克莎拉(HKSL)、水毛花(SMH)和莲(L)群落的土壤pH均值分别为7.68、7.35、7.51、7.77、7.55。各植物群落表层土壤含水量最高, 随着土层的加深而含水量降低, 且土层间差异显著(<0.05)。各群落之间土壤含水量差异显著(<0.05), 其中深水区的莲群落(L)土壤含水量最高, 土层平均值为106.14%, 河岸附近的铺地黍群落(PDS)土壤含水量最低, 土层平均值为18.34%。总体而言, 群落之间随着积水深度的增加(河岸附近-浅水区-积水沼泽-深水区)土壤pH值和含水量升高或增加。
3.2 不同植物群落土壤养分状况
会仙湿地不同植物群落土壤养分状况有所差异, 不同植物群落土壤有机碳、全氮、全钾含量的变化范围为9.91—30.54、0.85—3.57、4.30—19.12 g·kg-1。在0—30 cm土层内, 表层土壤(0—10 cm)有机碳、全氮和全钾含量均显著高于下层土壤(<0.05)。各群落类型土壤有机碳和全氮含量在垂直剖面上均表现出随土壤深度的增加而减少的趋势(表1); 除柳叶箬和田间鸭嘴草群落在20—30 cm较大之外, 土壤全钾也随着土壤深度的增加而减少。铺地黍、柳叶箬、田间鸭嘴草、菰、长苞香蒲、华克拉莎、水毛花和莲群落的0~30 cm土层土壤有机碳含量均值分别为16.38、14.43、12.49、22.95、24.68、27.04、16.36和20.36 g·kg-1, 全氮含量均值为1.53、1.35、1.55、2.27、2.57、2.85、1.80和1.93 g·kg-1, 全钾含量均值分别为9.95、7.07、8.35、14.13、14.07、14.10、6.64和8.47 g·kg-1。各群落间土壤有机碳平均含量变化趋势为HKLS>CBXP> G>L>PDS>SMH>LYR>YZC; 土壤全氮平均含量变化趋势为HKLS>CBXP>G>L>SMH>YZC>PDS>LYR; 土壤全钾平均含量变化趋势则为G>HKLS> CBXP> PDS>L>YZC>LYR>SMH, 且各群落之间养分含量差异显著(<0.05)。会仙湿地各植物群落土壤速效氮和速效钾含量在各土层之间差异显著(<0.05), 且随着土层深度的增加逐渐减少。华克拉莎群落的土壤速效氮(233.55 mg·kg-1)和速效钾(377.94 mg·kg-1)含量显著高于其它群落(<0.05), 水毛花群落的土壤速效氮和速效钾含量最低, 平均值分别为38.99和70.22 mg·kg-1。

图1 会仙湿地不同植物群落土壤pH和含水量
3.3 不同植物群落土壤微生物生物量碳氮分布差异
除铺地黍群落外, 不同植物群落土壤微生物生物量碳含量在土壤垂直剖面上呈现出随土层深度的增加而减少的趋势(图2), 且土层间差异显著(<0.05); 各群落土壤生物微生物量氮含量在土层间的变化规律也基本一致, 均随着土层深度的增加而减少, 且各土层之间差异显著(<0.05)。由图2可知, 土壤微生物生物量碳氮具有明显差异(<0.05)。就各群落平均水平而言, 各群落土壤微生物生物量碳含量排序为华克拉莎群落(369.81 g·kg-1)>长苞香蒲群落(338.85 g·kg-1)>菰群落(299.28 g·kg-1)>田间鸭嘴草群落(248.35 g·kg-1)>铺地黍群落(219.84 g·kg-1)>柳叶箬群落(167.05 g·kg-1)>莲群落(130.78 g·kg-1)>水毛花群落(89.86 g·kg-1); 微生物量氮含量排序为华克拉莎群落(65.12 g·kg-1)>莲群落(58.79 g·kg-1)>菰群落(55.30 g·kg-1)>长苞香蒲群落(49.47 g·kg-1)>柳叶箬群落(34.78 g·kg-1)>田间鸭嘴草群落(31.72 g·kg-1)>水毛花群落(30.36 g·kg-1)>铺地黍群落(22.35 g·kg-1)。不同群落同一土层土壤微生物生物量碳氮含量也有显著差异。在三个土层中, 华克拉莎群落土壤微生物生物量碳氮含量均为最高; 在0—10 cm土层内, 水毛花群落土壤微生物生物量碳含量最低, 铺地黍群落土壤微生物生物量氮含量最低; 在10—20 cm和20—30 cm土层内, 水毛花群落土壤微生物生物量碳氮含量均为最低。方差分析表明, 除20—30 cm土层内铺地黍群落和田间鸭嘴草群落的土壤微生物生物量碳无明显差异外(>0.05), 其它群落的土壤微生物生物量碳含量在同一土层中均有显著差异(< 0.05); 在0—10 cm和20—30 cm土层中各群落微生物生物量氮差异显著(<0.05), 在10—20 cm土层内, 仅柳叶箬和田间鸭嘴草群落的微生物生物量氮差异不显著(>0.05)。
3.4 不同植物群落土壤微生物活性特征
会仙湿地不同植物群落土壤基础呼吸和呼吸势的垂直剖面变化规律与土壤微生物量碳氮类似, 均随着土壤深度的增加而降低(图3), 且所有群落不同土层间的基础呼吸以及呼吸势的差异均达到显著水平(<0.05)。在同一土层中, 不同群落的土壤基础呼吸和呼吸势也存在显著差异(<0.05)。在0—10 cm土层, 华克拉莎群落土壤基础呼吸速率和呼吸势最高,达8.20和16.77 mg·kg-1·h-1, 显著高于其它群落(<0.05); 铺地黍群落和柳叶箬群落土壤基础呼吸速率相对较低, 分别为4.20和3.98 mg·kg-1·h-1, 二者差异不显著(>0.05)且显著低于其它群落(<0.05); 同时, 柳叶箬群落的土壤呼吸势也为最低, 仅4.68 mg·kg-1·h-1, 且各群落间的土壤呼吸势差异显著(<0.05)。在10~20 cm土层, 长苞香蒲群落土壤基础呼吸速率和呼吸势最高, 达7.19和14.25 mg·kg-1·h-1; 柳叶箬群落土壤基础呼吸速率和呼吸势最低, 仅为2.45和4.20 mg·kg-1·h-1; 除铺地黍和柳叶箬群落的土壤基础呼吸和呼吸势无明显差异外(>0.05), 其它各群落间差异显著(<0.05)。在20~30 cm土层, 华克莎拉群落土壤基础呼吸速率和呼吸势又为最高, 分别为4.95和10.32 mg·kg-1·h-1; 水毛花群落土壤基础呼吸速率和呼吸势最低, 仅为1.40和2.21 mg·kg-1·h-1; 除铺地黍和柳叶箬群落的呼吸势无明显差异外(>0.05), 其它各群落间土壤基础呼吸和呼吸势差异显著(<0.05)。就土层平均水平而言, 各群落土壤基础呼吸和呼吸势变化趋势一致, 大小排序均为: 华克莎拉(6.41, 13.10 mg·kg-1·h-1)>长苞香蒲(6.39, 13.01 mg·kg-1·h-1)>菰(5.45, 10.52 mg·kg-1·h-1)>莲(4.51, 8.02 mg·kg-1·h-1)>田间鸭嘴草(4.14, 7.65 mg·kg-1·h-1)>水毛花(3.02, 5.46 mg·kg-1·h-1)>铺地黍(2.94, 4.56 mg·kg-1·h-1)>柳叶箬群落(2.89, 3.97 mg·kg-1·h-1), 部分群落间差异显著(<0.05)。

表1 会仙湿地不同植物群落土壤养分状况
注: 不同大写字母表示同一群落不同土层间差异显著, 不同小写字母表示同一土层不同群落间差异显著(<0.05), 下同。SOC(土壤有机碳), TN(全氮), TK(全钾), AN(速效氮), AK(速效钾)
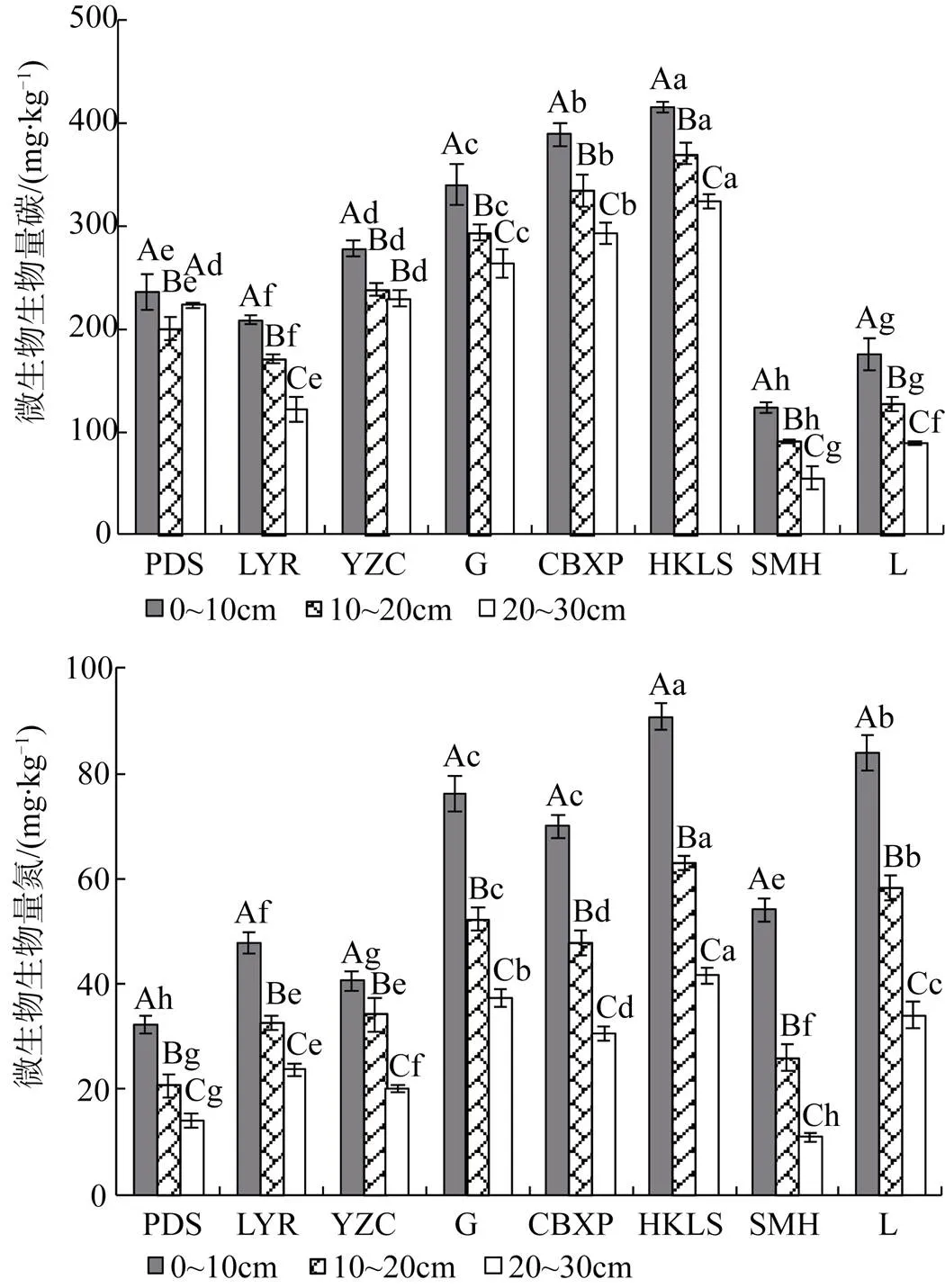
注: 不同大写字母表示同一群落不同土层间差异显著, 不同小写字母表示同一土层不同群落间差异显著(P<0.05), 下同
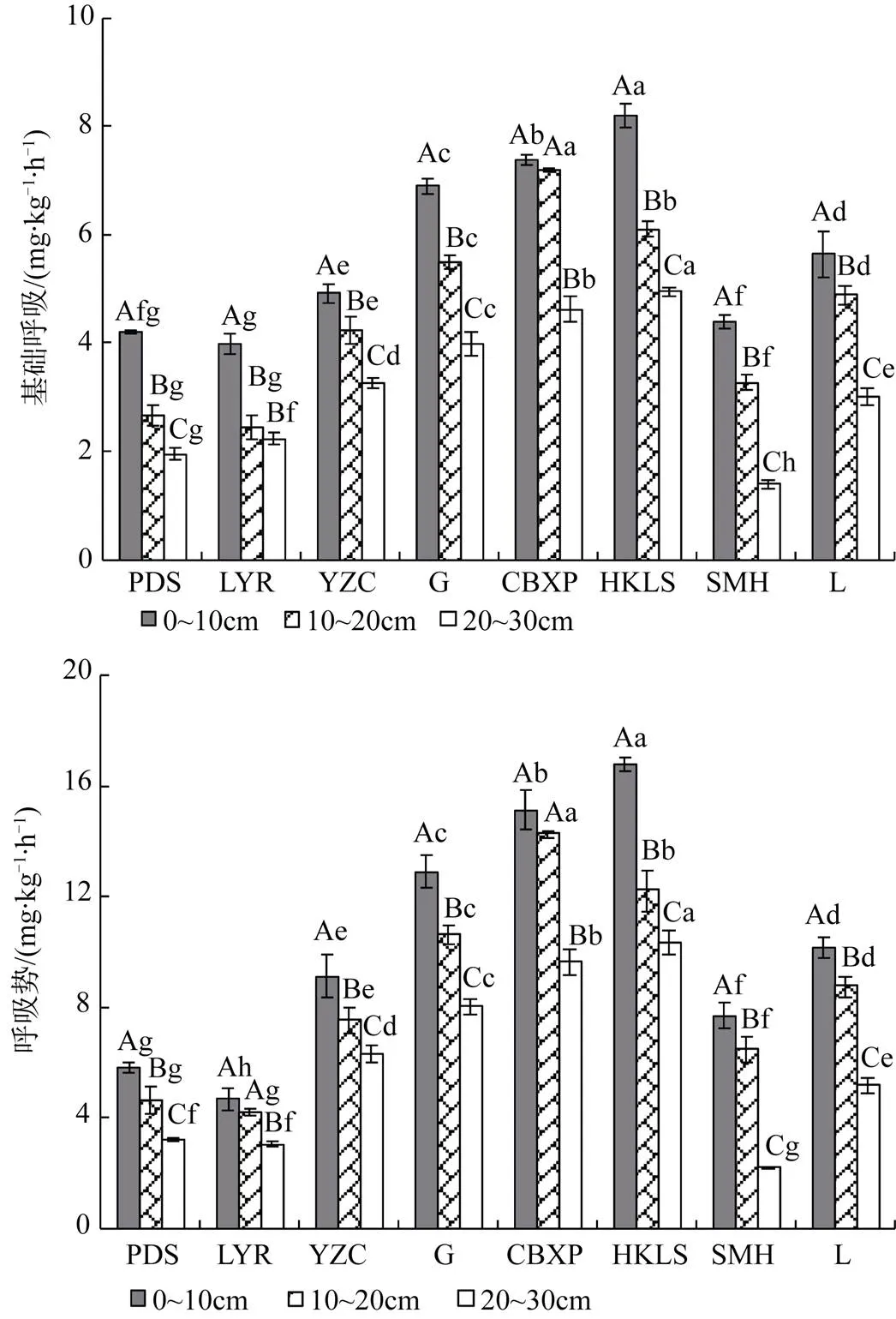
图3 会仙湿地不同植物群落土壤基础呼吸和呼吸势
会仙湿地8种植物群落类型土壤微生物熵和代谢熵在垂直剖面的分布并无明显规律(图4), 仅柳叶箬和莲群落的微生物熵随着土层的加深而减小, 其它群落的微生物熵则是先减小后增加; 铺地黍、菰和华克莎拉群落的代谢熵随土层的加深而减小, 柳叶箬群落则是先减后增的趋势, 其它群落(田间鸭嘴草、长苞香蒲、水毛花和莲群落)的代谢熵则随着土层的加深先加后减。0—10 cm土层内, 田间鸭嘴草群落的土壤微生物熵最高(2.02%), 是最低值水毛花群落(0.58%)的3.48倍, 与其它群落差异显著; 而其对应的代谢熵则恰好相反, 水毛花群落的代谢熵最高(35.50 mg·g-1·h-1)是最低值田间鸭嘴草群落(17.68 mg·g-1·h-1)的2.01倍。10—20 cm土层内, 田间鸭嘴草群落的土壤微生物熵最高(1.91%), 水毛花群落最低(0.50%); 莲群落的代谢熵最高(38.39 mg·g-1·h-1), 是最低值(铺地黍群落, 13.30 mg·g-1·h-1)的2.89倍, 仅部分群落之间差异显著。20—30 cm土层内, 莲群落的土壤微生物熵最低(0.52%), 而代谢熵最高(33.54 mg·g-1·h-1); 田间鸭嘴草群落的土壤微生物熵最高(2.06%), 显著高于其它群落(<0.05); 铺地黍群落的代谢熵最低(8.76 mg·g-1·h-1), 显著低于其它群落(<0.05)。
3.5 土壤微生物生物量碳氮、微生物活性与土壤养分相关性分析
分析结果显示(表2), 会仙湿地土壤pH、SOC、TN、TK、AN、AK、MBC、MBN与土壤基础呼吸(BR)和呼吸势(PR)之间均呈极显著(<0.01)的正相关关系; 微生物熵(qMB)和TK、AN之间显著正相关(<0.05), 与MBC之间极显著(<0.01)正相关, 与SOC负相关(>0.05), 与pH和含水量显著负相关(<0.05,<0.01), 而与TN、AK之间无显著相关性(>0.05); 代谢熵(qCO2)与pH和含水量均呈极显著(<0.01)的正相关关系, 与MBC极显著负相关(<0.01), 与MBN显著正相关(<0.05)。表明会仙喀斯特湿地土壤微生物生物量碳氮、部分微生物活性指标与土壤养分关系密切, 且相互影响, 因此, 微生物生物量碳氮、土壤基础呼吸和呼吸势等能够指示土壤有机碳和全氮的变化。

图4 会仙湿地不同植物群落土壤微生物熵和代谢熵

表2 会仙湿地植物群落土壤养分与微生物活性指标之间的相关性分析
注: **P<0.01; *P<0.05. SOC(土壤有机碳), TN(全氮), TK(全钾), AN(速效氮), AK(速效钾), MBC(微生物生物量碳), MBN(微生物生物量氮), BR(基础呼吸), PR(呼吸势), qMB(微生物熵), qCO2(代谢熵)
4 讨论
4.1 不同植物群落土壤含水率、pH和养分的变化
除河岸附近的铺地黍和柳叶箬群落土壤偏酸性外, 会仙湿地其它群落土壤pH均呈中性到弱碱性(图1)。这与喀斯特湿地土壤母质有关, 会仙湿地地处桂北喀斯特地貌中心区域, 岩溶地球化学背景下其土壤母质中的碳酸盐在水淹条件下溶解电离出大量的CO32-、HCO3-, 使土壤呈弱碱性。另外, 土壤含水量随着土层的加深而含水量降低, 这与群落水淹状态及土壤入渗率有关, 表层土壤直接与湿地水域接触, 其入渗率高, 随着土层的加深, 土壤入渗率降低, 所以表层土壤含水量较高。另外, 从陆生到水生方向, 即随着湿地水位梯度的增加(河岸附近-浅水区-积水沼泽-深水区), 土壤pH值升高, 土壤含水量增加。
会仙湿地不同植物群落土壤有机碳和全氮含量在垂直剖面上表现为由表向下逐渐降低的趋势(表1), 这可能由于湿地植物根系的分布直接影响到土壤有机碳和全氮的垂直分布, 湿地植物根系集中分布在表土层, 因此表土层土壤有机碳含量高于下部土层, 这与肖烨[25]等在三江平原典型湿地和张宏斌[26]等在黑河流域芦苇湿地研究结果类似。由于每年有大量的植物凋(枯)落后经微生物分解而形成腐殖质返回土壤, 为土壤提供了丰富的碳源, 增加了表层土壤有机质含量, 所以土壤有机碳和全氮含量也相应较高。土壤有机碳的垂直分布还与土壤剖面的发育过程密切相关, 随着土壤深度的增加, 微生物数量减少, 分解速率降低, 有机质向下迁移量减少[27], 这些都导致了有机碳和全氮含量的不断减少。除柳叶箬和田间鸭嘴草群落之外, 土壤全钾也随着土壤深度的增加而减少。会仙湿地土壤钾的分布除了与成土母质有关外, 还受到其地上生长的植被的影响。会仙湿地草本植物的凋落物, 其茎叶中的K元素进入土壤中, 使得表土层K含量高于其它土层。会仙湿地积水沼泽区(华克莎拉和长苞香蒲群落)的土壤有机碳和全氮含量均高于其它水位梯度下的群落(表1), 这是因为积水沼泽区具有较厚的泥炭层, 富含大量有机质, 而有机质又是土壤有机碳和全氮的主要来源, 且沼泽区水流缓慢, 有机质累积后不容易流失, 而浅水区和深水区因水流的流速较快, 有机质部分易被水流带走, 河岸带土壤有机质也会受雨水冲刷流失。另外, 积水沼泽区的华克拉莎和长苞香蒲群落生长茂盛, 植物地上生物量相对较大(未发表数据), 其凋落物量也大, 所以在积水沼泽区土壤碳氮含量相对较高。表1显示, 浅水区菰群落的土壤全钾含量略高于积水沼泽区的华克莎拉和长苞香蒲群落, 但三者差异并不显著, 主要是因为菰的茎秆较其它植物粗壮, 占植株生物量的大部分, 菰茎秆中的K元素随着凋落物的分解使得土壤中全钾的含量有所增加。随着水位梯度的增加, 土壤SOC和TN在积水沼泽区域(华克拉莎群落和长苞香蒲群落)和浅水区(菰群落)较高, TK在浅水区(菰群落)和积水沼泽区域(华克拉莎群落和长苞香蒲群落)较高, 这3个植物群落的地上生物量相对较大(未发表数据), 表明在小尺度上, 水位梯度可能是通过影响地表植被的群落生物量从而间接影响土壤碳氮钾的分布。此外, 会仙喀斯特湿地是一个开放性的水体, 有机质的来源较复杂, 除了植物的凋落物之外, 每年由漓江流域内其他水流及旅游干扰携入的悬浮有机物也可能占有一定的比重。
4.2 土壤微生物量碳氮与微生物活性的影响因素
土壤微生物参与土壤碳氮等元素的循环及养分的转化过程, 调控着土壤碳截获能力、碳矿化过程一级生态系统的生产力[28], 同时以自身生物量的形式储存土壤中的碳和其他矿物养分, 因而它们既是土壤养分的重要来源, 又是土壤养分的储存库[29]。本研究中, 除铺地黍群落外, 会仙湿地土壤微生物生物量碳、氮含量均随土层深度的增加而减少(图2), 其变化趋势与土壤有机碳和全氮的变化规律相似, 这与彭佩钦等[5]在洞庭湖湿地的研究结果相似, 主要是因为会仙湿地表土层水热条件和通气状况较好, 植物根系分布较多, 凋落物周转较快, 有机质含量高, 而土壤有机质为微生物生长和繁殖提供了碳源和氮源, 随着土层的加深, 土壤有机质含量急剧下降, 土壤微生物生物量碳、氮含量也随之降低。会仙湿地微生物生物量碳、氮与土壤有机碳、全氮间呈极显著正相关关系(表2), 这与刘银银等[30]在洞庭湖典型湿地的研究结果一致。吴金水[31]认为, 在同一土壤中, 微生物变化与土壤有机碳的变化密切相关, 这是因为土壤有机碳控制着土壤微生物介导的能量和营养物质循环, 土壤有机碳含量越高, 土壤微生物丰度越高[25]。表明土壤微生物生物量碳氮可以敏感指示土壤碳氮的变化, 另外, 土壤微生物生物量碳氮与土壤pH、土壤含水量、SOC、TN、TK、AN和AK之间显著相关(<0.05), 说明土壤生物微生物量也受土壤理化性质的重要影响。华克莎拉群落的土壤微生物量碳氮含量居各群落之首, 这与土壤有机碳和全氮含量的分布相一致, 进一步证明微生物生物量碳氮与土壤碳氮关系密切。随着水位梯度的增加, 土壤MBC和MBN在积水沼泽区域(华克拉莎群落)较高, 高于深水区域(莲群落和水毛花群落), 这与其他研究结果类似[32], 杨桂生等人的研究也表明随积水位升高小叶章湿地土壤生物微生物量碳明显下降[33]。
土壤基础呼吸反映土壤基质特性和微生物对有机碳的利用效率, 可敏感地反映土壤有机碳的变化特征, 对生态系统结构与功能产生重要影响。土壤微生物呼吸作用主要受土壤有机质中碳底物的调控, 而表层凋落物为微生物呼吸提供了大量的碳底物[34], 随着土层深度的增加, 土壤孔隙度变小, 土壤微生物活动受到限制, 土壤有机质和氮含量下降, 因此会仙湿地土壤基础呼吸和呼吸势随土层深度的增加而减弱(图3)。另外, 土壤微生物呼吸还受多植被类型、渍水时间、温度、根系等因素的影响[35]。总体来看, 相对于喀斯特陆地生态系统[36], 会仙湿地优势植物群落的土壤微生物熵较低, 说明好氧微生物的活性受到了水分(水淹)条件的抑制。qMB是衡量土壤有机碳积累或损失的一个重要指标, 该比值高表示土壤有机碳处于积累状态[37].本研究中, 田间鸭嘴草群落的土壤微生物熵在3个土层中都显著高于其它群落, 说明鸭嘴草群落中大量凋落物输入使得可供微生物利用的碳增多, 暗示土壤碳处于积累状态, 微生物对土壤碳库的利用效率在逐渐提高, 土壤质量得到改善。qCO2反映了土壤微生物利用碳源的效率, 该值大, 意味着微生物呼吸消耗的碳比例较大。本研究中铺地黍、菰和华克莎拉群落的代谢熵随土层的加深而减小, 柳叶箬群落则是先减后加的趋势, 表明这四个植物群落表层土壤微生物活跃, 这几个群落的qCO2较小, 说明土壤中碳的利用率和微生物活性较高, 因此土壤微生物呼吸消耗的碳较多。
图3和图4表明, 土壤水分明显影响土壤微生物活性的含量。在水位梯度变化下, 河岸附近(水位最低)或深水区(水位最高)都不利于土壤基础呼吸, 积水水位过高(如长期水淹)明显抑制土壤呼吸。随着积水水位的增加, 代谢熵(qCO2)值明显增大, 变化趋势与微生物熵(qMB)正好相反, 这说明随着积水水位的增加对微生物的胁迫在增强, 积水水位过高, 由于对土壤微生物群落产生明显胁迫作用, MBC较小, 土壤微生物活性受到抑制, 这与杨桂生等[29]对不同水分梯度小叶章湿地微生物活性研究结果相似。因为随着水位的增加, 氧气进入土壤的能力下降[38], 不利于好氧微生物和它们的代谢。相关性分析表明(表2), 微生物生物量碳氮、土壤基础呼吸和呼吸势等微生物活性特征可以作为土壤有机碳和全氮含量变化的指示性指标。加强保护会仙喀斯特湿地乡土优势植物群落, 这对于改良该区域土壤质量有很大的潜在价值。在湿地生态恢复过程中要充分考虑水分、植被和微生物对土壤养分的影响, 以乡土植被自然恢复为主, 适当辅以人为景观, 在湿地生态系统保护与生态旅游产业发展之间寻求平衡点, 实现桂林会仙喀斯特国家湿地公园的可持续发展。本研究所涉的土壤环境因子有限, 而其他环境因子(土壤容重、土壤温度、电导率等)的不同可能也是影响土壤微生物活性特征的因素, 还需进一步研究。
5 结论
(1)除河岸附近的铺地黍和柳叶箬群落外, 其它水位梯度下植物群落的土壤pH均呈弱碱性, 含水量随着土层的加深而降低, 且土壤pH值和含水量随水位梯度的增加而升高。积水沼泽区域的华克拉莎群落土壤有机碳、全氮、速效氮和速效钾含量都高于其它群落, 说明其土壤质量较好。
(2)水位梯度变化对会仙喀斯特湿地土壤TOC、TN、MBC、MBN、BR、qMB、qCO2影响显著, 随积水水位的增加, 土壤微生物活性呈现降低的趋势。在河岸带和积水沼泽区域, 表层土壤的微生物活跃, 反映了土壤中碳的利用率和微生物活性较高。
(3)会仙喀斯特湿地不同植被群落土壤微生物活性有明显的差异, 沿水分梯度, pH、土壤含水量和土壤养分变化是调控土壤微生物活性变化的主要因子。
[1] 刘凯, 李希来, 金立群, 等. 黄河源湖泊湿地退化过程土壤和植被的变化特征[J]. 生态科学, 2017, 36(3): 23–30.
[2] VERHOEVEN J T A, ARHEIMER B, YIN C, et al. Regional and global concerns over wetlands and water quality[J]. Trends in ecology & evolution, 2006, 21(2): 96–103.
[3] TILMAN D. The resource–ratio hypothesis of plant succession[J]. The American Naturalist, 1985, 125(6): 827–852.
[4] LOST S, LANDGRAF D, MAKESCHIN F. Chemical soil properties of reclaimed marsh soil from Zhejiang Province P.R China[J]. Geoderma, 2007, 142(3-4): 245–250.
[5] 彭佩钦, 张文菊, 童成立, 等. 洞庭湖典型湿地土壤碳、氮和微生物碳、氮及其垂直分布[J]. 水土保持学报, 2005, 19(4): 49–53.
[6] 傅国斌, 李克让. 全球变暖与湿地生态系统的研究进展[J]. 地理研究, 2001, 20(1): 120–128.
[7] LUNDQUIST E J, JACKSON L E, SCOW K M, et al. Changes in microbial biomass and community composition, and soil carbon and nitrogen pools after incorporation of rye into three California agricultural soils[J]. Soil Biology and Biochemistry, 1999, 31(2): 221–236.
[8] 刘兴土. 三江平原沼泽湿地的蓄水与调洪功能[J]. 湿地科学与管理, 2007, 1(3): 18–22.
[9] 徐惠风, 刘兴土, 白军红. 长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J]. 水土保持学报, 2004, 18(3): 115–118.
[10] GIL-SOTRES F, TRASAR-CEPEDA C, LEIRÓS M C, et al. Different approaches to evaluating soil quality using biochemical properties[J]. Soil Biology and Biochemistry, 2005, 37(5): 877–887.
[11] SCHLESINGER W H, ANDREWS J A. Soil respiration and the global carbon cycle[J]. Biogeochemistry, 2000, 48(1): 7–20.
[12] ANDERSON T H, DOMSCH K H. The Metabolic quotient for CO2(qCO2) as a specific activity parameter to assess the effects of environmental conditions, such as pH, on the microbial biomass of forest soils[J]. Soil Biology and Biochemistry, 1993, 25(3): 393–395.
[13] 王军静, 白军红, 赵庆庆, 等. 哈拉海湿地芦苇沼泽土壤碳、氮、磷含量的剖面特征[J]. 湿地科学, 2014, 12(6): 690–696.
[14] 宋长春, 王毅勇, 阎百兴, 等. 沼泽湿地开垦后土壤水热条件变化与碳、氮动态[J]. 环境科学, 2004, 25(3): 150–154.
[15] 迟光宇, 王俊, 陈欣, 等. 三江平原不同土地利用方式下土壤有机碳的动态变化[J]. 土壤, 2006, 38(6): 755–761.
[16] 张珍明, 林绍霞, 林昌虎, 等. 不同土地利用方式下草海高原湿地土壤碳、氮、磷分布特征[J]. 水土保持学报, 2013, 27(6): 38–47.
[17] 章文龙, 曾从盛, 陈晓艳, 等. 闽江河口湿地土壤速效磷时空分布与来源[J]. 生态学杂志, 2015, 34(1): 168–174.
[18] 陈志杰, 韩士杰, 张军辉. 土地利用变化对漳江口红树林土壤有机碳组分的影响[J]. 生态学杂志, 2016, 35(9): 2379–2385.
[19] 李晖, 黄培芳, 黄晓维, 等. 桂林会仙湿地土壤有机质、氮、磷含量与芦苇的响应研究[J]. 安徽农业科学, 2012, 40(6): 3295–3297.
[20] 吴应科, 莫源富, 邹胜章. 桂林会仙岩溶湿地的生态问题及其保护对策[J]. 中国岩溶, 2006, 25(1): 85–88.
[21] 韦峰. 桂林会仙喀斯特湿地生物多样性及保护研究[D]. 桂林: 广西师范大学, 2010.
[22] 鲍士旦. 土壤农业化学分析[M]. 北京: 中国农业出版社, 2000.
[23] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 中国气象出版社, 2006.
[24] HOFMAN J, BEZCHLEBOVÁ J, DUŠEK L, et al. Novel approach to monitoring of the soil biological quality[J]. Environment International, 2003, 28(8): 771–778.
[25] 肖烨, 黄志刚, 武海涛, 等. 三江平原4种典型湿地土壤碳氮分布差异和微生物特征[J]. 应用生态学报, 2014, 25(10): 2847–2854.
[26] 张宏斌, 孟好军, 赵维俊, 等. 黑河流域中游芦苇湿地土壤碳垂直分布特征[J]. 生态科学, 2016, 35(2): 123–127.
[27] 王盼盼, 李艳红, 徐莉. 艾比湖湿地典型植物群落下土壤有机质空间变异性研究[J]. 生态科学, 2015, 34(4): 131–136.
[28] TIAN Hanqin, CHEN Guangsheng, ZHANG Chi, et al. Pattern and variation of C: N: P ratios in China’s soils: a synthesis of observational data[J]. Biogeochemistry, 2010, 98(1-3): 139–151.
[29] MANZONI S, TROFYMOW J A, JACKSON R B, et al. Stoichiometric controls on carbon, nitrogen, and phosphorus dynamics in decomposing litter[J]. Ecological Monographs, 2010, 80(1): 89–106.
[30] 刘银银, 孙庆业, 李峰. 洞庭湖典型湿地植被群落土壤微生物特征[J]. 生态学杂志, 2013, 32(5): 1233–1237.
[31] 吴金水. 土壤有机质及其周转动力学[C]//何电源主编.中国南方土壤肥力与栽培作物施肥. 北京: 科学出版社, 1994: 37–46.
[32] XIAO Ye, HUANG Zhigang, LU Xianguo. Changes of soil labile organic carbon fractions and their relation to soil microbial characteristics in four typical wetlands of Sanjiang Plain, Northeast China[J]. Ecological Engineering, 2015, 82: 381–389.
[33] 杨桂生, 宋长春, 王丽, 等.水位梯度对小叶章湿地土壤微生物活性的影响[J]. 环境科学, 2010, 31(2): 444–449.
[34] MAIER C A, KRESS L W. Soil CO2evolution and root respiration in 11 year–old loblolly pine () plantations as affected by moisture and nutrient availability [J]. Canadian Journal of Forest Research, 2000, 30(3): 347–359.
[35] 仲启铖, 关阅章, 刘倩, 等. 水位调控对崇明东滩围垦区滩涂湿地土壤呼吸的影响[J]. 应用生态学报, 2013, 24(8): 2141–2150.
[36] 杨刚, 何寻阳, 王克林, 等. 不同植被类型对土壤微生物量碳氮及土壤呼吸的影响[J]. 土壤通报, 2008, 39(1): 189–191.
[37] SINGH J S, RAGHUBANSHI A S, SINGH R S, et al. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna[J]. Nature, 1989, 338(6215): 499–500.
[38] GAMBRELL R P, DELAUNE R D, PATRICK W H. Redox processes in soils following oxygen depletion[A]. In: JACKSON MB, DAVIES D D, LAMBERS H, (eds.). Plant Life Under Oxygen Deprivation[J]. The Hague, The Netherlands: SPB Academic Publishing BV, 1991: 101–117.
Soil nutrient distributions and microbial activities characteristics of different plant communities in the Huixian Karst Wetland, Guilin, China
LI Yanqiong1, SHEN Yuyi2, HUANG Yuqing1, XU Guangping1,*, PU Gaozhong1, HE Chengxing1, WANG xingui1, MO Ling1
1. Guangxi Key Laboratory of Plant Conservation and Restoration Ecology in Karst Terrain, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China 2.Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China
Vegetation types have an impact on the soil properties and may further alter the microbial activities. In order to reveal the effects of vegetation types on the soil physicochemical properties and microbial activities along a water table gradient, pH, soil nutrients, i.e. soil organic carbon (SOC), total nitrogen (TN), total potassium (TK), available nitrogen (AN) and available potassium(AK) concentrations and microbial activity index, i.e. microbial biomass carbon/nitrogen (MBC/MBN), basal respiration(BR), potential respiration (PR), microbial quotient (qMB) and metabolic quotient (qCO2) were measured from 8 kinds of plant communities in the Huixian wetland. The correlations among soil nutrients and soil microbial activity indictors were also examined. The results showed are as follows. 1) The soil pH is weakly alkaline for most of the plant communities in the Huixian wetland, soil moisture content decreased with soil depth, and both of them increased with the depth of water levels. 2) The contents of soil organic carbon, total nitrogen, available nitrogen and available potassium decreased with soil depth. The content of MBC / MBN (except) and the value of BR/PR also decreased with soil depth for every plant community, which showed significantdifferences among soil layers(<0.05). However, there were no obvious change regularities among soil layers for qMB and qCO2. 3) Among 8 different plant communities, the contents of SOC, TN, AN, AK, MBC, MBN and the values of BR, PR ofwere the highest, and the value of qMB ofwas significantly higher than that of others (<0.05). 4) There were significantly positive correlations among MBC/MBN/BR/PR and SOC/TN (<0.01), and qMB and TK/AN were also positively correlated (<0.05). It showed that there were close interactions between soil nutrients and microbial activities in the Huixian karst wetland. Soil microbial activities could indicate the status of soil nutrients and quality.
karst wetland; vegetation community types; soil microbial activity; soil nutrient
10.14108/j.cnki.1008-8873.2018.04.003
S154.1
A
1008-8873(2018)04-024-11
2017-09-22;
2017-10-29
国家自然科学基金项目(31760162, 41361057, 41603079); 广西林业科技项目(桂林科字[2013]第14号); 广西喀斯特植物保育与恢复生态学重点实验室基金项目(17-259-23); 广西科技攻关计划项目(桂科攻14124004-3-5, 桂科AB16380250); 广西自然科学基金项目(2017GXNSFBA 198037)
李艳琼(1990—), 女, 湖南邵阳人, 硕士, 研究实习员, 主要从事环境生态学研究, Email: liyqcsuft@163.com
徐广平, 男, 博士, 副研究员, 主要从事生态学的研究, Email: xugpgx@163.com
李艳琼, 沈育伊, 黄玉清, 等. 桂林会仙喀斯特湿地不同植物群落土壤养分分布差异与微生物活性特征[J]. 生态科学, 2018, 37(4): 24-34.
LI Yanqiong, SHEN Yuyi, HUANG Yuqing, et al. Soil nutrient distributions and microbial activities characteristics of different plant communities in the Huixian Karst Wetland, Guilin, China[J]. Ecological Science, 2018, 37(4): 24-34.
