HO-1修饰的BMMSC对大鼠小肠移植免疫功能的影响
2018-09-10宋红丽杨洋尹明丽郑卫萍刘涛董冲沈中阳天津市第一中心医院器官移植外科天津市器官移植重点实验室天津市器官移植临床医学研究中心天津3009天津市第一中心医院卫生部危重病急救医学重点实验室天津3009
宋红丽,杨洋,尹明丽,郑卫萍,刘涛,董冲,沈中阳(.天津市第一中心医院器官移植外科,天津市器官移植重点实验室,天津市器官移植临床医学研究中心,天津3009;.天津市第一中心医院,卫生部危重病急救医学重点实验室,天津 3009)
小肠移植(small bowel transplantation,SBT)是公认的能够挽救小肠功能衰竭合并全胃肠外营养并发症患者的有效治疗手段[1-2]。但由于小肠富含淋巴组织以及肠腔内存在大量细菌,小肠移植排斥反应明显,目前尚无有效的控制手段。现有的免疫抑制治疗效果不佳,并会带来一些相应的风险,如恶性肿瘤、感染及高额费用等,这些将会严重影响小肠移植受者长期的存活率,也制约了小肠移植事业的发展。免疫耐受是一种受体免疫系统对移植物长期特异性的不应答状态,仍然具有正常的针对其他外来抗原的免疫应答能力。因此,如何诱导一种持久稳定且无需药物的免疫耐受是迫切需要解决的问题[3]。
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)在器官移植中具有重要的应用价值[4]。BMMSC具有低免疫原性,对于抑制器官移植后T细胞介导的免疫排斥具有一定的效果[5-6]。其能够通过分泌一些免疫抑制细胞因子如白细胞介素 -10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)等以及干扰辅助性T淋巴细胞的分化来诱导免疫耐受[7-8],是一种具有应用前途的治疗方法。但也有报道单纯BMMSC输注在组织内的活性偏低[9],而研究证明,应用基因工程方法干预BMMSC的基因表达是一个有效的方法[10]。血红素加氧酶1(hemeoxygenase 1, HO-1)是一种具有免疫调节作用的活性因子,参与器官移植后免疫耐受的调控过程[11]。HO-1可以转染到BMMSC上,并增强BMMSC的活性,从而增强其免疫调节和抗氧化能力,同时还可以延长其作用时间[12]。
本研究在单纯应用BMMSC保护小肠移植排斥反应的基础上,以腺病毒为载体将大鼠HO-1基因体外转染BMMSC形成HO-1/BMMSC,研究其对大鼠异位小肠移植排斥反应的影响,探讨HO-1是否能增强BMMSC在移植免疫中的调节作用以及其作用机制。
1 材料和方法
1.1 主要试剂和实验器材:DMEM/F12(1:1)培养基(Hyclone,美国),胎牛血清(PAA,澳大利亚),谷氨酸胺、青霉素/链霉素双抗混合液(Gibco,美国),胰蛋白酶消化液、二甲基亚砜、磷酸盐缓冲溶液(Sigma,美国),10×红细胞裂解液(BD,美国),大鼠IL-10、TGF-β、白细胞介素-2(interleukin-2,IL-2)、白细胞介素 -17(interleukin-17,IL-17)、白细胞介素-23 (interleukin-23,IL-23)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(Santa cruz biotechnology,美国),表达大鼠HO-1的重组腺病毒 (上海吉凯基因化学技术有限公司,中国)。Leica c0269手术显微镜(Leica microsystems AG,德国),显微手术器械 (金钟医疗器械,中国),正置荧光显微镜(Nikon Ni-U,日本),流式细胞仪(BD FACSCalibur,美国),酶标仪(Bio Tek Synergy 2,美国)。
1.2 实验动物、分组及处理:实验动物购自军事医学科学院实验动物中心SPF级健康雄性BN大鼠(RT-1n)及雄性Lewis大鼠(RT-11),BN大鼠体重180~200 g,Lewis大鼠200~220 g。动物购进后置于光照与黑暗每12小时循环的环境,适应性喂养7天。以BN大鼠为供体,Lewis大鼠为受体,建立异基因(allogeneic,Allo)急性排斥反应模型,实验鼠术后经阴茎背静脉注射生理盐水或细胞,供受体术前分别禁食24小时和12小时。实验分为生理盐水 (NS) 组、BMMSC组和HO-1/BMMSC组,每组分别在0、1、5、7、10天各个时间点分配5只实验鼠。实验各组均选择输注细胞5×106/ml剂量(1 ml/只鼠),对照组输注NS(1 ml/只鼠)。观察移植术后各个时间点分别处死的实验大鼠,收集外周静脉血及组织标本。
1.2.1 异位小肠移植动物模型的建立方法同之前的研究[7]。将供体小肠的肠系膜上动脉及门静脉分别于受体大鼠的腹主动脉及下腔静脉做端侧吻合。吻合完毕后开放血流,于下腹两侧腹壁分别戳孔将移植肠两断端牵引出腹腔行造瘘。温生理盐水冲洗腹腔后关腹。烤灯加温保暖至受体大鼠清醒。
1.2.2 受体术后护理:术后给予单笼喂养,清醒后即可自由饮水,12小时后给予自由进食。定期清洗消毒笼具并更换敷料保持清洁。每天至少巡视3次,对堵塞的造瘘口进行护理。观察移植大鼠术后的生存状态并记录各组大鼠生存时间。
1.3 实验方法
1.3.1 BMMSC的提取、培养以及HO-1转染BMMSC与验证的方法参照我们之前的研究[10]。应用免疫细胞化学荧光染色检测HO-1/BMMSC中HO-1的表达,步骤如下:将灭菌后的盖玻片置于无菌的培养皿底部,取5 ml 腺病毒载的HO-1转染的BMMSC悬液(密度为1×106/ml)加入培养皿进行爬片;待细胞生长融合后用PBS漂洗3次;4%多聚甲醛处理20分钟,漂洗;0.5% Txiton X-100室温处理20分钟,漂洗;3% H2O2室温处理15分钟,漂洗;100 ml/L正常羊血清封闭液封闭l小时;在玻片上滴加浓度为1:100的兔抗鼠HO-1抗体,4℃冰箱过夜;漂洗后滴加浓度为1:400的PE标记的羊抗兔免疫荧光抗体,37℃水浴箱中避光孵育1小时;漂洗后封片,于荧光显微镜下观察红色荧光。
1.3.2 组织病理学检测及急性排斥反应评分:分别于术后1、5、7、10天搜集各组移植肠标本行组织病理学检测,光学显微镜观察组织病理学改变,按急性排斥评分标准对各组大鼠各时间点排斥反应程度进行评分并进行统计学分析。
光学显微镜下随机选择5个视野观察两组动物在各时间点的病理改变,并根据Wu等[13]报道的小肠移植排斥评分标准进行排斥反应评分。此标准依据黏膜层及黏膜下层细胞浸润、腺窝上皮损伤、腺窝调亡小体形成、结构破坏及黏膜溃疡程度,将小肠移植排斥反应程度划分为不明确的、轻度的、中度的以及重度的排斥反应。
1.3.3 受体大鼠NK细胞活性检测:提取各组受体鼠脾脏淋巴细胞与靶细胞YAC-1细胞共培养,通过测定乳酸脱氢酶的释放量计算NK细胞的活性,统计学分析各组间差异。
1.3.4 免疫相关细胞因子检测:酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测各组大鼠在各时间点血清的IL-10、TGF-β、IL-2、IL-17、IL-23及TNF-α的水平。具体步骤按照试剂盒说明书操作。
1.3.5 流式细胞术检测脾脏Tregs水平:分离受体鼠脾淋巴细胞,PBS重悬至1×107/ml,取0.1 ml分别加入抗 CD4 抗体 0.5 μl,抗 CD25 抗体 0.625 μl,4℃避光孵育30分钟。PBS洗涤后加入穿孔素1 ml,4℃避光孵育过夜。PBS洗涤并定容至0.1 ml,加入抗Foxp3抗体5 μl,4℃避光孵育2小时。PBS洗涤后固定于4%的多聚甲醛等待上机检测。流式细胞术检测其中CD4+、CD25+、Foxp3+和Tregs的变化,统计学分析各组间差异。
1.4 统计分析:用GraphPad Prism 5.0软件进行数据分析和图片制作,应用SPSS统计学软件(19.0版)进行统计学分析。数据比较如为两组间的,则用Student'st检验;如为3组及以上,则用单因素方差分析 (One-Way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 体外提取BMMSC和制备HO-1/BMMSC
2.1.1 大鼠BMMSC的培养和鉴定:体外成功培养和扩增出大鼠BMMSC。可从以下三个方面对其进行鉴定:① 细胞贴壁生长,传代后的细胞呈长梭形,部分呈漩涡或菊花状排列,具备典型的BMMSC形态特征 (图1a)。② 细胞能够诱导分化成为脂肪细胞(油红O染色显示胞浆内出现红色脂滴,图1b)和成骨细胞(von Kossa染色显示细胞中出现黑色钙盐) (图1c)。③ 细胞表面标记检测显示CD29+CD34-、CD90+CD45-和 RT1A+RT1B-的阳性率分别为99.5%、99.8%和98.5% (图1g,h,i)。
2.1.2 重组腺病毒载体能够成功介导HO-1基因到BMMSC中:用表达HO-1基因的重组腺病毒感染BMMSC,Ad-GFP作为对照。感染后48小时观察细胞,荧光显微镜发现细胞中绿色荧光表达阳性率>80% (图1d),免疫组化检测发现Adv-HO-1/BMMSC组红色标记的HO-1表达量明显高于单纯Adv/BMMSC 组(图 1e ~ f),HO-1基因表达明显上调,表达量约为对照细胞的5倍。以上这些结果表明腺病毒介导的HO-1成功在BMMSC中过表达。HO-1转染成功,为下一步实验打下基础。
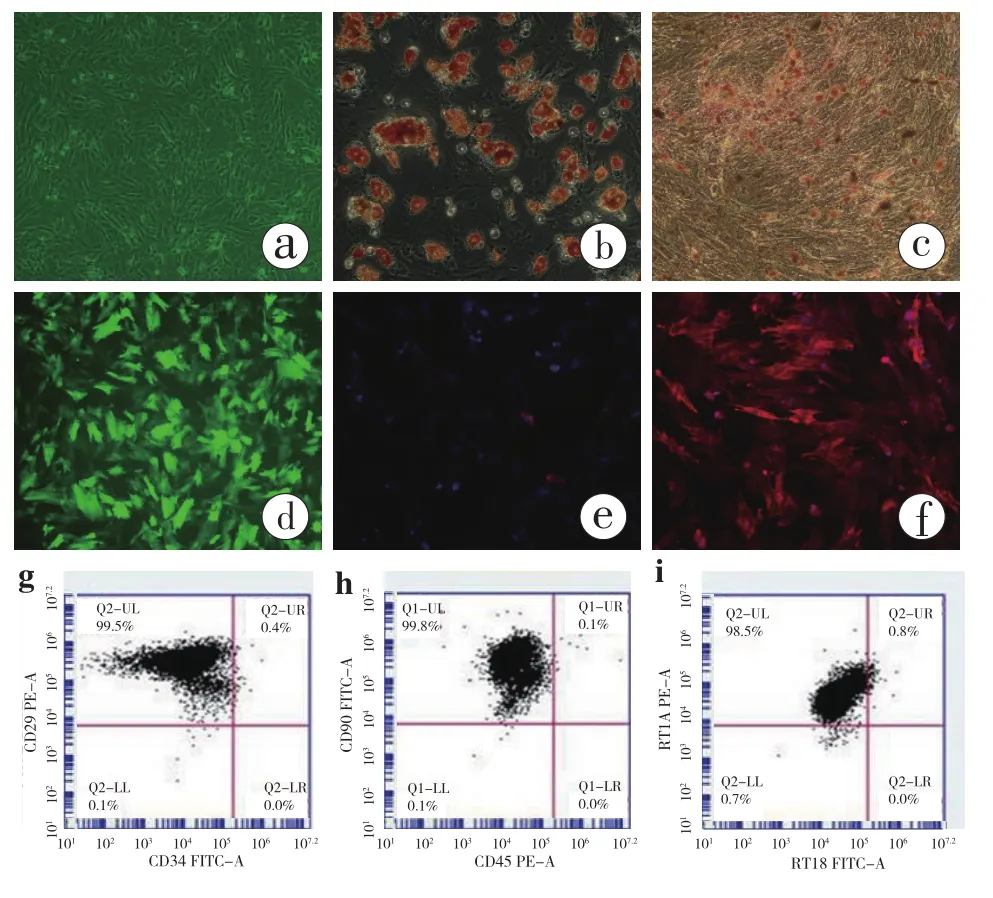
图1 BMMSCs形态、特性、表型及转染HO-1
2.2 大鼠小肠移植排斥反应模型建立成功
2.2.1 一般表现和生存时间:BMMSC治疗在一定程度上减轻了移植大鼠的急性排斥症状,受体大鼠的精神状态、活动以及对外界刺激的反应均有一定程度的好转,生存率也有显著提高,但总体效果还是不太令人满意。HO-1/BMMSC组的观察结果则十分令人鼓舞,在整个观察期内,大部分受体鼠的生存状况良好,没有出现典型的急性排斥反应症状。各组的中位生存时间分别为:NS组10天、BMMSC组15天和HO-1/BMMSC组24天。HO-1/BMMSC治疗进一步提高了移植大鼠的生存率,与BMMSC组相比,差异具有统计学意义。
2.2.2 各组移植小肠的病理表现(图2):NS组移植肠表现为进行性加重的急性排斥反应。黏膜及黏膜下层逐渐加重的炎性细胞浸润,腺窝上皮损伤及调亡小体形成,小肠绒毛破坏以及黏膜溃疡出血。BMMSC组移植肠在5天及7天时的病理改变大大减轻,一般仅有少至中等量的炎性细胞浸润以及有限的腺窝上皮损伤及调亡等轻至中度的排斥反应表现,而10天时虽然也相对好转,但依然表现出中至重度的急性排斥反应。HO-1/BMMSC治疗组在各时间点的病理学表现较BMMSC组明显改善,特别是在第10天,仅有少数发展为中度急性排斥反应。
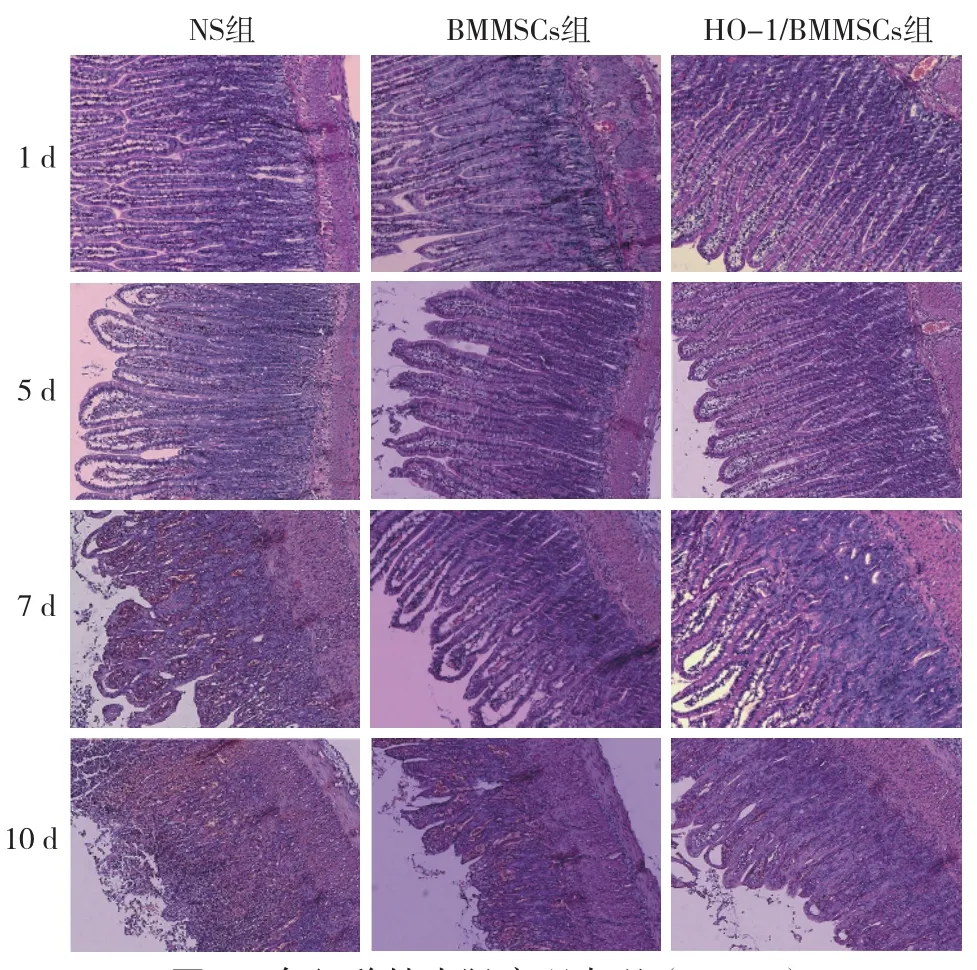
图2 各组移植小肠病理表现(100×)
2.3 BMMSC过表达HO-1诱导大鼠脾脏Treg细胞高水平持久表达:经流式细胞术检测发现,BMMSC 治疗显著增加了 CD4+、CD25+、Foxp3+和Tregs的表达水平,在7天时达到峰值,10天时出现回落现象(图3a)。HO-1/BMMSC组Tregs水平呈现快速稳步上升,10天时依然保持在高水平。统计学分析显示,HO-1/BMMSC组较BMMSC组进一步提高了Tregs表达,尤其在第10天,差异具有统计学意义(图3b)。
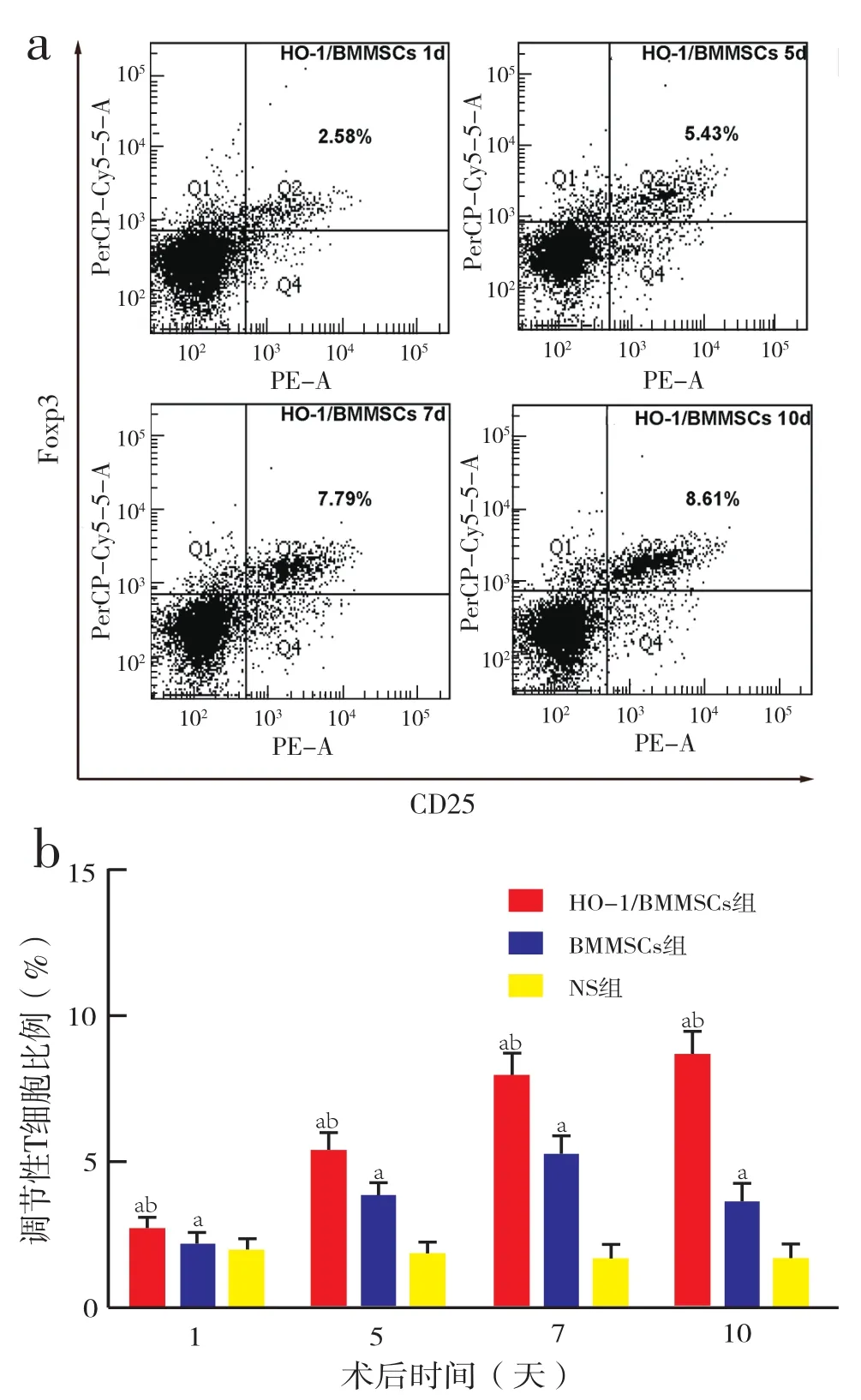
图3 受体脾中Tregs水平
2.4 过表达HO-1增强BMMSC对大鼠血清中细胞因子的调节(图4):ELISA检测结果发现,HO-1/BMMSC组血清IL-10及TGF-β等与抗炎或Tregs分化相关的细胞因子表达水平较对照组进一步升高。而与促炎或Th17分化相关的细胞因子IL-2、TNF-α及IFN-γ上升幅度较BMMSC组显著缩小,仅有小幅上升,IL-6、IL-17及IL-23呈现下降或较小幅度的波动,而不是如BMMSC组出现先下降后上升的趋势,且总体水平较BMMSC组表达水平则明显降低。差异具有统计学意义。
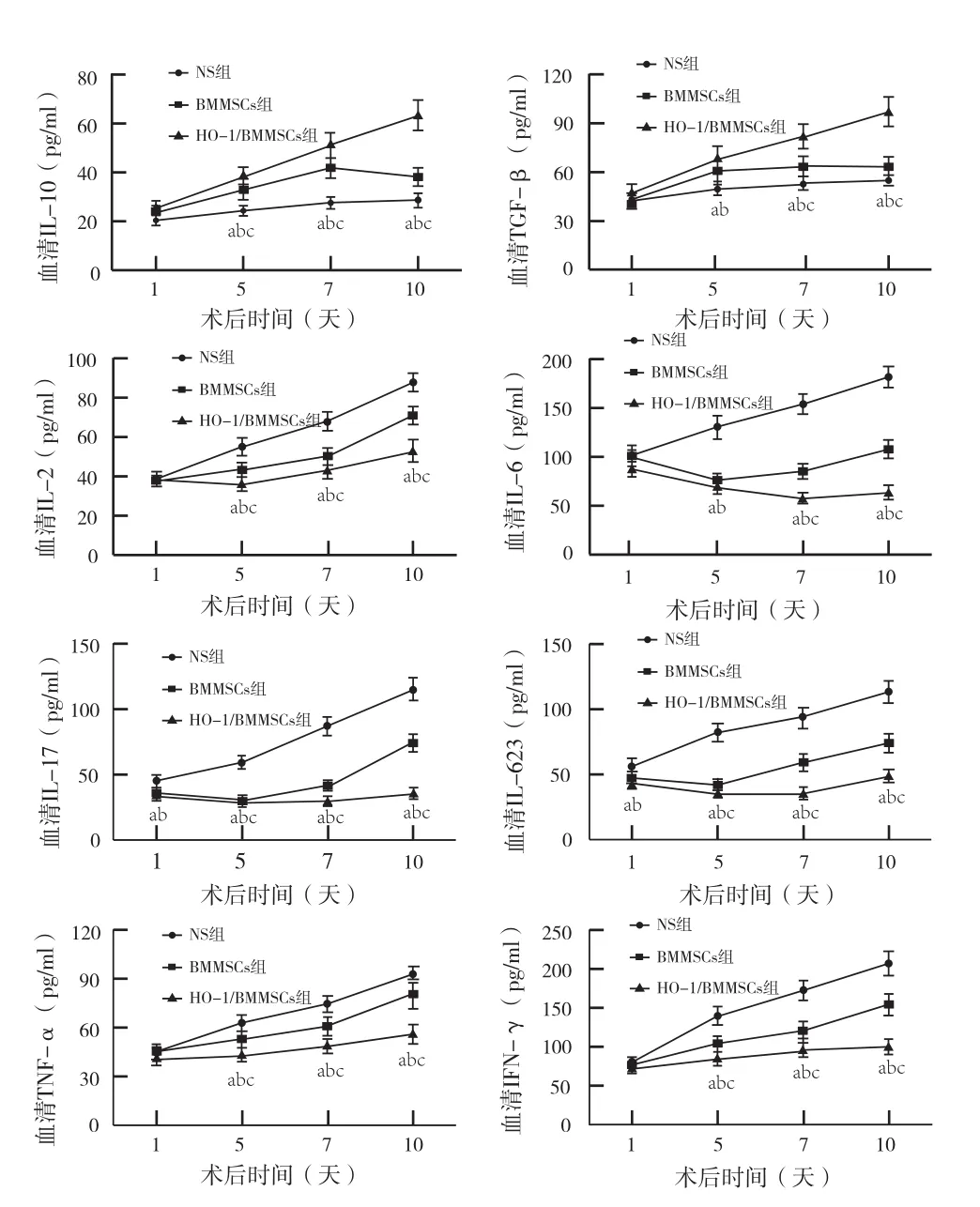
图4 血清中各细胞因子水平(与NS组相比,aP<0.05;与BMMSC组相比,bP<0.05;与HO-1/BMMSC相比,cP<0.05)
2.5 过表达HO-1增强BMMSC对大鼠NK细胞活性的抑制(图5):BMMSC的治疗虽显著抑制了NK细胞活性,但在7天和10天时,NK细胞活性依然呈现较大幅度的上升趋势, BMMSC组大致情况与此类似。HO-1/BMMSC组NK细胞活性在观察期内则无明显大幅上升趋势,仅仅是围绕正常水平上下波动。统计分析结果表明,NK细胞活性在HO-1/BMMSC组进一步降低至接近正常范围,差异具有统计学意义。
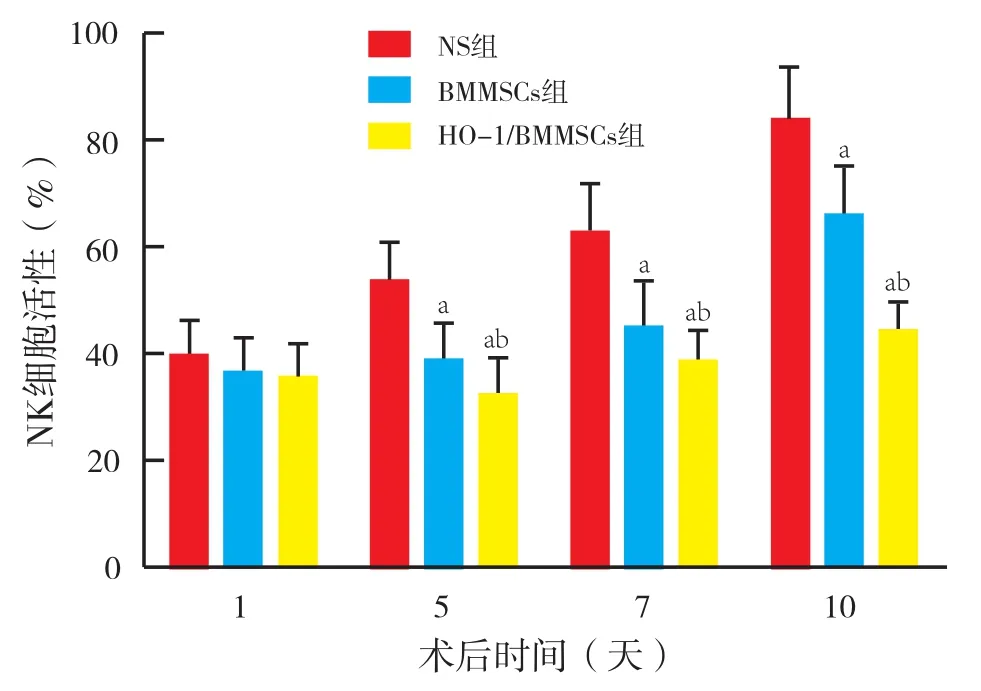
图5 NK细胞活性
3 讨 论
尽管随着新型免疫抑制剂的问世和不断发展,目前临床小肠移植排斥反应得到了较好的控制,但排斥反应的发生率依然很高。有报道称小肠移植术后的急、慢性排斥反应的发生率分别可达90%及30%~50%[14]。而长期使用免疫抑制剂增加了发生高血压、肾毒性、神经毒性、术后肿瘤以及代谢性疾病等不良反应的风险[15]。因此,寻找一种全新的不良反应少的免疫抑制策略显得尤为必要。
由于干细胞(mesenchymal stem cell, MSC)具有低免疫原性、较低的抗原提呈能力以及独特的免疫调节作用,使其能够在体内及体外影响免疫系统,如T细胞、B细胞、NK细胞、单核细胞以及树突状细胞[16-18],从而逃避免疫识别,抑制免疫应答[19]。目前,MSC已经被应用于几乎所有的器官移植基础研究中,同时发现体内移植的MSC具有归巢的特点,在多种因素的作用下,外源性的或自体的MSC能够定向趋向性迁移并定植于靶向组织[20-21]。并被证实在减轻移植免疫及诱导器官移植免疫耐受上发挥重要作用[22]。
MSC能够迁移至炎症性的结肠并发挥抗炎及调节免疫的作用[23],但其肠道定植率极低,MSC被认为至少是部分通过旁分泌发挥治疗作用的。同时,由于局部组织的缺血、缺氧以及炎症反应,MSC移植后的存活率极低,移植后4天存活的细胞数量明显下降,而只有不到1%的细胞存活超过1周[24]。无论MSC是通过何种途径发挥其再生、抗炎以及免疫调节作用的,其效应均严重受限于体内低下的生存率。我们的研究中发现,BMMSC虽然减轻了小肠移植大鼠的急性排斥反应,但这种效应维持的时间较为有限,一般在7天内效果比较显著,而7天后便大大减弱。病理学检测10天时,BMMSC治疗组组织结构破坏严重,大量炎性细胞浸润,调亡细胞较前显著增多,表现为中至重度的排斥反应。排斥评分虽较NS组降低,但受体鼠的生存状况及病理学改变均较前显著加重。各种检测结果提示,BMMSC组在抑制NK细胞活性、调节细胞因子表达水平以及诱导Tregs生成等方面均不能维持1周内的良好态势。这均与BMMSC移植体内1周后存活率显著降低有关。为了改善BMMSC移植体内后的生存率,我们的研究引入了HO-1这种细胞保护性的基因。
HO-1是HO的诱导型,是一种细胞保护性酶,通过发挥抗炎、抗调亡、抗氧化应激以及抗缺血/再灌注损伤等效应而起到保护细胞的作用[25-27]。研究发现,HO-1对各种原因引起的肠道损伤同样具有保护及修复作用,其主要机制包括抗氧化、抗炎、抗调亡以及调节微循环的作用等[28-30]。另外,HO-1对MSC具有调控作用,能够在缺氧和氧化应激状态下减轻MSC的调亡[31]。然而,在器官移植的研究中,HO-1亦具有减轻排斥反应、延长移植物存活时间甚至诱导移植物免疫耐受的作用[32-33]。本研究将HO-1通过基因工程修饰BMMSC,一方面希望借助这种具有细胞保护作用的酶能够提高BMMSC在小肠移植大鼠体内的存活率,另一方面希望HO-1与BMMSC两者的免疫抑制效应叠加,从而发挥更强大的免疫抑制效应,进而更好地控制小肠移植排斥反应。结果发现,小肠移植排斥反应中,NK细胞是参与其中的效应细胞之一,使用未处理的BMMSC治疗时,NK细胞的活性虽有显著降低,但依然呈现出上升的趋势,而使用HO-1基因转染的细胞治疗后,NK细胞的活性被抑制在正常范围内,并没有出现大幅度地升高,我们推测这是因为BMMSC在体内的存活时间延长发挥了更持久的免疫抑制作用,同时也可能与过表达的HO-1的免疫调节相关。
器官移植中移植物排斥反应是由T细胞介导的针对供体抗原的免疫反应,Th1、Th2、Th17及Tregs 等CD4+的Th细胞分别发挥着不同的免疫效应,Th1/Th2及Th17/Treg的比率在调节T细胞免疫反应中发挥重要的作用[34]。Th1细胞主要分泌IL-2、IFN-γ以及TNF-α,而Th2细胞主要分泌IL-4、IL-10以及IL-13。Th1/Th2比率及二者相关细胞因子常被用来解释器官移植免疫相关现象[35]。Th17细胞的特点是分泌细胞因子IL-17、IL-21及IL-22[36],其分化需要 TGF-β 和 IL-6 的参与[37],其表型的稳定需要 IL-23、TNF-α及IL-1β[38]。Tregs则通过分泌IL-10及TGF-β产生抗炎效应及促进自我耐受。Th17细胞及其细胞因子IL-6、IL-17及IL-23可能介导移植排斥[39]。而Tregs则可能阻止排斥反应的发生,甚至诱导并维持免疫耐受[40]。MSC的免疫调节作用与Tregs的扩增相关,其中一些研究中MSC可以诱导Foxp3+和Tregs依赖性的免疫耐受[41]。本研究中,炎症相关性细胞因子以及Th分化相关的细胞因子在BMMSC与HO-1/BMMSC治疗作用下均发生显著变化。具体来说,IL-10和TGF-β的浓度显著升高,而 IL-2、IL-6、IL-17、IL-23、TNF-α及IFN-γ浓度显著降低。不同的是,与单纯BMMSC组相比,HO-1/BMMSC组中升高IL-10、TGF-β以及降低IL-2、IL-6、IL-17、IL-23、TNF-α及IFN-γ 浓度更显著,甚至不同程度地逆转了IL-6、IL-17和IL-23的上升趋势。Tregs的变化也十分显著,HO-1/BMMSC不仅进一步上调了Tregs的表达,而且其高水平表达更为稳定持久。我们推测以上这些效应与HO-1保护BMMSC并增强其免疫调节的作用有关。
总之,本研究中与单独BMMSC相比,HO-1/BMMSC组对小肠移植排斥反应的抑制作用更强大更持久。主要是通过抑制免疫细胞如NK细胞、Treg细胞和细胞因子发挥作用的。
