人肝癌巴马小型猪异种移植模型的建立
2018-09-10吴嫣爽胡兴琳周晓囡雷蕾哈尔滨医科大学组织胚胎学教研室黑龙江哈尔滨150081
吴嫣爽,胡兴琳,周晓囡,雷蕾(哈尔滨医科大学组织胚胎学教研室,黑龙江 哈尔滨150081)
肝细胞癌(hepatocellular carcinoma, HCC)是临床常见原发性肿瘤,也是第三大癌症相关致死性疾病[1-2]。癌症动物模型在研究肿瘤病理生理学特征和药物治疗中扮演了重要角色。近年来,一些研究小组相继报道了动物HCC模型[3],这些研究大多使用化学药物破坏肝细胞功能,诱导肿瘤的发展[4]。这些模型虽然有效地获得了HCC动物模型,但是较长的建模时间以及较高的致死率限制了这些模型的应用。此外,这些 HCC动物模型中肿瘤细胞来源于动物自体细胞,与人类的肝癌细胞在生物学特性上还有一些区别,因此,人肿瘤细胞异种移植的动物模型可能更适用于临床应用性研究。
现有的人肿瘤细胞异种移植模型大多是啮齿类癌症模型[5],巴马小型猪在解剖和生理上与人类相似,更适合作为理想的动物模型用于人HCC的研究[6]。
Selek等[7]将人胶质瘤细胞移植到猪的顶叶,在给予免疫抑制剂的情况下,建立了低分化脑胶质瘤猪模型。Rai等[8]将人肝癌细胞通过门静脉植入免疫缺陷猪的肝脏内,虽然移植后一周在猪外周血中检测到人甲胎蛋白(alpha-feto protein,AFP)的表达,但最终未检测到肝肿瘤细胞。本研究通过腹腔镜原位移植人肝癌细胞,建立人HCC的猪模型,为HCC临床药物试验和猪肝脏内细胞移植等研究奠定了实验基础。
1 材料和方法
1.1 人肝癌细胞系HepG2-GFP-Puro的培养:含1%青链霉素、10%胎牛血清的高糖DMEM培养基,培养于5%CO2、37℃的培养箱中。
1.2 巴马小型猪肝损伤模型的建立:选取健康,月龄约为3个月,体重为16~25 kg的巴马小型猪。术前12小时禁止喂食和饮水。术前称重,经耳缘静脉缓慢注射丙泊酚10 mg每千克体重诱导麻醉,用呼吸麻醉机吸入1.5%~2.0%的异氟烷维持麻醉。将巴马小型猪固定在腹腔镜操作手术台上,在腹腔镜引导下,对巴马小型猪的肝左叶切除,切除完成后进行结扎,取出切除的部分肝脏。术后微创缝合伤口给予碘酒消毒,同时注射素青霉素80 U,链霉素40 U,1次/天,共3天,7天后对手术缝合的伤口进行拆线,每天检测体温和体重。
1.3 腹腔镜下HepG2-GFP-Puro植入巴马小型猪肝实质中:注射细胞前,将培养的HepG2-GFPPuro细胞消化为单细胞悬液,用PBS重悬后进行计数。通过腹腔镜操作,将细胞沿距离肝脏的断面2 cm左右注射入巴马小型猪的肝实质中,注射共约10个位点,每个位点约5×107个细胞。
1.4 实验分组:2.5~5.0月龄的15只雄性巴马小型猪(体重为12.0~25.2 kg) 作为实验动物,随机分组(表1)。G0组实验动物肝切除术后在距离断面约2 cm的位置注射0.2 ml生理盐水/位点,共注射10个位点,记为假手术组。G1和G2组实验动物总计移植5×108个细胞,G2组实验动物术后饲喂免疫抑制剂〔甲泼尼龙1 mg /(kg·d);他克莫司胶囊1 mg/ d,10天后,2 mg/ d;霉酚酸酯0.25 g/ d,2 周后 0.5 g/ d〕。
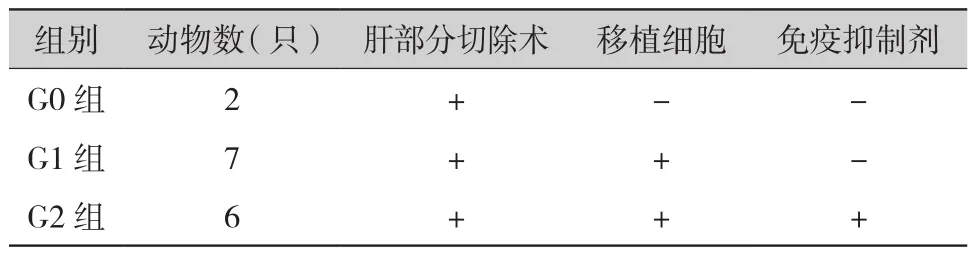
表1 实验分组
1.5 巴马小型猪术后采血:术后按照1、3、5、7、9、11、13、15天和3、4、5周的时间顺序采取猪的颈部静脉血,收集血清。
1.6 酶联免疫吸附试验(enzyme-linked immunosorbentassay,ELISA) 检测猪外周血清中人AFP表达量:按照Uscn公司的ELISA试剂盒说明书操作。用酶标仪在450 nm波长测量各孔的吸光度(A)值。根据浓度和A值绘出标准曲线,计算各孔样品的实际浓度。
1.7 血生化仪检测血清肝功能酶的变化情况:对分离的血清进行肝功能酶丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate transaminase,AST)的分析,同时抽取G0组静脉血为对照。
1.8 肝脏组织学形态的观察:观察各组肝脏的外观情况。每组样本取自肝右叶,在4%的甲醛溶液中固定,石蜡包埋、制成组织切片进行苏木精-伊红(hematoxylin-eosin, HE)染色和免疫组织化学染色,光学显微镜下观察。
1.9 统计数据及分析:实验数据使用统计学软件SPSS 19.0中的独立样本t检验进行计算分析,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 巴马小型猪ALT和AST检测结果(图1):术后第1天ALT和AST的水平均有一定程度地升高,第3天开始回落,在术后第7天之后基本恢复到正常的水平,之后一直维持在正常水平。所有实验动物的肝功指标ALT和AST在术后第1天出现大幅升高的现象,说明实施肝部分切除术可以引起肝功急性损伤。
2.2 移植后人肝癌细胞在巴马小型猪肝脏内嵌合生长情况(图2):组织化学染色显示,在G1、G2组猪肝脏组织中检测到GFP阳性细胞,即为移植到肝实质内的HepG2-GFP细胞。这些GFP阳性的细胞在肝小叶内定植,单个或者2 ~ 5个细胞形成一个细胞团,与周围猪肝细胞嵌合生长。
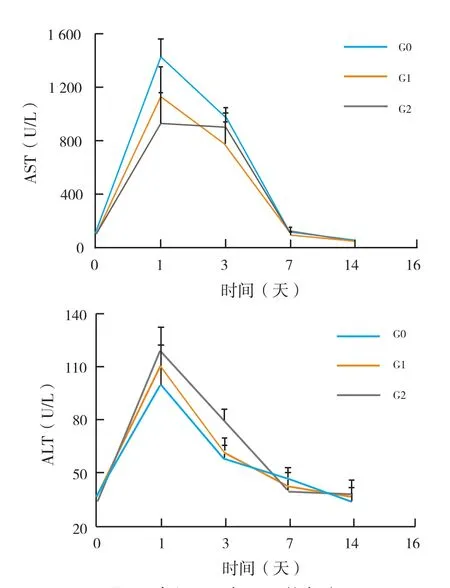
图1 各组AST与ALT的水平
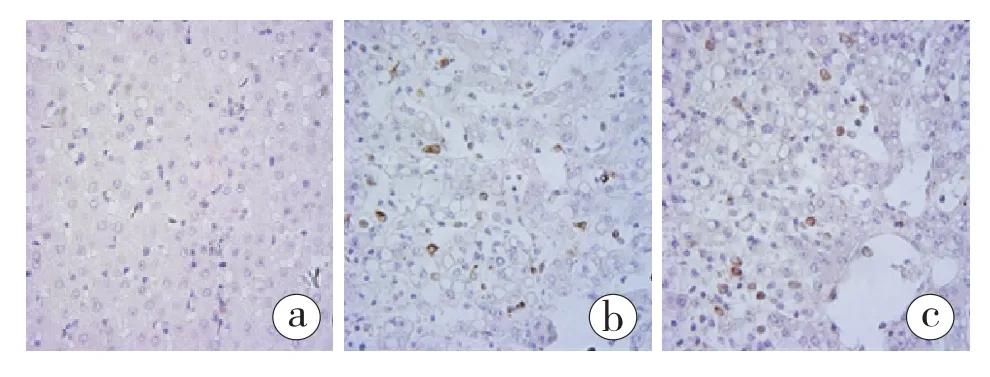
图2 巴马小型猪肝脏组织GFP免疫组化染色(放大倍数200×)
2.3 移植的人肝癌细胞在巴马小型猪肝脏内分泌AFP的水平(图3):移植术后2周检测到G2组实验动物外周血中含有(39.54±20.30)μg/L人AFP蛋白,G1组实验动物外周血中含有(13.77±7.52)μg/L人AFP蛋白。移植术后4周检测到G2组实验动物外周血中减少至(29.21±21.48)μg/L人AFP蛋白,G1组实验动物外周血中含有(4.32±2.62 )μg/L人AFP蛋白。G2组实验动物外周血中人AFP蛋白的含量显著高于G1组(P<0.05)。
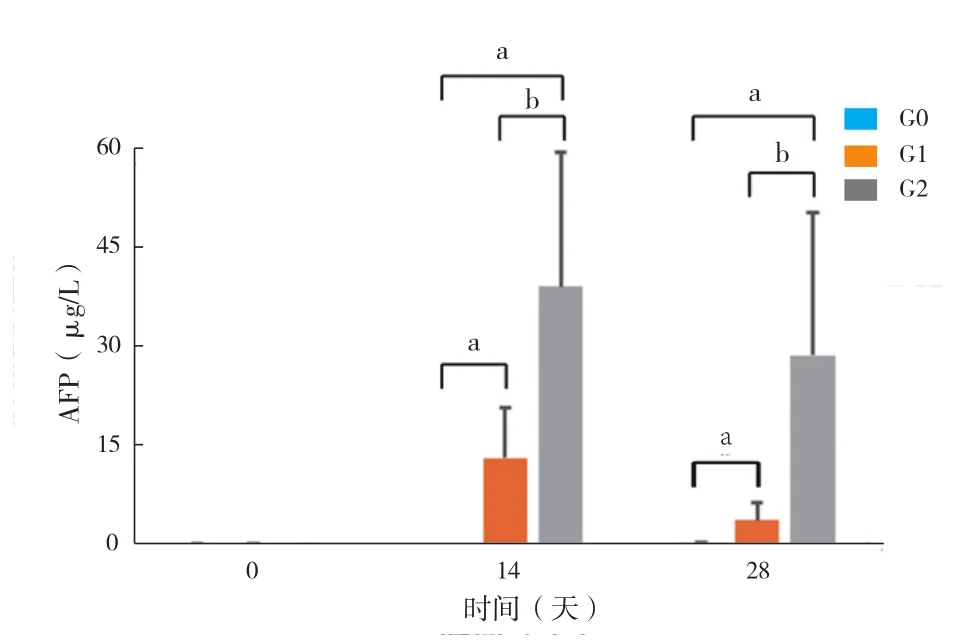
图3 巴马小型猪外周血中人AFP蛋白含量的分析
2.4 移植后巴马小型猪肝脏组织形态(图4):HE染色显示巴马小型猪术前肝脏呈正常组织形态:肝细胞呈不规则或圆形,胞质嗜酸性,细胞核嗜碱性位于细胞中央,肝细胞围绕中央静脉呈条索状分布(图4a)。G0组巴马小型猪术后肝脏呈正常组织形态(图4b)。G2组巴马小型猪术后肝脏组织形态正常,在肝血窦内有少量淋巴细胞(图4c);而G1组巴马小型猪术后肝组织形态发生改变,肝实质内大量淋巴细胞浸润,肝小叶内出现纤维化,部分肝细胞变性坏死(图4d)。
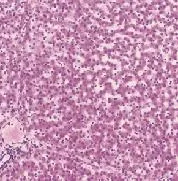
图4 巴马小型猪肝脏组织学检测(放大倍数200×)
3 讨 论
异种移植模型有利于研究肝细胞癌的发展及治疗手段,但与人类相比,啮齿类动物体型偏小,并不适用于外科手术[9]。由于猪的解剖学与生理学特性与人类极为相近,猪的模型被认为是目前最理想的候选模型之一。通过图像引导的微创介入技术可以建立更适合于模拟人体内环境的大动物模型[10]。在本研究中,我们通过移植人肝脏细胞建立了一种大动物的肝细胞癌模型。
本实验采用巴马小型猪肝部分切除术,切除巴马小型猪的肝左叶,在断端附近注射人的肝癌细胞。Zhang等[11]的研究表明巴马小型猪肝部分切除术可以模拟人肝部分切除术建立物理性肝损伤模型。多个研究的结果表明物理性肝损伤能够促进移植的细胞存活、增殖。Paschkis等[12]在肝部分切除的大鼠中建立了异种移植肝癌模型。我们的研究结果也提示:巴马小型猪肝部分切除术可能有利于人肝癌细胞移植物的存活。
先前的研究表明,细胞免疫在异种移植的排斥反应中发挥了重要的作用[13]。免疫抑制剂不仅用于预防同种异体移植排斥反应,也可应用于猪到非人灵长类的异种移植模型中[14]。因此,联合免疫抑制剂可以用来延长异种移植物的存活时间[15]。研究表明,他克莫司引起T细胞调亡,霉酚酸酯通过阻断用于DNA合成所需的鸟嘌呤核苷酸从而抑制T和B淋巴细胞的增殖[16]。在本研究中,血清中AFP含量的下降可能与猪的免疫系统排斥了移植的肿瘤细胞有关,肝组织的组织形态证实了这一推测。在移植G1组中发现部分受体移植后存在严重的炎性细胞浸润。移植后在G2组中几乎未观察到炎性细胞浸润。GFP免疫组化显示,在G2组的肝实质中,HepG2细胞比例显著高于G1组。G2组中的AFP水平显着高于G1组。这些结果表明,联合应用免疫抑制剂可以延长移植的人肝癌细胞在猪肝中存活的时间。
