消融左侧星状神经节对犬急性心肌缺血后缝隙连接蛋白43表达的影响*
2018-09-10刘珊鲁志兵罗达余小梅王晓莹瞿唯一胡慧慧马瑞松江洪
刘珊 鲁志兵 罗达 余小梅 王晓莹 瞿唯一 胡慧慧 马瑞松 江洪
恶性室性心律失常是导致急性心肌梗死(简称心梗)患者猝死的主要原因。基础研究证实交感神经活性增强及副交感神经活性抑制是诱发室性心律失常的重要原因[1-3]。目前普遍认为抑制交感神经活性或增强副交感神经活性可预防心梗后室性心律失常的发生。
缝隙连接蛋白43(Cx43)是心室肌缝隙连接通道的主要蛋白,有助于心肌细胞电化学偶联和机械稳定[4]。Cx43的含量、分布及自身磷酸化状态的改变可影响缝隙连接的电化学偶联,进而诱发心律失常[5]。在器质性心脏病中,改善Cx43的含量及分布可维持心电稳定性,恢复正常心脏功能[6]。已有研究证实低强度迷走神经刺激可通过抑制急性心梗后Cx43的丢失发挥抗心律失常的作用[7]。笔者制造急性心梗模型来探索消融左侧星状神经节(left stellate ganglion,LSG)发挥抗室性心律失常的作用是否与调控Cx43的表达有关。
1 材料与方法
1.1实验动物及分组 健康成年杂种犬18只,体重14~22 kg,均为雄性,由武汉大学人民医院动物中心提供。戊巴比妥钠30 mg/kg前肢静脉麻醉,以后每小时追加2 mg/kg维持麻醉状态。气管插管接动物呼吸机,静脉滴注生理盐水补液。空调控制在25 ℃~30 ℃,整个实验过程中,犬下方放置电热板以维持犬正常体温。持续记录体表心电图(Lead7000,四川锦江电子公司)。
18只成年杂种犬随机分为三组:①假手术组(SO组,n=6):开胸,游离LSG而不予以消融,分离左冠状动脉并穿线,但不结扎;②心梗组(MI组,n=6):制造心梗模型;③消融组(n=6):消融LSG 30 min后再造急性心梗模型。
1.2消融LSG 消融组左侧第2肋间开胸暴露LSG,使用高频电刺激(频率20 Hz,脉宽2 ms,电压15 V)进行LSG功能定位,高频刺激能使血压迅速上升即确认为LSG。消融功率设定为35 W,消融时间不短于1 min,消融过程中持续生理盐水冲洗导管头端。LSG消融成功的标志为同样电压刺激无法使血压上升[8]。其余两组左侧第2肋间开胸游离LSG后,将大头消融电极(3.5 mm)置于LSG表面但不予以射频能量。
1.3心梗模型的建立 各组均经左侧第4肋间开胸,剪开心包,暴露心脏。分离冠状动脉第一对角支之上的左前降支近端,于其下穿入两根3-0丝线,SO组仅穿线不结扎,MI组及消融组采用两部法结扎左前降支建立急性心梗模型。首先于第一道结扎线上放入粗导丝,结扎左前降支后抽出导丝进行缺血预适应20 min,而后将第二道结扎线扎紧。结扎成功的标准:心肌缺血区局部发绀,同步Ⅱ导联ECG显示ST段明显改变(≥0.1 mV抬高或压低),心梗期间出现室性心律失常。
1.4心率变异性的记录 采用LabChart多道生理记录仪(澳大利亚ADInstruments公司)记录消融前及消融30 min内的动态心电图,利用配套的分析软件分析各5 min时段的心率变异性(HRV),以评估心脏自主神经活性的变化。其中高频(HF)反映副交感神经活动的指标,低频(LF)和LF/HF比值反映交感神经活动的指标。
1.5室性心律失常的观察 心电图连续监测犬急性心梗后1 h的室性心律失常事件。SO组分离左前降支并穿线后持续记录1 h心电图。室性早搏(简称室早):提前发生的QRS波群,无P波;QRS波形宽阔畸形,较正常高且时间长;T波与QRS波群主波方向相反。成对室早指2个连续出现的室早,室性心动过速(简称室速)为3个或3个以上连续出现的室早,心室颤动(简称室颤)指心电图上可见心室颤动波,伴动脉血压消失。
1.6总Cx43蛋白及磷酸化Cx43蛋白的检测 应用Western blot分析总Cx43蛋白(T-Cx43)及磷酸化Cx43 (P-Cx43)的表达量,相应的一抗分别为羊Cx43多克隆抗体(AB0016-200,sicgen公司)及兔磷酸化Cx43多克隆抗体(bs-3098R,北京博奥森公司)。检测方法如以前研究所述,以内参GADPH条带光密度值作为标准,计算T-Cx43和P-Cx43蛋白表达的相对量。
1.7Cx43 mRNA表达的检测 安乐死处死动物后,于左前降支结扎处取心肌颜色为苍白与暗红交界处的整层缺血心肌,厚约2 cm。Trizol一步法提取总RNA并用DNA酶处理,按试剂盒说明一步法逆转录为cDNA,再进行聚合酶链反应(PCR)扩增。Cx43 RNA双向引物由武汉金开瑞生物工程有限公司提供。Cx43上游引物:5′-TGT ACG CTT CTG GGT CCT GC-3,;下游引物:5′-CCT TGC CGT GCT CTT CAA TT-3′。用凝胶成像系统扫描分析,以内参GAPDH mRNA条带光密度值作为标准,计算Cx43 mRNA表达的相对量。

2 结果
2.1消融前后HRV的比较 消融前SO组与消融组HF、LF及LF/HF无统计学意义(P均>0.05)。SO组消融前后HF、LF及LF/HF无明显改变(P均>0.05)。与消融前相比,消融组消融后HF显著升高,LF值及LF/HF值显著降低(P均<0.05)。见表1。

表1 消融LSG对HRV的影响
注:与同组消融前比较,*P<0.05
2.2三组室性心律失常事件的比较 三组室性心律失常发生示意图见图1。SO组无室性心律失常事件发生。与SO组相比,MI组室性心律失常发生明显增加。与MI组相比,消融组单发室早、成对室早、室速的次数和室速持续时间明显降低(P均<0.05)。MI组有1只于结扎左前降支后出现室颤,消融组均未发生室颤。见表2。
2.3各组P-Cx43和T-Cx43的表达 与SO组相比,MI组P-Cx43、T-Cx43显著降低(P均<0.05)。与MI组相比,消融组P-Cx43和T-Cx43较MI组明显升高(P均<0.05),但与SO组比较,无明显差异(P均>0.05)。见图2,表3。
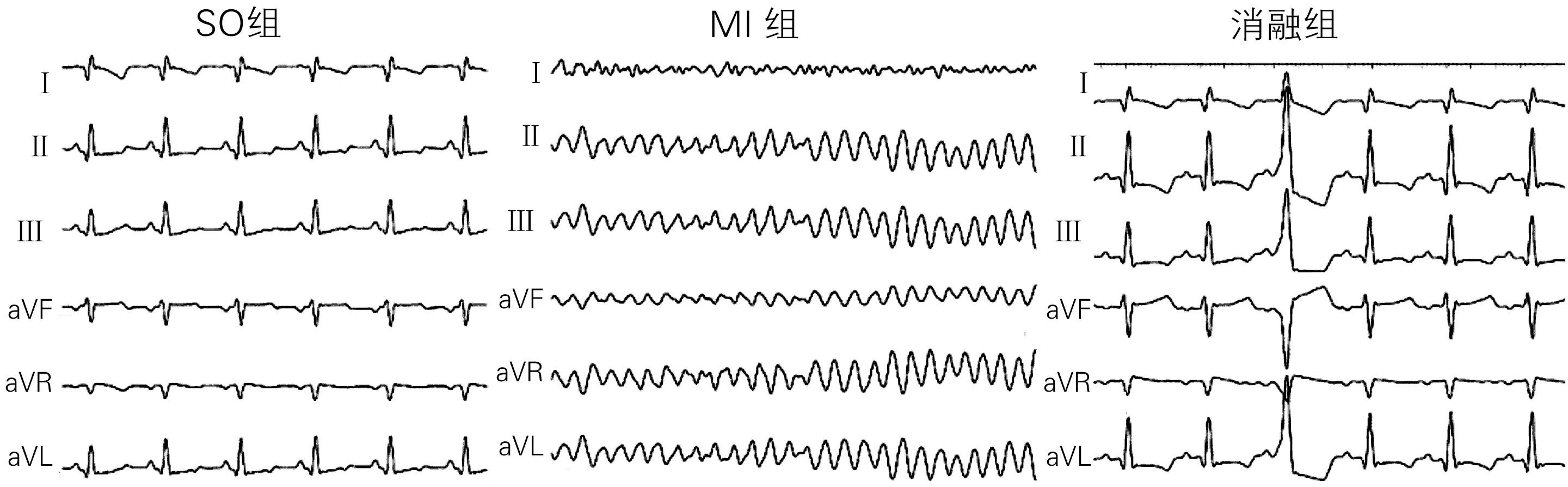
图1 三组典型的心电图表现

组别n单发室早/个成对室早/个室速/次室速持续时间/s室颤/只SO组600000MI组6286(142~476)13(6~16)7(1~12)4.3(3.2~4.9)1(16.67%)消融组613(4~19)*1(0~1)*0(0~2)*0.9(0.7~1.2)*0
注:与MI组比较,*P<0.05
2.4三组Cx43 mRNA的表达 与SO组相比,MI组Cx43 mRNA显著降低(P=0.00);消融组Cx43 mRNA较MI组明显升高(P=0.00),但与SO组相比,无差异(P=0.068),见表3。

图2 三组P-Cx43和T-Cx43的表达
3 讨论
LSG是交感神经支配心脏的重要组成部分,基础研究及临床实验已证实LSG阻滞或消融可有效降低心梗后室性心律失常事件及心脏猝死的发生[9-10]。本实验结果也表明消融LSG可通过降低交感神经活性,增强副交感神经活性,进而抑制急性心梗后室性心律失常的发生,与以往研究结果一致。但消融LSG发挥抗心律失常作用的具体机制尚不明确,可能与降低交感神经活性,改善电生理性质,

表3 三组P-Cx43、T-Cx43及 Cx43 mRNA的表达
注:与SO组比较,*P<0.05;与MI组比较,#P<0.05
改善心电传导等因素有关。
Cx43是哺乳动物心室肌缝隙连接通道含量最丰富的连接蛋白,主要在闰盘以端-端分布为主[11]。生理状态下,大部分心肌细胞的Cx43为P-Cx43。心肌缺血后,细胞代谢和能量产生障碍,闰盘处Cx43发生再分布和快速去磷酸化可减慢传导速度、增加传导的各向异性、发生折返性电活性,最终导致室性心律失常的发生[12-13]。Hu等[14]研究发现刺激交感神经促进室性心律失常的发生,可能与激活β肾上腺素受体进而促进Cx43的降解有关。此外,他们发现刺激迷走神经一方面可通过抑制急性心梗后Cx43的去磷酸化,增加P-Cx43的表达;另一方面可通过改善Cx43的分布,发挥抗室性心律失常的作用[15]。近期Yang等[16]在心梗鼠模型上将Sema3a注入LSG,2周后发现交感神经再生明显减弱,且通过可激活Cx43蛋白激酶引起Cx43发生磷酸化,增加心肌缺血周边区P-Cx43和T-Cx43的表达进而抑制室性心律失常的发生。以上研究表明自主神经参与急性心肌缺血后Cx43的再表达和再分布。笔者的研究发现,消融LSG可抑制心肌缺血后P-Cx43和T-Cx43的表达下降。我们认为消融LSG上调急性心肌缺血后P-Cx43和T-Cx43的表达与交感神经活性降低,副交感神经活性增强有关。消融LSG抑制急性心梗后P-Cx43和T-Cx43的丢失可能机制如下:①只有P-Cx43才参与心电传导。已有研究报道,刺激迷走神经不仅可降低血清去甲肾上腺素的浓度,还可促进乙酰胆碱的释放,后者可上调心肌缺血后P-Cx43的表达[17]。消融LSG可拟迷走神经兴奋作用促进P-Cx43的表达;②在分子层面上,T-Cx43的表达与NO有关。Yao等[18]研究表明NO可通过环磷酸鸟苷相关通路激活蛋白激酶A进而增加T-Cx43的表达。消融LSG可能通过激活NO合成酶,增加NO的释放,从而上调T-Cx43的表达。
综上所述,消融LSG可通过抑制交感神经活性,增强迷走神经活性,进而抑制缺血心肌Cx43的丢失发挥抗心律失常的作用。消融LSG调控Cx43的表达及磷酸化水平确切机制还需进一步探讨。
