3种抑芽剂对马铃薯贮藏效果的影响
2018-09-10葛霞任娜黄铮田世龙
葛霞 任娜 黄铮 田世龙


摘要:以马铃薯品种新大坪为试验材料,研究了氯苯胺灵粉剂、香芹酮粉利和1-萘乙酸甲酯粉剂对马铃薯贮藏效果的影响。综合其抑芽效果、失重率、呼吸强度以及品质的观测结果表明,3种抑芽剂对马铃薯的贮藏效果依次为氯苯胺灵粉剂 > 香芹酮粉剂 > 1-萘乙酸甲酯粉剂。与对照相比,3种抑芽剂处理均可将马铃薯休眠推迟70 d,使马铃薯贮藏150 d不发芽。香芹酮熏蒸粉剂剂量为0.6 mL/kg、1-萘乙酸甲酯粉剂剂量为100 mg/kg时贮藏效果最好,可取代氯苯胺灵粉剂,达到绿色安全的目的。
关键词:马铃薯抑芽剂;氯苯胺灵;香芹酮;萘乙酸甲酯;贮藏效果
中图分类号:S532 文獻标志码:A 文章编号:1001-1463(2018)12-0046-07
马铃薯中含有很高的淀粉含量、蛋白质以及人体所需的维他命和矿物质,是世界上第四大最重要的粮食作物[1 ]。然而在贮藏过程中,马铃薯的呼吸作用和休眠期的打破会导致马铃薯发芽以及薯块营养价值的损失[2 - 3 ]。休眠期的打破使得马铃薯生理老化,从而使商品马铃薯因失重萎缩而失去商品价值,并且对产量也有很大的影响[3 - 5 ]。目前,国内外普遍使用氯苯胺灵[CIPC;异丙基-N(3-氯苯基甲酸酯)]或氯苯胺灵与苯胺灵(ICP;异丙基-N-苯胺基甲酸酯)混合物防止马铃薯的发 芽[6 ],然而使用CIPC和IPC后药剂会残留在马铃薯上,也不适合小规模种植户应用和种薯的抑 芽[7 ]。因此,探索可取代CIPC的其他具有抑芽活性的化合物成为了目前国内外的研究热点。
S-(+)-香芹酮(S-Carvone)是一种天然的、具有挥发性的单萜类化合物,它可从葛缕子草(Carum carvi L.)的种子中提取出来。由于S-Carvone对马铃薯中的3-羟甲基戊二酰辅酶A还原酶(HMGR, E.C. 1.1.1.34)有抑制作用,因此将马铃薯暴露在极低浓度的S-Carvone蒸气下,4 d内就可完全抑制芽的生长,并且这种抑制作用具有可逆性[8 ],因此S-Carvone不仅可以用于商品薯的抑芽,也可作为种薯抑芽剂使用[9 ]。此外,它对马铃薯贮藏期间存在的一些真菌病害还具有抗菌作用,比如硫色镰刀菌(Fusarium sulphureum),疱霉菌(Phoma txigua var. foveata)以及茄病长蠕孢(Helminthosporium solani)等[10 ]。1-萘乙酸甲酯(MENA),也称α-萘乙酸甲酯,俗名抑芽酯,是一种挥发性的液体植物生长调节剂。它是除了CIPC以外目前抑芽效果较好的化合物,最佳的施用方法是将其制成粉剂来使用[11 ],并且施用后在播种前将薯块取出,放在阴暗、空气流通的地方待萘乙酸甲酯挥发殆尽,或用水将其从马铃薯上洗去,因此也可用作种薯抑芽剂使用[12 ]。
我们选用香芹酮和1-萘乙酸甲酯为抑芽剂,通过考察其不同浓度、剂型对马铃薯发芽的抑制效果,从而确定这2种化合物的最佳施用浓度和剂型,同时考察其在贮藏过程中对马铃薯品质的影响。
1 材料和方法
1.1 材料与仪器
指示马铃薯品种为新大坪,采收于定西市,采收后即运往实验室。选取大小均一(80~90 mm)的马铃薯作为试材,按每箱50个装箱(约10 kg),称重装入半透明可密封塑料箱,共计27箱。马铃薯装箱后,敞口在16 ℃、相对湿度80%且避光的条件下放置7 d,伤口愈合后进行相应的抑芽处理。
供试材料S-(+)-香芹酮(纯度96%)和1-萘乙酸甲酯(纯度97%),均购自Alfa Aesar China (Tianjin) Co., Ltd.,其中香芹酮粉剂(粉剂浓度0.12 mL/g)为6 mL S-香芹酮与50 g的凹凸棒(200目)在塑料容器中充分混合均匀;1-萘乙酸甲酯粉剂为2 g萘乙酸甲酯与98 g凹凸棒在塑料容器中充分混合均匀。CIPC粉剂(纯度99%,自制),CIPC施用的有效剂量为20 mg/kg马铃薯。
测试仪器包括数显游标卡尺、气相色谱仪、岛津RF-540型荧光分光光度计、WZZ-2S数字式自动旋光仪、瑞典Tecator 1030型全自动定氮仪、电子天平、电子称、温湿度计。
1.2 试验方法
试验共设9个处理(表 1),每处理3个平行,共27组。在包装箱上用记号笔编号,如1-1、1-2、1-3 …,表示每个处理的每个平行。贮藏库贮藏温度10 ℃,相对湿度80%~90%,每处理分开放置。为了让马铃薯块茎的呼吸有充足的氧气交换,每2 d打开箱盖10 min。
1.4.4 数据处理 用Excel进行数据分析,用Orign 7.0进行谱图处理。
2 结果与分析
2.1 平均芽长
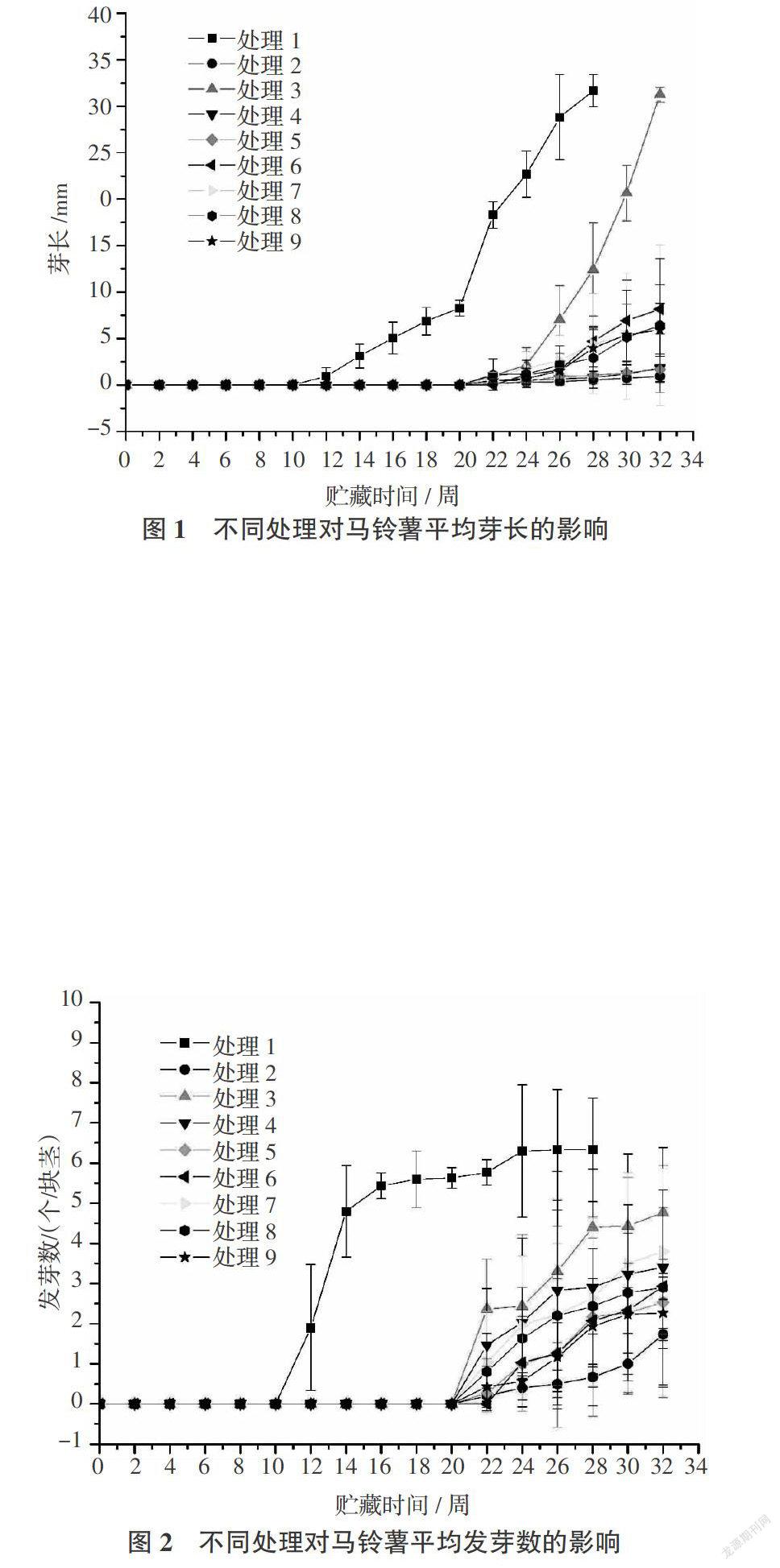
从图1可以看出,处理1(对照)在贮藏第10周开始发芽,并在28周因发芽较多失去商品价值而未继续统计,其余处理均于第20周开始发芽。其中,贮藏32周时处理2(CIPC)抑制马铃薯芽长的效果最好,平均芽长为0.940 mm;其次是处理5、处理4、处理9、处理8、处理7、处理6,分别为1.673、1.833、5.930、6.411、6.409、8.151 mm。抑制芽长效果较好,而处理3平均芽长为31.253 mm,与28周时对照平均芽长(31.672 mm)相当。可以看出芽长与抑芽剂处理浓度成反比,浓度越高平均芽长越短。此外发现,除处理3外(可能浓度不够),抑制芽长的效果为CIPC粉剂 > 香芹酮熏蒸 > 萘乙酸甲酯粉剂 > 香芹酮粉剂。
2.2 单薯发芽数
处理1(对照)从第10周开始发芽(图2),其余处理在第20周开始发芽。对照在贮藏末期(28周)时的单薯平均发芽数为6.3个。贮藏第32周时,处理2(CIPC)的单薯平均发芽数最低,为1.7个,其他处理从少到多依次为处理9、处理5、处理8、处理6、处理4、处理7、处理3,分别为2.3、2.5、2.9、2.9、3.4、3.8、4.8个。抑芽剂处理浓度越高,单薯平均发芽数越少。
2.3 发芽指数
从图3可以看出,对照在第10周开始发芽,在第20周时发芽指数达到100%,其他抑芽剂处理均在贮藏第20周开始发芽,处理3可能因药剂浓度不够而致发芽指数一直处于最高,而处理2(CIPC)发芽指数最低。在贮藏末期,抑芽剂处理的发芽指数从低到高依次为处理2、处理5、处理4、处理9、处理8、处理7、处理6、处理3,分别为8.33%、16.67%、19.17%、32.50%、38.33%、42.50%、46.67%和95.83%。抑芽剂效果为CIPC > 香芹酮熏蒸 > 萘乙酸甲酯粉剂 > 香芹酮粉剂。
2.4 发芽率
马铃薯芽长大于等于1 mm时即判定为发芽。从图4可以看出,对照在贮藏第10周就开始发芽,贮藏第16周时发芽率达100%,而抑芽剂处理的发芽时间推迟到第20周。到贮藏末期,处理2(CIPC)的发芽率仍最低,为33.33%,其他处理的发芽率从低到高依次为处理5、处理9、处理4、处理6、处理8、处理7、处理3,分别为50.00%、56.67%、63.33%、63.33%、66.67%、76.67%和96.67%。
2.5 失重率
從图5可以看出,块茎失重率随着贮藏期的延长而增大,其中对照在第10周后因开始发芽而失重率显著增加,并在贮藏末期(28周)失重率达7.47%。经抑芽剂处理后,处理3、处理6、处理8、处理7和处理9的块茎也在20周发芽后失重率增加显著,而处理2、处理5和处理4的失重率随着贮藏期的延长一直稳步增加。抑芽剂处理在贮藏末期(32周)时的失重率从低到高依次为处理2、处理5、处理4、处理3、处理6、处理8、处理7、处理9,分别为3.85%、3.95%、4.34%、5.11%、5.12%、6.07%、7.09%和7.33%。在贮藏过程中,马铃薯重量损失的主要原因为水分散发、呼吸以及其他生理代谢进程,除此之外还因发芽的增多而增加[2 - 5,19 ]。从供试的抑芽剂来看,抑制失重的效果为CIPC > 香芹酮 > 萘乙酸甲酯,这是因为香芹酮除了抑芽作用外对一些真菌病害还具有抗菌作用,可减少贮藏过程中因腐烂而造成的失水损失,因此对失重率的抑制作用较好。
2.6 呼吸强度
呼吸强度是植物新陈代谢强弱的重要指标。马铃薯在采收后运输中被擦伤或割伤时呼气强度将增加,随后必须伤口愈合过程来降低薯块的呼吸强度[20 - 21 ]。从图6可以看出,由于搬运、挑拣使得马铃薯呼吸强度较高,伤口愈合完毕后呼吸强度也会很快降低。4周以后随着贮藏期的延长呼吸强度变化较为稳定,并且由于抑芽剂的抑芽作用使马铃薯呼吸强度均低于对照(处理1),对照在完全发芽以后呼吸强度也逐步达到一个小峰值 [22周,0.79 mg/(kg·h)]。抑芽剂处理贮藏末期(32周)的呼吸强度由高到低依次为处理3、处理7、处理4、处理9、处理6、处理8、处理5、处理2,分别为0.61、0.52、0.48、0.44、0.41、0.32、0.26、0.22 mg/(kg·h),均低于贮藏28周时对照的呼吸强度。
2.7 品质
有关在贮藏过程中施用抑芽剂是否影响马铃薯品质的研究较少,我们的研究发现,与对照相比,施用抑芽剂对马铃薯干物质、粗淀粉、还原糖含量的影响不明显(图7 a-c)。这些含量的变化主要与马铃薯的品种、区域性、贮藏温度等有 关[22 - 23 ]。马铃薯中的Vc较丰富,在新鲜的块茎中占0.02%左右,但在贮藏期间Vc易被氧化酶氧化分解而失去生理活性,其含量随着贮藏时间显著降低[24 - 25 ]。从图7 d中可以看出这种变化趋势,并且发现抑芽剂的施用可显著减缓Vc含量的降低,而与抑芽剂的种类无显著关系。从图7 e可以看出,各处理马铃薯蛋白含量的变化基本在20~30 g/kg之间,说明马铃薯蛋白质的含量在贮藏期间变化不大,因此蛋白质含量是个相对稳定的指 标[26 - 28 ],贮藏后期经抑芽剂处理的马铃薯蛋白含量略高于对照。
3 小结与讨论
试验研究了氯苯胺灵、香芹酮和1-萘乙酸甲酯对马铃薯贮藏效果的影响。综合抑芽效果、失重率、呼吸强度以及品质的观测结果表明,3种抑芽剂对马铃薯贮藏效果依次为氯苯胺灵 > 香芹酮 > 1-萘乙酸甲酯。尽管香芹酮与1-萘乙酸甲酯抑芽效果不及氯苯胺灵,但与对照相比,香芹酮、1-萘乙酸甲酯与氯苯胺灵一样,均将开始发芽时间由第10周推迟到了第20周,即将马铃薯的休眠期延长了约70 d,可使马铃薯150 d不发芽,达到了很好的贮藏效果。
对香芹酮和1-萘乙酸甲酯考察了3个浓度梯度的使用剂量,结果发现抑芽效果随着剂量的增加而增强。对香芹酮来说,香芹酮熏蒸有效剂量为0.4 mL/kg处理的抑芽效果较差;香芹酮熏蒸有效剂量为0.6、0.8 mL/kg时,虽然以有效剂量为0.8 mL/kg的抑芽效果较好,但考虑到香芹酮使用的成本问题,推荐有效剂量为0.6 mL/kg为最佳使用剂量。对于1-萘乙酸甲酯,尽管随着处理剂量增加,抑芽效果增强,但由于粉剂施用过多可能对马铃薯皮孔有阻塞作用,易造成马铃薯腐烂,故1-萘乙酸甲酯粉剂剂量为 130 mg/kg时失重和呼吸强度较高,所以推荐1-萘乙酸甲酯粉剂最佳剂量为100 mg/kg。
香芹酮采用熏蒸劑型比其采用粉剂剂型对马铃薯贮藏效果好。这是因为:第一,香芹酮为易挥发性液体,熏蒸可直接使用,而粉剂增加制备成本且耗费人力,且施用时粉剂的小颗粒对人体有危害;第二,相同香芹酮的有效浓度制成粉剂后,由于凹凸棒的吸附作用虽然对香芹酮具有缓释作用,但凹凸棒也可吸收一部分香芹酮,使其达不到预期的有效浓度,使抑芽效果低于同剂量直接熏蒸的效果;第三,由于香芹酮施用时有效剂量较高,制成粉剂时为了充分分散好香芹酮液体,凹凸棒的用量较大,过多的粉剂颗粒会阻塞马铃薯对香芹酮气体的吸收,也会阻碍马铃薯表皮的气体交换,易使马铃薯发生腐烂。
综上,尽管香芹酮和1-萘乙酸甲酯的抑芽效果不如氯苯胺灵,但也可使马铃薯的休眠期延长至150 d,可取代氯苯胺灵作为马铃薯抑芽剂,并且与氯苯胺灵抑芽的不可逆性相比,也可作为种薯抑芽剂使用。本研究的推荐抑芽剂最佳使用剂量为香芹酮0.6 mL/kg、1-萘乙酸甲酯100 mg/kg。
参考文献:
[1] COSTA E,SILVA M,GALHANO C,et al. A new sprout inhibitor of potato tuber based on carvone/β-cyclodextrin inclusion compound[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry,2007. 57(1):121-124.
[2] BURTON W G. The Potato. A survey of its history and of factors influencing its yield,nutritive value,quality and storage[D]. Holland:Wageningen University,1966,
382.
[3] SUHAG M,B K NEHRA,N SINGH,et al. Storage behavior of potato under ambient condition affected by curing and crop duration[J]. Haryana J. Hort. Sci., 2006,35:357-360.
[4] YOSUKE M,K F YAPTENCO,N TOMOHIRO,et al. Property changes in potato tubers (Solanum tuberosum L.) during cold storage at 0 ℃ and 10 ℃[J]. Food Pre. Sci.,2000,26:153-160.
[5] KATUNDU M G C,S L HENDRIKS,J P BOWER,et al. Effects of traditional storage practices of small-scale organic farmers on potato quality[J]. J. Sci. Food Agric.,2007,87:1820-1825.
[6] KERSHOLT R P V,C M REE,H C Moll. Environmental life cycle analysis of potato sprouth inhibitors[J]. Industrial Crops and Products, 1997,6:187-194.
[7] SANLI A,KARADOGAN T,TONGU M,et al. Effects of caraway(Carum carvi L.) seed on sprouting of potato (Solanum tuberosum L.) tubers under different temperature conditions[J]. Turkish Journal of Field Crops, 2010,15(1):54-58.
[8] OOSTERHAVEN K, HARTMANS K J,HUIZING H J. Inhibition of potato(Solanum tuberosum)sprout growth by the monoterpene S-carvone: reduction of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity without effect on its mRNA level[J]. J. Plant Physiol., 1993, 141:463-469.
[9] OOSTERHAVEN J. Different aspects of S-Carvone,a natural potato sprout inhibitor[D]. Holland:Wageningen University,1995.
[10] HARTMANS KJ,P DIEPENHORST,W BAKKER et al. The use of carvone in agriculture: sprout suppression of potatoes and antifungal activity against potato tuber and other plant diseases[J]. Industrial Crops and Products,1995,4:3-13.
[11] MARSHALL E R, SMITH O. Effect of field and storage applications of sprout inhibitors on potato tubers [J]. American Potato Journal,1950,27:133-141.
[12] DENNY F E. The use of methyl ester of alpha naphthaleneacetic acid for inhibiting sprouting of potato tubers,and an estimate of the amount of chemical retained by tubers[J]. Contrib. Boyce. Thompson. Inst.,1942,12:387-403.
[13] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[14] 中华人民共和国商业部食品检验研究所. GB/T 8858-1988水果、蔬菜产品中干物质和水分含量的测定方法[S]. 北京:中国标准出版社,1988.
[15] 中华人民共和国商业部食品检验研究所. GNJ/JZX 080-2004水果、蔬菜产品中粗淀粉的测定方法[S]. 北京:中国标准出版社,2004.
[16] 中华人民共和国商业部食品检验研究所. GNJ/JZX 086-2004水果、蔬菜产品中还原糖的测定方法[S]. 北京:中国标准出版社,2004.
[17] 中华人民共和国商业部食品检验研究所. GB/T 5009.86-2003蔬菜、水果及其制品中总抗坏血酸的测定[S]. 北京:中国标准出版社,2003.
[18] 中华人民共和国卫生部. GB 5009.5-2010 食品安全国家标准 食品中蛋白质的测定[S]. 北京:中国标准出版社,2010.
[19] WONG YEN CHEONG,J K C,N GOVINDEN. Quality of potato during storage at three temperatures[J]. Food and Agricultural Research Council,Mauritius, 1998,175-179.
[20] MEINL G. Studies on the respiration intensity of potato tubers as an indicator of damage caused by different methods of harvesting and handling[J]. Archivfur Acker-und Pflanzenbau und Bodenkunde,1972,16, 21-30.
[21] BURTON W G. The potato,3rd edn.[M]. London:Longman Scientific and Technical,1989.
[22] MAAG REUST W. Storage and reconditioning of crisp potatoes[J]. Kartoffelbau,1992,43:443-448.
[23] CLASSEN P A M,BUDDE,CALKER M H. Increase in phos-phorylase activity during coldinduced sugar accumulation in potato tubers[J]. Potato Research,1993,
36:205-217.
[24] 趙 萍. 马铃薯块茎中 Vc 含量变化[J]. 马铃薯杂志,1997,7(1):26.
[25] DALE M F,GRIFITHS D W,TODD D T. Effects of genotype,nvironment, and postharvest storage on the total ascorbate content of potato(Solanum tuberosum)tubers[J]. Agric. Food Chem.,2003,51(1):241-248.
[26] 巩慧玲,赵 萍,杨俊峰. 马铃薯块茎贮藏期间蛋白质和维生素C含量的变化[J]. 西北农业学报,2004,13(1):49-51.
[27] 李 梅,田世龙,程建新,等. 田二氧化氯对贮藏马铃薯块茎的抑芽作用初探[J]. 甘肃农业科技,2017(2):33-36.
[28] 田世龙,李守强,李玉梅,等. 马铃薯抑芽剂基料的筛选初报[J]. 甘肃农业科技, 2008(9):13-15.
(本文责编:杨 杰)
