高效液相色谱法与酶联免疫法检测小麦中呕吐毒素含量的比较研究
2018-09-10高艳陶维春王睿沈跃丽
高艳 陶维春 王睿 沈跃丽
摘 要:高效液相色谱法、酶联免疫法是常见的呕吐毒素检测方法,以小麦为样品,依次利用高效液相色谱法、酶联免疫法等对小麦呕吐毒素进行了分析。对两者呕吐毒素检测结果进行了对比分析,最终结果表明:高效液相色谱法、酶联免疫法在小麦呕吐毒素检测环节,在250~1 450 μg/kg之间存在相关性,且高效液相色谱法测定的小麦呕吐毒素含量小于酶联免疫法测定的结果。
关键词:高效液相色谱法;酶联免疫法;小麦;呕吐毒素;含量
呕吐毒素又称为脱氧雪腐镰刀菌烯醇,其为镰刀菌产生的单端孢霉毒素。依据粮食卫生标准的相关规定,小麦呕吐毒素限量标准为1 000.0 μg/kg。呕吐毒素对于粮食谷物的污染状况与产毒菌株、温度、湿度、通风、日照等因素有关。而现阶段我国部分地区小麦呕吐毒素含量出现严重超标现象,特别是在多雨的年份,因此强化呕吐毒素检测管理非常重要。现阶段在小麦呕吐毒素检测过程中,高效液相色谱及酶联免疫为常用的方法,通过对两者检测结果的相关性分析,可有效判断小麦呕吐毒素的有效检测[1~3]。
1 高效液相色谱法材料及方法
1.1 试剂、材料
甲醇(色谱纯)、聚乙二醇、脱氧雪腐镰刀菌烯醇标准品、脱氧雪腐镰刀菌烯醇免疫亲和柱、玻璃纤维滤纸(直径11 cm、孔径1.5 μm)。
1.2 主要仪器
色谱仪(配有紫外检测器)、天平(感量0.001 g)、高速万能粉碎机、空气压力泵、试验筛(1 mm孔径)、均质器(转速大于10 000 rpm/min)、注射器(10 mL)。
1.3 方法
1.3.1 标准溶液的配制
将脱氧雪腐镰刀菌烯醇(DON)标准溶液100 μg/mL用甲醇水(20∶80)分别稀释成0.1 μg/mL、0.2 μg/mL、0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、5.0 μg/mL标准工作液。
1.3.2 样品前处理
(1)将样品研磨,硬质的粮食用高速万能粉碎机磨细并通过试验筛(1.2 mm孔径),不要磨成粉末,称取25 g(精确到0.01 g)磨碎的试样于100 mL容量瓶中加入5 g聚乙二醇,用水定容至刻度,混匀,转移至均质杯中,高速搅拌2 min。定量滤纸过滤后以玻璃纤维过滤至滤液澄清,收集滤液于干净的容器中。
(2)净化。将2 mL滤液以1滴/2 s的速度缓慢通过免疫亲和柱;用20 mL水冲洗柱子,流速1滴/s,弃去流出液,加入1.0 mL甲醇(色谱级)洗脱,流速自然重力,直至2~3 mL空气通过柱体,收集全部洗脱液。
(3)高效液相色谱参考条件。色谱柱:C18柱,5 μm,150 mm×4.6 mm;流动相:甲醇+水(20+80);流速:0.8 mL/min;柱温:35 ℃;进样量:50 μL;检测波长:218 nm。
根据整体样品峰保留时间进行定性分析,随后依据相应峰面积利用外标法进行定量评估。
2 酶联免疫法材料及方法
酶联免疫法在实际应用中主要是利用酶联免疫盒进行间接酶联免疫检测。
2.1 材料、试剂
呕吐毒素检测试剂盒、去离子水。
2.2 主要儀器
酶标仪:450 nm;恒温培养箱:37 ℃;天平:感量0.001 g;粉碎机;离心机;微量移液器。
2.3 方法
2.3.1 样品前处理
将5 g粉碎好的样品加入25 mL去离子水,离心机5 000 rpm离心5 min,取上清液500 μL备用。
2.3.2 试剂盒检测
本试验使用苏微牌DON检测试剂盒。
取出试剂盒中所有试剂和微孔板回温(20~25 ℃)30 min以上;将标准品孔、样品孔进行编号,以便记录位置;每孔加入250 μL洗涤液,放置40 s,甩掉拍干,重复一次;将标准溶液、样品液各50 μL加入标记孔中,分别加入酶标物50 μL/孔、抗试剂50 μL/孔,培养箱37 ℃反应30 min;甩掉反应液,用洗涤液250 μL/孔充分洗涤5次,每次间隔30 s,拍干;依次分别加入底物液50 μL/孔、显色液50 μL/孔,培养箱37 ℃反应15 min;之后加入终止液50 μL/孔,酶标仪450 nm,读取每孔的吸光度OD值。
3 结果及讨论
3.1 结果
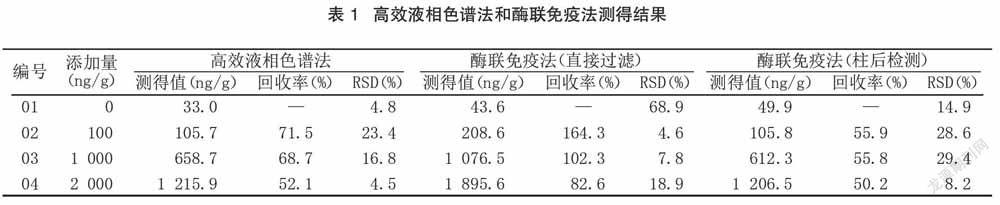
经过小麦样品加标回收试验后,重复反应3次,并在样品提取后分别使用高效液相色谱法、酶联免疫法进行小麦提取物呕吐毒素的检测。其中高效液相色谱法在样品处理前期需经过免疫亲和柱,而酶联免疫法可直接反应。在本次反应过程中,将高效液相色谱法过柱后的样品又进行了酶联免疫试验,最终所得结果见表1。
3.2 分析
通过表1数据可得出,使用高效液相色谱法、酶联免疫法分别对小麦提取物进行检测,所测得的小麦呕吐毒素含量高效液相色谱法小于酶联免疫法,且当呕吐毒素含量大于100 μg/g时,两者之间的测量平均差值在425 ng/g以上,而在呕吐毒素含量在100 ng/g以下时,两者测量数值差值在105 ng/g以下。使用高效液相色谱法对于呕吐毒素的检测限度为100 ng/g。通过对整体测量数值的综合评估,可得出两者偏差影响因素。首先在高效液相色谱法的甲醇洗脱过程主要采用固相萃取的措施,而在实际洗脱过程中由于洗脱时间及洗脱频率没有得到有效控制,从而导致整体检出率偏低;其次在酶联免疫检测过程中样品稀释倍数与高效液相色谱法稀释倍数存在差异性,从而导致整体酶联免疫检测结果出现假阳性反应;再加上经过免疫亲和柱后样品可由免疫亲和柱吸收一部分,从而导致免疫亲和柱过滤后的样品酶联免疫法所得结果与高效液相色谱法最终差异不大。而且随着样品添加量的增加,其两者的重复性呈现良好的态势,这种情况表明酶联免疫法试剂盒检测结果具有一定稳定性。
通过直接过滤酶联免疫法检测结果分析,可得出在添加物浓度在100 ng/g时整体回收率为164.3%,而随着添加物浓度的增加,酶联免疫法检测结果回收率出现下降趋势。这种情况主要是由于添加物浓度过低会导致内在样品杂质干扰程度增加,从而出现假阳性反应。而直接过滤酶联免疫检测法与经过免疫亲和柱之后的酶联免疫反应回收率存在差异,则主要是由于样品提取液流经免疫亲和柱的浓度损失。这就导致在实际检测过程中,利用免疫亲和柱高效液相色谱法进行小麦呕吐毒素测定时,具有亲和柱洗脱样品不完全的风险,再加上高效液相色谱法在实际应用中需要对小麦样品液进行过柱、淋洗、定容等措施,整体检测时效不高,且耗费成本较大,因此其在实际应用中常用于在酶联免疫法出现假阳性反应之后的确认工作。
4 总结
总而言之,酶联免疫法在实际检测过程中主要以抗原抗体特异性反应为依据,具有良好的检测灵敏度及特异性。而且相较于高效液相色谱法而言,酶联免疫法并不需要进行样品前处理及免疫亲和柱过柱等过程,从而有效地提高了样品检测效率。而高效液相色谱法主要是利用样品纯化,依据免疫亲和柱过程中抗原与特异性抗体的结果理论,可以有效避免样品检测假阳性反应,具有检测结果准确度较高的优良特点。在实际应用中可根据具体检测需要,选择适宜的检测方法。
参考文献:
[ 1 ] 张羽,唐亚芳,王烨旻.免疫亲和柱净化高效液相色谱法与酶联免疫吸附法测定小麦中脱氧雪腐镰刀菌烯醇[J].粮食与油脂,2016,29(06):78-81.
[ 2 ] 庄芸蕾.胶体金免疫快速检测卡与酶联免疫法检测小麦中呕吐毒素的技术比较[J].粮食储藏,2017,46(03):38-41.
[ 3 ] 陆源,王韦岗,马晓凤,等.小麦粉中呕吐毒素测定方法优化研究[J].广州化工,2017,45(06):115-116.
