单核细胞增生李斯特氏菌实时荧光RPA检测方法的建立及应用
2018-09-08王金凤刘立兵耿云云石蕊寒孙晓霞南汇珠姜彦芬王建昌
王金凤,刘立兵,耿云云,石蕊寒,孙晓霞,南汇珠,姜彦芬,王建昌
(1.河北出入境检验检疫局检验检疫技术中心,河北石家庄 050000)(2.河北省检验检疫科学技术研究院,河北石家庄 050051)(3.河北师范大学生命科学学院,河北石家庄 050024)
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM),在2000年WHO食品安全工作计划中,被列为重点检测的食源性致病菌之一[1]。蔬菜、乳制品和肉类等食品都已被证实是单增李斯特菌的传播载体[2]。近几年食品污染物调查结果显示,单增李斯特菌在生肉及即食食品中污染率较高[3],我国散装熟肉制品也具有引起单增李斯特菌病的风险[4]。LM可诱发食物中毒,导致李斯特菌病,主要引起人类脑膜脑炎和菌血症[5,6],发病率虽低,病死率高达12.8%~17%[7]。据估计,在欧洲每年可引起400人死亡[8]。在美国,李斯特菌病在食源性疾病引起的死亡中占第3位,每年约1600人感染李斯特菌病并有260人因此死亡[9]。因此,单增李斯特菌对人类健康的危害使得对食品中该菌的检测具有重要意义。
目前对食品中LM的检测方法主要是传统培养方法和分子生物学方法。我国目前对LM传统培养方法多采用 GB 4789.30-2016[10],该方法至少需要 4~5 d(若为阳性,则需要7 d)完成对样品中LM的检测,操作繁琐复杂,并且对检测人员技术要求较高。目前分子生物学技术在食源性致病菌的检测中已经得到了广泛应用[11]。刘万静等[12]应用LMReal-time PCR 方法成功的从134例风险监测样本中检测出8例LM阳性;黄朱梁等[13]建立了实时浊度 LAMP方法检测食品中LM,并从160份不同种类的食品中检出5份阳性样本。Real-time PCR方法需要60 min左右,且均需要昂贵的仪器设备,专业的技术人员,以及良好的实验室环境;实时浊度LAMP方法反应时间也为60 min,无法实现对LM的快速检测。上述方法对于口岸现场及食品突发事件中对LM的现场快速检测,具有一定的局限性。
重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)是一种新的核酸等温扩增技术,是一种依赖结合单链核酸(寡核苷酸引物)的重组酶、单链DNA结合蛋白(SSB)和链置换DNA聚合酶三种核心酶,对核酸进行特异、灵敏、等温、快速扩增,对试验设备、人员和资源的要求较低。目前RPA技术已广泛应用于转基因大豆[14],病毒[15,16]、细菌[17,18]和寄生虫[19]等多种病原的快速检测,但未见RPA方法用于LM检测的报道。
鉴于此,本研究基于LM特异性基因hlyA的保守区域,设计特异性RPA引物和exo探针,建立了快速检测LM的实时荧光RPA方法,并进行该方法的特异性、灵敏性、人工污染样品验证试验,为实现LM的现场快速检测提供技术参考。
1 材料和方法
1.1 材料
1.1.1 实验菌株
本实验所用菌株见表1。

表1 本研究所用菌株Table 1 Strains in this study

注:+,阳性结果;-,阴性结果。
1.1.2 主要试剂
TwistAmpTMexo kit,购自英国TwistDx公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;LB增菌液,单核细胞增生李斯特氏菌选择性平板,均购自北京陆桥技术股份有限公司;Premix Ex Taq,购自 TAKARA 公司。
1.1.3 主要设备
NanoDrop 2000c核酸蛋白分析仪,美国Thermo公司;ABI 7500实时荧光定量PCR仪,美国ABI公司;GenieⅢ等温扩增荧光检测系统,英国OptiGeneLimited公司。
1.2 方法
1.2.1 探针和引物设计
参考Genbank中LMhlyA基因序列(HM58959),根据保守区域设计合成特异性的 real-time RPA和real-time PCR引物探针,扩增片段分别为158 bp和95 bp。
所有引物和探针均由生工生物工程(上海)股份有限公司合成(见表2)。

表2 引物和探针序列Table 2 Primer and probe sequences
1.2.2LMreal-time RPA 反应体系和条件
使用 TwistAmpexokit配制 50 μL RPA 反应体系,其中包括LM-RPA-F/R(10 μM)各 2.1 μL,LM-RPA-P(10 μM)0.6 μL,Rehydration Buffer 29.5 μL,ddH2O 12.2 μL,模板 1 μL,280 mM MgAc 2.5 μL。实验操作为:将除去模板和MgAc的所有试剂预混后转入含有冻干酶制剂的0.2 mL反应管中,充分混匀;取1 μL模板加入反应管中;取2.5 μL MgAc加在反应管盖中,盖紧后瞬时离心并涡旋;置于等温扩增荧光检测系统中,设置反应条件 37 ℃ 20 min。
1.2.3LMreal-time PCR 反应体系和条件
根据本实验室已优化好的反应条件,配制25 μL real-time PCR反应体系,包括Premix Ex Taq(包含PCR buffer、DNA聚合酶和dNTPs等),LM-PCR-F/R(10 μM)各 1.5 μL,LM-PCR-P(5 μM)0.8 μL,DNA 模板 1 μL,ddH2O 7.7 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s(收集荧光),35 个循环。
1.2.4LMreal-time RPA 特异性和灵敏性试验
提取表1中LM和其它菌株DNA,进行RPA方法特异性验证试验。将LM过夜纯培养,取1 mL菌液使用细菌基因组提取试剂盒提取 DNA,并测定DNA浓度。使用灭菌水进行10倍梯度稀释,使其浓度在 5.0×104~5.0×10-3pg/μL 范围,分别取 1 μL 各稀释浓度DNA作为模板进行RPA方法灵敏性试验,确定该方法的最低检测限。同时与real-time PCR方法进行灵敏性比较。
1.2.5LMreal-time RPA 重复性实验
将LM纯培养物按10倍梯度稀释,随机取3个稀释度的样本分别作5个重复,用real-time RPA方法进行批内和批间的扩增检测,同时计算 Ct值的变异系数,评价实验结果的重复性。
1.2.6 人工污染样品的检测
将LM经过夜纯培养后,用生理盐水进行10倍列稀释,选取10-6、10-7稀释度菌液作平板计数,计算纯培养物的初浓度。经稀释后,选取0~5、20~30、50~100 CFU范围内的菌量分别添加到25 g羊肉、生菜样品(预先已经GB 4789.30-2016检测为LM阴性,并经GB 4789.2-2016和GB 4789.3-2016检测样品中细菌总数和大肠菌群)中,再添加225 mL的LB增菌液,同时做空白对照,30 ℃培养。选取1 mL前增菌时间分别为14 h和20 h的培养液,使用试剂盒进行LM基因组DNA提取,加50 μL ddH2O进行溶解,并取1 μL进行real-time RPA检测。同时与real-time PCR、GB 4789.30-2016方法进行平行验证,比较三种方法的检测结果。同时使用GB 4789.30-2016方法测定人工污染样品经不同时间前增菌后的LM数量。
2 结果与讨论
2.1LMreal-time RPA 方法的特异性结果

图1 LM real-time RPA特异性结果Fig.1 Specific results of real-time RPA for LM
应用所建立的LMreal-time RPA方法对表1中标准菌株和分离菌的基因组DNA进行特异性扩增,结果在20 min内,仅有LM出现特征性荧光扩增曲线,其余菌株均无扩增曲线。具体结果见表1。图1为部分菌株特异性检测结果。上述结果说明本方法具有良好的特异性。
2.2LMreal-time RPA 方法的灵敏性结果
经NanoDrop 2000c核酸蛋白分析仪测定,所提取的细菌基因组 DNA 浓度为 5×104pg/μL。经 10 倍列梯度稀释至浓度 5×10-3pg/μL,以此作为模板进行LMreal-time RPA和real-time PCR灵敏性检测,结果如图 2所示。当 DNA 浓度为 5×104~5×10-1pg时,real-time RPA均出现明显的扩增曲线,且 TT值在2:30~7:12 之间,说明所建立方法的检出限为 5×10-1pg(图2a)。同real-time PCR结果相比,两种方法的灵敏性一致,均可检测到5×10-1pg(图2b)。就检测时间而言,real-time RPA仅需要2:30~7:12就可实现对5×104~5×10-1pg 基因组DNA 的检测,而real-time PCR则需要约 25~55 min(Ct值在 15.32~31.70 之间)。具体结果见表3。
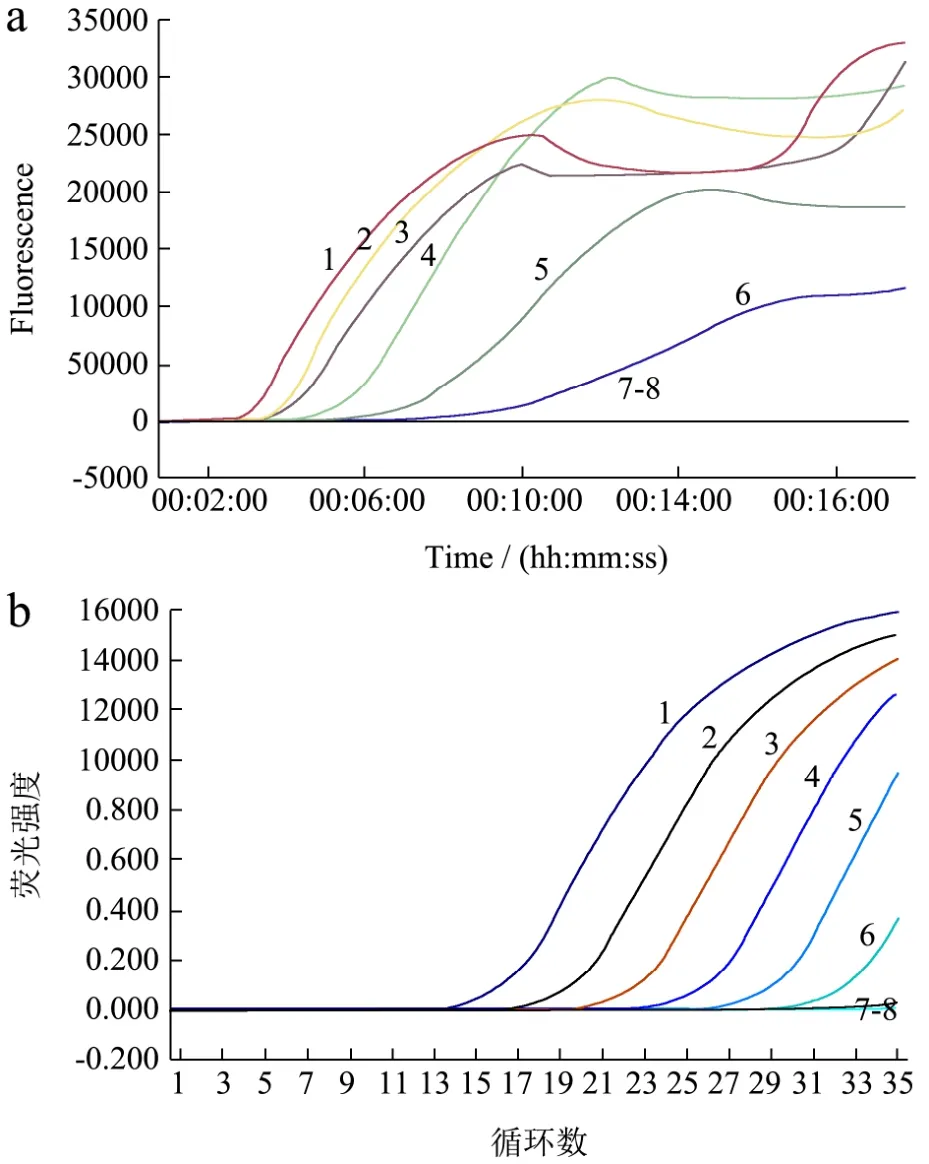
图2 LM real-time RPA和real-time PCR灵敏性结果Fig.2 Sensitivity of real-time RPA and real-time PCR for LM
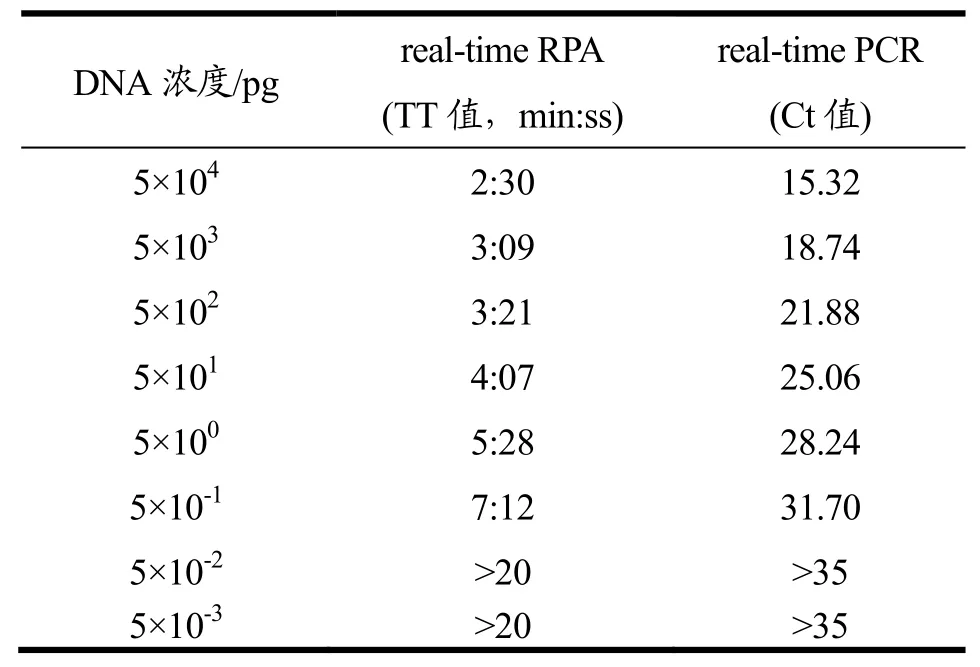
表3 LMreal-time RPA与real-time PCR方法灵敏性结果比较Table 3 Comparison of sensitivity results of real-time RPA and realtime-PCR for LM
2.3LMreal-time RPA 方法的重复性结果
重复性实验结果表明,无论批内和批间重复实验Ct值的标准差均小于1,变异系数<5%(见表4),说明所建立的方法具有良好的重复性。

表4 LM real-time RPA重复性实验Table 4 Repeatability test of LM real-time RPA
2.4 人工污染样品检测结果
通过计算原始菌液量,最终添加至羊肉和生菜样品中的初始菌量分别为 3、29、62 CFU/25 g。取 14、20 h的增菌液进行LM基因组DNA提取,应用本研究建立的real-time RPA方法进行检测。结果表明,空白对照无任何扩增曲线,未检测到LM,说明实验成立。对于接菌量为3 CFU/25 g羊肉和生菜样品,增菌14 h 后,real-time RPA 方法可在 12 min 内实现对LM的检测。对于相同样品,real-time PCR与传统培养方法均检测到LM。三种方法检测结果均一致,但是real-time RPA能够在12 min内获得所有阳性结果,real-time PCR 需要 55 min,而传统培养方法则需要 7 d(结果见表5)。

表5 人工污染样品检测结果Table 5 Results of artificially contaminated samples
3 结论
3.1 同其它核酸扩增技术相比,RPA技术具有以下突出的优势:操作简便、反应时间短、特异性强、灵敏性高、假阳性率低、对核酸要求质量不高等。但由于RPA反应原理和反应过程的特殊性,所用引物探针的长度和标记方法与以往分子生物学方法标记不同,在设计程序上要严格按照其规则进行,尤其注意发卡结构和非特异性扩增的发生,这也是决定其扩增成败的关键。只有完全掌握了RPA引物和探针的设计原则,才能综合试验结果筛选出最佳的引物和探针。
3.2 本研究选取LM特异性基因hlyA为靶基因,设计RPA引物和exo探针,建立了LMreal-time RPA方法。该方法仅对LM出现特异性荧光扩增曲线,具有很好的特异性;检出限可以达到5×10-1pgLM基因组DNA,与本实验室建立的LMreal-time PCR方法一致,但是 real-time RPA 所需要的反应时间远远少于real-time PCR方法。顾思宇等[20]建立的LAMP方法对LM纯培养物的检测限为2.27 fg/μL,低于本研究建立的real-time RPA方法,但LAMP反应时间为45 min,明显高于本研究建立的RPA方法。同时real-time RPA方法重复性良好,无论批内还是批间其变异系数均小于5%。
3.3 本研究中所选用生菜样品菌落总数和大肠菌群背景值低,而羊肉样品背景值较高,但是两种样品在人工污染相同浓度的LM时,均可以通过real-time RPA实现有效检测,说明所建立的real-time RPA方法受样品基质和背景值影响较小。样品增菌14 h后,在接菌量为 3 CFU/25 g 时,real-time RPA 方法能够在 12 min内实现对LM的检测;在接菌量为62 CFU/25 g时,real-time RPA仅需要6~7 min即可实现对LM的有效检测。对不同浓度和不同增菌时间的人工污染样品,real-time RPA 检 测结果同 realtime-PCR、GB 4789.30-2016一致,但是检测时间大大缩短,有效节约了人力物力成本,能够实现对LM的快速检测。
3.4 本研究建立的LMreal-time RPA 检测方法,能够在37 ℃,20 min内实现对食品中LM的快速分子检测,真正实现了快速、简便、灵敏和特异等特点,并且不需要复杂的仪器设备,可应用于食品突发事件中LM的现场快速检测,对保障我国食品安全具有重要意义。在后续工作中,本研究将继续完善大量临床样本的LMreal-time RPA检测和方法验证,以期形成相应的国家标准。同时探索食源性致病菌的多重 real-time RPA方法和基于测流层析试纸条检测的RPA方法将是下一步的研究重点。
