EDTA-壳聚糖对小鼠模型中Cd(Ⅱ)脱除作用
2018-09-08杨锡洪辛荣玉宋琳李银平赵誉焜石百媚张俊逸李钰金解万翠
杨锡洪,辛荣玉,宋琳,李银平,赵誉焜,石百媚,张俊逸,李钰金,解万翠
(1.青岛科技大学海洋科学与生物工程学院,山东青岛266042)(2.青岛信和源生物科技有限公司,山东青岛266002)(3.荣成泰祥食品股份有限公司,山东荣成 264303)(4.山东省冷冻调理食品加工技术企业重点实验室,山东荣成 264309)
镉是人体非必需的有害微量元素,广泛存在于自然环境中,具有生物富集性,所以易在某些植物和动物体内富集,最终通过食物链进入人体。镉在人体内 的半衰期为10~35年[1],长期接触镉会导致慢性中毒。研究证明镉会引发肾、肝和肺等多个人体器官的损伤,并具有致癌和致畸作用[2],日本著名的“骨痛病”事件便是由镉中毒引起。竞争吸附法、酶-微生物分解法及亚临界水处理法等[3]方法大都无法用于活体脱镉,EDTA吸附法是目前较为有效的活体脱镉方法。EDTA结构中含有2个氨基氮原子和4个羧基氧原子,而这些原子都有孤对电子,根据有机结构的张力学理论,五元环或六元环的张力最小,结构最稳定[4],在pH值合适时,EDTA螯合树脂对镉离子的吸附性能可达到最佳。但EDTA用于驱镉时,会促使血液中Cd2+向肝脏、肾脏等脏器转移,对机体无保护作用,加之本身具有一定的毒副作用,在慢性镉中毒时,不宜采用EDTA治疗[5]。
壳聚糖(Chitosan,CTS)是一种阳离子多糖,具有化学和机械修饰的结构可能性[6]。因为CTS分子链上富含游离羟基及氨基,具有提供电子对的O和N,所以能有效与重金属离子形成稳定螯合物,可有效用于含重金属离子工业废水的处理、贵重金属离子富集与回收等领域[7,8]。但是 CTS只能溶于一些稀的无机酸或有机酸中,不能直接溶于水中;且CTS在注射入体内后能快速到达肾脏和尿液中,但几乎不分布到肝、脾和血液等肾以外的组织,各种低分子量的CTS中,仅有壳二糖和壳三糖能被胃肠道略微吸收[9],这在很大程度上限制了它的应用。
将EDTA接枝到CTS分子上,既可以改变CTS的溶解性差的缺点,又可以提高衍生物对重金属的吸附性能,同时又能避免EDTA的毒副作用,提高了脱镉剂的安全性。因此对CTS改性以制备一种水溶性及吸附性较好的吸附剂是近年研究的热点[10]。Ren等[11]开发了一种新型磁性EDTA修饰CTS/SiO2/Fe3O4吸附剂 (EDCMS), 在 pH 5.0( 25 ℃ ) 下 ,CTS/SiO2/Fe3O4(CMS)对 Cu2+、Pb2+和 Cd2+最大吸附容量分别为31.680、9.324和4.496 mg/g,而在相同条件下EDCMS分别为44.736、123.491和63.281 mg/g,比较发现EDCMS对Cu2+、Pb2+和Cd2+的吸附性能比CMS强。REPO等[12]将EDTA或二亚乙基三胺五乙酸(DTPA)的配体固定在 CTS的聚合物基质上,发现制备的吸附剂对Co2+和Ni2+的吸附效率在93.6%~99.5%之间,吸附性能加强。REPO等[13]研究了EDTA配体对CTS与杂化材料进行功能化合成新型吸附剂,发现合成的吸附剂结合了硅胶和CTS的优点。
实验动物的脏器重量和脏器系数是动物主要的生物学特性之一[14]。在药物安全评价的长期毒性试验中,动物脏器的重量常会出现一些变化。为了减小动物体重对脏器重量的影响,通常要计算实验动物的脏器系数,比较不同剂量给药组的脏器系数与对照组的差别,根据差别的显著性检验动物的脏器是否受到不良影响[15]。小白鼠的基因序列和人类相似,它的全基因组和人类的相似度极高,很多人类难以治愈的疾病可以在小白鼠身上找到相似性状,从而加以实验发现致病基因。因此本文采用小鼠模型进行脱镉实验,从而为人类脱镉提供试验基础。
本文采用EDTA-Na2对CTS进行酰化改性,通过引入羧基以制备一种溶解性及吸附性均较 CTS好的壳聚糖衍生物,同时,小分子的EDTA盐与CTS螯合后增加了安全性。通过蓄积及脱除实验,从生物学水平研究ETC对镉模型小鼠中Cd2+的吸附情况。为该类衍生物作用于人体以脱除重金属提供了实验基础。
1 材料与方法
1.1 材料与试剂
昆明种小鼠由湛江422医院动物中心提供(许可证号 SYXK(粤)2014-0053),体重 20~28 g;小鼠饲养温度控制在20~26 ℃,自由采食、饮水;小鼠饲料、垫料由广东医学院提供。
壳聚糖(脱乙酰度≥90%,分子量50~60 ku,食品级),江苏南通绿神生物工程有限公司;EDTA-Na2、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(EDAC),上海源聚生物科技有限公司;羧甲基壳聚糖(CMCS),浙江金壳生物化学有限公司。
1.2 仪器与设备
Thermo M6原子吸收分光光度计,赛默飞世尔科技公司;NEXUS-670红外光谱仪,美国Nicolet公司;FDU-1100真空冷冻干燥机,埃朗科技国际贸易(上海)有限公司;YL300杯式超滤器,上海羽令过滤器材有限公司;mW800微波消解仪,加拿大aurora仪器(中国)有限公司。
1.3 方法
1.3.1 ETC 制备
0.5 g CTS 加入到 50 mL 0.1%(V/V)醋酸溶液中,搅拌至完全溶解。加入 1 g EDTA-Na2[16],并用 5 mol/L NaOH和1 mol/L HCl调pH至5.5,再加入EDAC并使其终浓度为40 mmol/L;混合物室温搅拌反应16 h,反应结束后透析,冷冻干燥即为成品[17]EDTA-CTS(ETC)。
1.3.2 ETC的FT-IR表征
ETC经真空干燥后,用KBr混合压片法,利用红外光谱仪进行表征。
1.3.3 ETC 取代度(DS)的测定
准确称量0.2 g在105 ℃烘干的ETC样品,加入30 mL 0.1 mol/L HCl标准溶液,充分搅拌使其完全溶解,用0.1 mol/L NaOH标准溶液滴定,记录pH值变化[18]。

注:DS为EDTA在CTS上取代度[19];0.157为EDTA取代占衍生物比值;∆V为两个突变点之间消耗NaOH标准溶液的体积(mL);M为氢氧化钠溶液的浓度(mol/L);W为样品的净重(g)。
1.3.4 ETC的热分析
通过热重、差示量热扫描(TG-DSC)分析研究ETC衍生物的热稳定性[20]。
1.3.5 小鼠体内重金属镉的蓄积
1.3.5.1 连续染毒方法
对照组:腹腔注射生理盐水(10 mL/kg),每1 d注射一次,共注射6次。
染毒组:将小鼠腹腔注射 CdCl2溶液(镉 1 mg/kg),每1 d染毒一次,共染毒6次,染毒结束1 d后,活体摘除眼球取血,处死小鼠取各脏器,消化检测Cd2+含量。
1.3.5.2 间隔染毒方法
对照组:腹腔注射生理盐水(10 mL/kg),隔2 d 注射一次,共注射3次。
染毒组:将小鼠腹腔注射CdCl2溶液(镉1 mg/kg),隔2 d染毒一次,共染毒三次,染毒结束1 d后处死小鼠,其他同1.3.5.1[21,22]。
1.3.6 小鼠脱毒实验
将上述染毒组小鼠随机分成8组,分别为空白对照组、染毒对照组、EDTA治疗组、ETC低剂量治疗组(0.0731 g/kg)、ETC 中剂量治疗组(0.1461 g/kg)、ETC高剂量治疗组(0.2922 g/kg)、CTS 治疗组(0.2922 g/kg)、羧甲基壳聚糖治疗组(CMCS 0.2922 g/kg)[23]。以灌胃的方式脱毒处理6 d,治疗结束后1 d处死小鼠。
1.3.7 小鼠处理及体内重金属含量的检测
1.3.7.1 小鼠血样中镉含量
小白鼠进行活体摘除眼球取血0.5 mL,血样用石墨炉原子吸收光谱仪测定血镉含量。同时做试剂空白[24,25]。
1.3.7.2 染毒小鼠脏器中的镉含量
末次给药治疗后1 d处死小鼠,取心,肝,肾脏器。
用生理盐水清洗表面血污,滤纸吸干表面水分,称重。计算实验动物脏器的重量与其体重之比,即脏器系数[26],计算公式如下:

然后进行消化后,采用原子吸收分光光度法[27]检测肝脏、肾脏、及心的镉含量。
1.3.8 统计学处理
2 结果与分析
2.1 ETC的红外表征及热分析
2.1.1 衍生前后的FT-IR表征

图1 CTS及ETC的FT-IR图谱Fig.1 FT-IR spectra of chitosan and ETC
经酸碱滴定法计算,本实验合成的ETC的取代度为0.4,即2.5个糖单体上酰化一个EDTA分子。CTS及其衍生物ETC的FT-IR图谱如图1所示。CTS的红外光谱中3422 cm-1是-OH和-NH2的伸缩振动峰,1597 cm-1为 N-H 的面内弯曲振动(酰胺Ⅱ),1380 cm-1为N-H的面外弯曲振动(酰胺III)[29~31]。与CTS不同的是,ETC在1401 cm-1处较强的特征峰为羧基的对称伸缩振动峰,说明产物结构中羧基含量较多,1628 cm-1处为酰胺基中的C=O特征峰,同时在1597 cm-1处游离氨基的吸收峰消失,证明EDTA在CTS的C2位上的伯氨基发生酰化反应;而从ETC的红外光谱图中观察不到 C6位上的伯羟基酰化生成的酯的特征峰,证明CTS C2位的氨基上发生酰化反应[32]。图中结构式为EDTA-CTS结合物的推定结构,络合剂的共价连接通过构成聚合物的伯氨基与EDTA的羧酸基团的酰胺结合来实现[33]。
2.1.2 CTS及ETC的TG-DSC分析

图2 CTS与EDTA-CTS的TG-DSC图谱Fig.2 TG-DSC curves of chitosan and ETC
CTS与ETC的TG-DSC图谱如图2所示。由图2可知,在DSC图谱中,CTS和ETC在升温受热情况下有两个吸热峰,前面的是其失去吸附水后产生的吸热峰,而308.27 ℃和277.12 ℃为主链断裂所产生,ETC中该峰向低温移动约20 ℃,说明衍生化后糖链断裂所需能量降低[34]。从热重图谱可知,随着温度的升高,ETC和CTS都有2个热失重阶段,第一阶段发生在100 ℃之前,此阶段失重较小,主要是样品中的结合水与结晶水的蒸发。第二个阶段发生在250~350 ℃之间,此阶段失重较大,说明此时CTS及壳聚糖衍生物都热降解剧烈。两者不同之处是,ETC在100 ℃之前热失重率较大,约为10%,表明产物含水较高;第二热失重阶段,ETC降解温度范围较宽,且热失重率较小,表明具有比CTS较高的热稳定性。
2.2 小鼠体内重金属镉的蓄积
通过对小鼠连续染毒及间接染毒两种方式染毒,结束后1 d处死小鼠,测定小鼠血、心、肝和肾的镉含量见表1。从表1可以看出,小鼠经染毒后,在小鼠的四部位镉含量都发生明显的变化(p<0.01),都明显的增加,其中连续染毒的血镉含量甚至到达 202.50 μg/L,是空白组的200倍以上,连续染毒与间接染毒的小鼠血液中的含量最高,分别为202.50 μg/L,108.21 μg/L;其次为肝,分别为 72.26 μg/g,25.70 μg/g,证明染毒成功。从数据中可判断出连续染毒中各部分的镉含量都比间接染毒要多,说明连续染毒对小鼠的毒害作用比间接染毒强,其原因在于连续注射(6次)的总剂量远高于间隔注射(3次),连续染毒小鼠体内富集的镉含量明显高于间接染毒;连续染毒中肝的镉含量是间接染毒中铬含量的3倍,增大倍数明显大于其他器官,这可能是由于小鼠的肝解毒功能,使间接染毒的小鼠中镉含量在一定程度上明显降低。
表1 染毒小鼠镉含量Table 1 The cadmium contents in toxic mice(±s)

表1 染毒小鼠镉含量Table 1 The cadmium contents in toxic mice(±s)
注:血镉含量单位为(μg/L),脏器镉含量单位(μg/g),湿重计。与空白组相比,##p<0.01。
组别 检测部位 连续染毒 血 心 肝 肾 空白组 1.420±0.080 0.041±0.003 0.017±0.004 0.040±0.006 染毒组 202.500±6.620## 1.720±0.008## 72.260±3.910## 19.980±0.280## 组别 检测部位 间接染毒 血 心 肝 肾 空白组 1.395±0.110 0.038±0.001 0.041±0.003 0.035±0.008 染毒组 108.210±4.500## 0.830±0.008## 25.700±0.330## 6.592±0.040##
表2 两种染毒方式对小鼠体重的影响Table 2 The effect of two exposure ways on body weight of mice(±s)

表2 两种染毒方式对小鼠体重的影响Table 2 The effect of two exposure ways on body weight of mice(±s)
注:间接染毒与相应的连续染毒组比较,#p<0.05,##p<0.01;相同染毒方式与染毒前1天比较,*p<0.05,**p<0.01;单位(g)。
组别 连续染毒 间隔染毒 染毒前1 d 染毒开始后第8 d 染毒前1 d 染毒开始后第8 d 空白对照组 21.81±1.67 24.25±3.19 24.50±3.08 28.00±1.55#* 镉对照组 21.69±2.25 22.68±1.44 23.67±2.58 27.20±1.30##** EDTA治疗组 22.07±2.01 23.73±1.56 21.83±2.85 26.50±3.33** ETC低剂量治疗组 20.73±2.17 23.33±1.91 23.33±2.58 27.33±3.01#* ETC中剂量治疗组 21.59±2.22 23.53±2.54 21.33±1.03 26.33±2.16#** ETC高剂量治疗组 21.34±4.84 22.55±3.55 22.83±2.48 26.50±1.22 CTS治疗组 23.65±2.68 23.94±4.36 23.00±2.68 26.33±1.75 CMCS治疗组 21.58±2.81 21.61±4.29 22.17±2.22 26.33±2.58#*
2.3 不同给药及剂量对小鼠体重的影响
两种染毒方式对小鼠体重的影响见表2数据。从表2可知,连续染毒法处理组体重都低于空白对照组,虽然无显著性差异,也可说明连续染毒对小鼠体重的增长起到了一定的抑制作用,在间隔染毒法中,染毒开始后第8 d的小鼠体重均增加,且EDTA治疗组、ETC低、中剂量治疗组、CMCS治疗组具有显著性差异(p<0.05 或p<0.01)。在连续染毒 8 d 后,CMCS 治疗组小鼠体重明显降低,具有显著性差异(p<0.05)。间隔染毒各组之间与相应的连续染毒组相比,大都具有显著性,说明两种染毒方式对动物产生的急性毒性作用有一定的差别,这与朱圣陶等[35]的研究结果相似,他认为小鼠对隔日染毒具有较大的耐受性,动物可在短期时间内对重金属代谢,使其生长不出现抑制。
2.4 驱镉剂治疗后小鼠脏器系数的变化

图3 不同染毒方式对小鼠脏器系数的影响Fig.3 Effects of different exposure modes on organ coefficient in mice
以连续和间隔染毒的不同染毒方式对小鼠脏器系数的影响,如图3所示。从图3可以看出两种染毒方式对小鼠脏器系数的影响相似,小鼠经镉染毒并解毒后,镉对照组与空白对照组相比,注射金属镉可导致小鼠心脏系数增大,而对肝脏及肾脏系数影响不大。连续染毒方式中,ETC低剂量、ETC高剂量治疗组、CTS治疗组、CMCS治疗组与镉对照组相比,心脏系数均降低且具有显著差异性(p<0.05或p<0.01);间隔染毒中,EDTA治疗组、ETC低剂量组、CMCS治疗组较镉对照组心脏系数显著降低,说明驱镉剂的加入能使镉中毒引起升高的心脏系数降低。两种染毒方式对小鼠肝脏、肾脏系数的影响相似,表明本实验所用金属镉溶液染毒剂量对动物心脏系数有影响,而对肝脏和肾脏系数无明显影响。这可能与肝脏与肾脏是排毒器官有关。
2.5 脱镉剂治疗后小鼠血镉含量检测
以不同类型及剂量的脱镉剂进行脱除后,测得各组小鼠的血镉含量如表3所示。从表3可以看出,在对小鼠先进行染毒后进行脱除后发现,各治疗组与镉对照组相比血镉含量均降低,差异具有显著性(p<0.01),说明驱镉剂的加入,对小鼠体内镉的脱除起到了一定作用,从而使血液中的镉含量降低。尤其是在加入EDTA脱镉剂后,与镉对照组血样中的镉含量相比,血样中的镉含量浓度差距最大,但在血样中的含量也是最少的,这可能由于在确定 ETC的计量组时,并没有使用最佳脱镉浓度,而EDTA治疗组正好处于最佳脱镉浓度,导致最终在加入EDTA后血样中镉含量最少。
表3 各组小鼠血镉含量Table 3 The concentration of the blood cadmium of every group mice(±s)
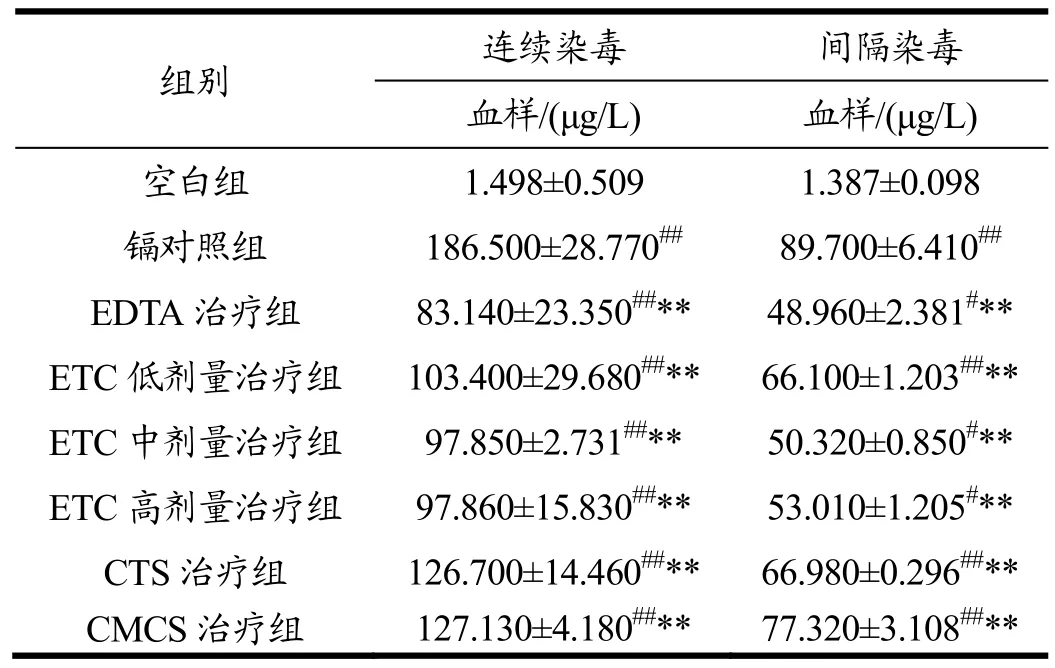
表3 各组小鼠血镉含量Table 3 The concentration of the blood cadmium of every group mice(±s)
注:与空白组相比,#p<0.05,##p<0.01;与镉对照组相比,*p<0.05。
组别 连续染毒 间隔染毒 血样/(μg/L) 血样/(μg/L) 空白组 1.498±0.509 1.387±0.098 镉对照组 186.500±28.770## 89.700±6.410## EDTA治疗组 83.140±23.350##** 48.960±2.381#** ETC低剂量治疗组 103.400±29.680##** 66.100±1.203##**ETC中剂量治疗组 97.850±2.731##** 50.320±0.850#** ETC高剂量治疗组 97.860±15.830##** 53.010±1.205#** CTS治疗组 126.700±14.460##** 66.980±0.296##**CMCS治疗组 127.130±4.180##** 77.320±3.108##**
2.6 脱镉剂治疗后小鼠各脏器镉含量变化
通过对动物小鼠的镉建模实验,染毒组的小鼠各脏器中镉的含量与空白对照组相比均升高,且均具有显著性差异(p<0.01)。以不同脱镉剂对小鼠各脏器进行脱毒,脱毒后镉含量的变化如图4所示。从图4可知,连续染毒方式中,EDTA与CTS治疗组除外,其余各治疗组各脏器镉含量与镉对照组相比均减少,并具有显著性差异(p<0.01),CTS治疗组与镉对照组相比,心、肝镉含量均降低,并有显著性差异(p<0.01),EDTA治疗组虽然对各脏器镉含量有降低作用,但是无显著性差异。间隔染毒方式中,除CTS治疗组外,其余各治疗组与镉对照组相比小鼠各脏器镉含量均较少,并有显著性差异(p<0.01)。

图4 不同脱镉剂对小鼠脏器镉含量的影响Fig.4 Effect of Different Cadmium Removal Agents onCadmium Contents in Mice
4种脱除方法中,ETC衍生物高剂量组相对于ETC中剂量组、ETC低剂量组对镉脱除动物小鼠体内的脏器镉含量效果更好。CTS脱重金属能力增强的原因在于,壳聚糖通过在O-位引入外来基团,不仅保留了氨基,使N的孤对电子能更多重金属离子形成配位键,且引入的基团又可进一步增强壳聚糖的吸附能力[36]。
3 结论
3.1 通过 EDTA 对 CTS改性,制得壳聚糖衍生物ETC。然后以不同的染毒方式进行Cd2+的蓄积及脱除。两种染毒方式都会使镉对照组心脏系数均增大,并有显著差异性。ETC低、高剂量组、CTS治疗组、CMCS治疗组与镉染毒组相比,心脏系数均降低,脱镉剂对重金属有一定的驱除作用。
3.2 EDTA、ETC、CTS对血镉脱除率分别达58.94%、51.68%、37.43%;而 ETC对小鼠脏器镉的脱除率远高于其他脱镉剂,其中对心、肾镉脱除率分别高达63.90%、45.00%,得出ETC对小鼠体内重金属Cd2+有较好的吸附作用。
3.3 目前镉污染已经越来越严重,无论是陆地、海洋还是人体的重金属超标现象也越来越严重。就现在来看,大多数重金属脱除剂会对人体、海洋动物等产生各种副作用,导致人体、动物的脏器受损严重,因此人类、动物急需一种天然、无毒、高效的脱镉剂来脱除其身体中的重金属镉。而本文所制备的改性壳聚糖,能在一定程度上克服了CTS的难溶于水的缺点,而且高效、无毒,为以后人类去除水中的重金属Cd2+及其他有毒、有害的离子提供了一条新思路。
