响应面法优化顺丁烯二酸-β-环糊精单乙酯的制备工艺
2018-09-08梁倩李咏富龙明秀田竹希何杨波石彬
梁倩,李咏富,龙明秀,田竹希,何杨波,石彬
(贵州省农业科学院现代农业发展研究所,贵州贵阳 550006)
环糊精是一种具有疏水性内腔的环状低聚糖,它由多个α-D-吡喃葡萄糖通过α-1,4-糖苷键首尾相连而形成的化合物[1~3],能选择性地结合底物,可以通过超分子催化化学反应[4]。其空腔结构可提供理想的作用位点,能与一定大小和形状的疏水性客体、亲脂性物 质通过范德华力、氢键等非共价键作用力形成包合物,不同强度的范德华力形成的包合物具有多种独特的物理、化学性质。可以运用于疏水性药物、天然色素、精油等食品和医药领域。天然的β-环糊精(β-CD)是由7个α-D-吡喃葡萄糖结构单元构成的,而其水溶性有限,它们与某些疏水性客体形成的包合物的水溶性得不到改善,更容易从水溶液中析出。因此,制备亲水性β-CD衍生物可以增加β-CD在水中的溶解性、稳定性并且拓展β-CD的应用范围,例如稳定的亲水性β-CD衍生物可作为一种理想药物载体,能够对疏水性药物有增溶作用[4~6],对天然药物具有保护和缓释作用等[7,8]。
本文以含乙烯基的β-CD为单体,通过与亲水性单体发生自由基共聚反应制备水溶性β-CD高分子聚合物,以期增大β-CD在水中的溶解性和稳定性。衍生物中含乙烯基的报道较少,现有方法在制备乙烯基β-环糊精衍生物时采用有毒化学试剂,对环境造成污染的同时也限制了乙烯基β-环糊精衍生物的应用范围[9]。
本文采用安全的低毒的方法,通过磷酸盐的催化含有乙烯基的顺丁烯二酸与β-CD进行酯化反应,制备β-CD高分子聚合物,并采用响应面BBD设计优化酯化反应的参数条件,得到最佳条件下的酯化产物,以期增大β-CD在水中的溶解性,增加对疏水性药物的水溶性,为其进一步在药物载体方面和生物活性等方面的研究奠定基础,拓展其在食品和药品行业的应用[10]。
1 材料与方法
1.1 材料
β-环糊精(分析纯)、顺丁烯二酸(分析纯)购于阿拉丁试剂有限公司;次亚磷酸钠(SPD)购于Sigma-Aldrich(USA);甲基氢醌购于中国国药集团公司;其余试剂均为分析纯;Aglient 1260高效液相色谱仪,安捷伦科技有限公司;傅里叶红外光谱仪(Tensor 37, BRUKER OPTICS, Germany);MALDI-TOF 质谱仪(BIFLEX III, Bruker Daltonics Inc., USA)。
1.2 顺丁烯二酸-β-环糊精单乙酯(CDM)的制备
顺丁烯二酸-β-环糊精单乙酯(CDM)的合成反应如下所示:

CDM的制备采用半干法,将3.405 g的β-CD与顺丁烯二酸(3~7 mmol)、次亚磷酸钠(0.2~0.7 mol)、甲基氢醌0.0186 g加入耐压品中,按固液比(0.3~0.6)加入乙醇水(30%~70%)溶液,混合均匀后于恒温鼓风干燥箱内(100 ℃~120 ℃)高温下反应3.5 h时。反应完全后冷却至室温,向耐压品中加入30 mL无水乙醇,静置24 h,过滤,用无水乙醇反复洗涤滤饼至到将水分洗净,于60 ℃烘箱干燥,产物即为顺丁烯二酸-β-环糊精单乙酯(CDM)。
1.3 HPLC法测定CDM酯化率
1.3.1 HPLC测定条件
CDM酯化率的测定采用YMC-AQ-C18(250×4.6 mm)色谱柱,流动相A为0.01 mol/L乙酸水溶液,B为无水乙醇,等度洗脱,流速1.2 mL/min;检测波长210 nm;柱温 35 ℃;进样量 10 μL。
1.3.2 标准品制备和标准曲线绘制
采用内标法测定CDM酯化率,以顺丁烯二酸单乙酯为标准品,分别配置浓度为0.05,0.1,0.5,1,2,3.5 mmol/L的标准溶液,将标准溶液浓度与其峰面积进行回归处理,绘制标准曲线,得到线性方程为y=2475.1x+9.3256,γ=0.9998,线性关系良好。
1.3.3 样品制备
准确称取CDM样品0.25 g,用蒸馏水定容至25 mL,配置成浓度为100 mg/mL的样品溶液,经过0.45 μm滤膜过滤后进行HPLC分析,测定其色谱峰面积,代入标准曲线计算酯化率(%)。
1.4 响应面设计试验
基于前期预实验工作[11],考察了CDM制备的主要因素有顺丁烯二酸用量(X1,mmol)、固液比(X2)、反应温度(X3,℃),乙醇浓度(X4,%)4个因素范围;结合中心组合 BBD法,设计上述四因素三水平的响应面优化试验,以确定CDM的最佳制备条件。试验因素水平设计如表1所示。

表1 BBD中心组合试验设计方案中的因素水平表Table 1 The coded values and corresponding actual values of the optimization parameters
1.5 CDM的结构表征
1.5.1 红外光谱
顺丁烯二酸单乙酯、β-CD和CDM红外光谱图采用傅里叶红外光谱仪进行测定。取少量样品与质量为300 mg的KBr混匀,于研钵内研磨成粉末后压片,在4000~400波数(cm-1)内扫描。
1.5.2 质谱信息
β-CD和CDM质谱信息采用MALDI-TOF质谱仪进行测定,以2,5-二羟基苯甲酸作为基质。
1.6 统计方法
使用SPSS 18.0软件对数据进行统计学分析,响应面优化试验使用Design-Expert 8.0.5b对试验数据进行多项式回归分析;使用t检验对回归系数进行统计分析,F检验对二次多项线性回归方程的显著性进行评价,回归系数R2评价模型的回归系数和实验数据的拟合度。
2 实验结果与讨论
2.1 CDM样品的高效液相色谱图
顺丁烯二酸单乙酯、CDM 的高效液相色谱图如图1所示。顺丁烯二酸单乙酯、CDM出峰时间都在4 min左右,且不重合,说明顺丁烯二酸单乙酯可以作为内标物[12~14]。

图1 顺丁烯二酸单乙酯、顺丁烯二酸-β-环糊精单乙酯的高效液相色谱图Fig.1 The HPLC chromatograms of monoethyl maleinate and CDM
2.2 顺丁烯二酸-β-环糊精单乙酯制备参数的优化
2.2.1 模型的适应性分析
通过响应面 BBD中心组合实验得到实验值与预测值如表2所示,顺丁烯二酸-β-环糊精单乙酯的酯化率分布在0.062%~36.75%范围内,运用Design-Expert 8.0.5b统计软件对数据进行多项式回归分析,确定其回归方程式,CDM 酯化率用二次多项式回归方程表示:

回归方程通过T检验、F检验,如表3所示,该模型p<0.0001,失逆项F值为1.55,p=0.3568,说明该模型有意义,模型拟合程度好;其决定系数R2值为0.8848,接近于1,说明实验值和预测值很接近;其校正系数R2Adj值为0.7681,说明酯化率响应值的76.81%可以被该模型预测,表明该模型的拟合度比较高[15,16]。 计自主生成结果。

表2 Box-Behnken中心组合试验设计及CDM酯化率的响应值Table 2 Box-Behnken central composite experimental design setting in coded form of the independent variables (X1, X2, X3,X4) and predicted and experimental values
p值对系数交互影响进行评价,p值越小,系数之间相互影响就越有意义[15,17],从表3可以看出,该二次多项回归方程的一次项系数X1、X2、二次项系数X12、X22、X32具有显著性差异(p<0.05)。

表3 响应面二次回归模型及其回归系数方差分析结果Table 3 ANOVA for the effects amounts of maleic acid (X1), solid-to-liquid ratio (X2), reaction temperature (X3) and ethanol concentsolid-to-liquid ration (X4) on synthesis of CDM using predicted polynomial models
2.2.2 响应面分析
本试验的顺丁烯二酸用量(X1,mmol)、固液比(X2)、反应温度(X3,℃),乙醇浓度(X4,%)四个因素对CDM酯化率的交互影响如图2A~F所示。
如图2A 3D响应面所示,当反应温度(110 ℃)、乙醇浓度(45%)一定时,CDM酯化率随着顺丁烯二酸用量(1~5 mmol)增加而升高,随着固液比(0.3~0.45)增加而缓慢升高,随着固液比(0.45~0.6)的增加趋于平稳,当顺丁烯二酸用量与固液比分别为3和0.45时,CDM酯化率达到最佳。
如图2B 3D响应面所示,当固液比(0.45)与乙醇浓度(45%)一定时,CDM酯化率随顺丁烯二酸用量(1~5 mmol)升高而升高,随着反应温度(100~120 ℃)升高而缓慢升高。
如图2C 3D响应面所示,当固液比(0.45)与反应温度(110 ℃)一定时,CDM 酯化率随乙醇浓度(30%~45%)的升高趋于平稳,随顺丁烯二酸用量(1~5 mmol)升高而升高,当乙醇浓度为45%,顺丁烯二酸用量为3 mmol时,CDM酯化率达到最佳。
如图2D 3D响应面所示,当顺丁烯二酸用量(3 mmol)与乙醇浓度(45%)一定时,CDM 酯化率随反应温度(100~110 ℃)的升高而缓慢升高,随固液比(0.3~0.45)升高而缓慢升高,当反应温度和固液比分别为110 ℃和0.45时,CDM酯化率达到最大。
如图2E 3D响应面所示,当顺丁烯二酸用量(3 mmol)与反应温度(110 ℃)一定时,CDM 酯化率随固液比(0.3~0.45)和乙醇浓度(30%~45%)的升高而缓慢升高,当固液比和乙醇浓度分别为 0.45和45%时,CDM酯化率达到最大。
如图2F 3D响应面所示,当顺丁烯二酸用量(3 mmol)与固液比(0.45)一定时,CDM 酯化率随乙醇浓度(30%~45%)和反应温度(100~110 ℃)的升高而缓慢升高,当乙醇浓度和固液比分别为 45%和110 ℃时,CDM酯化率达到最大。
2.2.3 验证实验

图2 3D响应面及等值图Fig.2 Response surface (3D) and Contour plots showing the effect of amounts of maleic acid (X1), solid-to-liquid ratio (X2),reaction temperature (X3) and ethanol concen-tsolid-to-liquid ration (X4) on synthesis of CDM.
为了验证模型方程的可靠性,根据响应面优化的条件进行验证实验:顺丁烯二酸用量 4.3273 mmol,固液比 0.4085,反应温度 109.462 ℃,乙醇浓度48.213%,为了实验的可操作性,将其进行修正。验证试验(n=3)结果如表4所示,实际测得CDM酯化率为40.977±2.032%,这与理论预测值40.71%接近(相对误差0.656%)。因此,采用BBD中心组合试验设计优化得到的工艺参数,准确可靠,具有意义。

表4 模型验证实验结果Table 4 Comparison between the predicted value and observed value for the response variables
2.3 CDM的结构表征
2.3.1 红外光谱分析
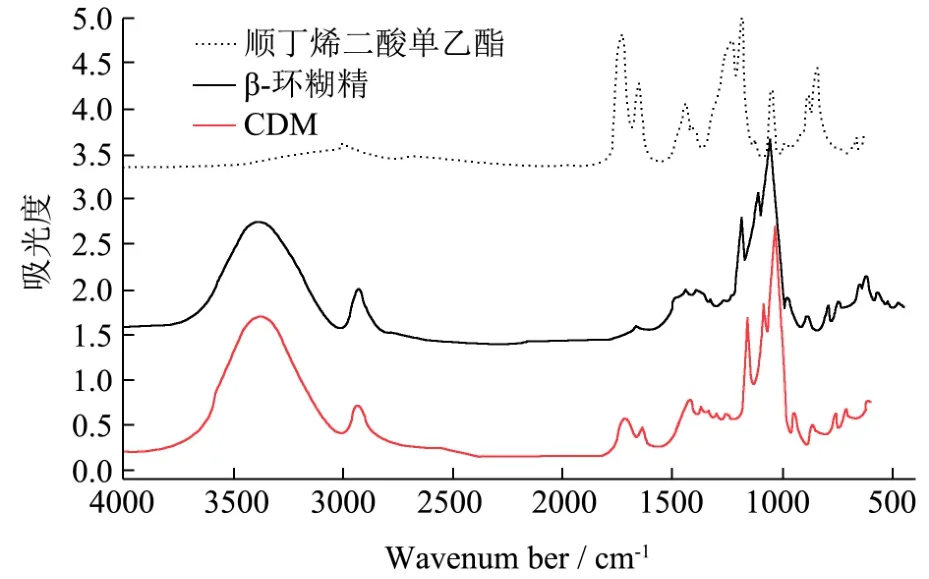
图3 顺丁烯二酸单乙酯、β-环糊精及顺丁烯二酸-β-环糊精单乙酯(CDM)红外光谱图Fig.3 The FT-IR sepctra of monoethyl maleinate, β-cyclodextrin and CDM
顺丁烯二酸单乙酯、β-CD以及CDM的红外光谱[18,19]比较图如图3所示β-CD吸收峰:在950 cm-1处是环糊精糖苷键骨架振动吸收峰,1044 cm-1是C-O/C-C拉伸震动吸收峰,1205 cm-1处吸收峰属于O-H平面弯曲振动,1160 cm-1C-O-C拉伸/O-H弯曲振动吸收峰,1250~1370附近吸收峰属于C-H的弯曲振动,1465 cm-1处CH2弯曲振动吸收峰;顺丁烯二酸单乙酯中不饱和酯键吸收峰有:1722 cm-1处C=O伸缩振动吸收峰,1708 cm-1处羧酸C=O伸缩振动吸收峰,CDM保留了β-环糊精的固有吸收峰,在1722 cm-1和1708 cm-1处不饱和酯键吸收峰与顺丁烯二酸一致,在1637 cm-1处是C=C双键伸缩振动吸收峰。由此说明了顺丁烯二酸-β-环糊精单乙酯(CDM)的合成[20]。
2.3.2 质谱分析
对β-CD及CDM进行了质谱分析[21,22],质谱信息如图 4所示,[CDM+Na]+质荷比(m/z)为 1255.6,[β-CD+Na]+质荷比(m/z)为1157.6,顺丁烯二酸的相对分子质量为116.07,也就是说CDM失去一个水分子(相对分子质量18)与顺丁烯二酸中的一个羧基发生酯化反应,形成CDM,CDM结构如图5所示。

图4 CDM的质谱图Fig.4 The mass spectra of CDM

图5 CDM结构图Fig.5 The molecular structure of CDM
3 结论
本文采用Design-Expert 8.0.5b软件,以BBD中心设计法优化顺丁烯二酸-β-环糊精单乙酯(CDM)合成条件,优化得到的工艺参数为顺丁烯二酸用量4.327 mmol,固液比0.408,反应温度109.462 ℃,乙醇浓度48.213%,CDM酯化率预测值为40.71%,在最佳工艺参数下,CDM实际酯化率达到40.977±2.032%,与预测值接近(相对误差 0.656%)说明采用响应面BBD中心组合试验设计优化得到CDM合成参数准确可靠;通过对样品进行红外光谱和质谱表征,佐证了顺丁烯二酸-β-环糊精单乙酯的合成。
顺丁烯二酸-β-环糊精单乙酯(CDM)制备工艺的优化,为进一步研究CDM单体的活性以及相关实验奠定了基础,为其在药物和食品方面的开发应用提供了参考。
