酶法制备葛根素的丙酯衍生物
2018-09-08袁亭亭李晓凤袁琨
袁亭亭,李晓凤,袁琨
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.乳业生物技术国家重点实验室,广东广州 510640)
葛根素有多种生理活性,在临床上主要用于治疗冠心病、高血压、心绞痛和心率失常等心血管方面疾病,且已显现出较好的疗效;除此之外,葛根素还可以增加脑血流量,促进人体脑循环,因此,常用于治疗脑动脉硬化、短暂脑缺血发作等脑血管疾病,且疗效极佳[1,2]。然而,由于其结构是异黄酮结构,脂溶性 较差,造成其生物利用度较低[3]。已有研究表明,通过对黄酮类化合物的酰化修饰可以有效提高其脂溶性,进而能够增强其生物利用率[4]。
目前可以对黄酮化合物酰化修饰的方法有传统的化学法和酶催化的方法,但是采用常规化学法对黄酮化合物进行选择性的酰化修饰一般要经过基团保护、酯化、脱保护基团等处理,此类方法步骤繁杂,引入溶剂较多;利用酶法催化黄酮类化合物的酰化反应可以避免上述这些问题。脂肪酶,即三酰甘油酯水解酶(EC3.1.1.3),是一类具有特殊性质的酯酶,能在水不溶性体系或油水界面进行催化反应,具有立体选择性、对映选择性、底物专一性等诸多特点[5]。脂肪酶在有机溶剂体系和水体系中都具有较高的稳定性和有效性,是一种非常重要的生物催化剂。在非水相介质中,脂肪酶能催化水解反应的逆反应,主要包括酯化反应和酯基转移反应(酯交换反应、醇解反应和酸解反应)等合成型反应[6,7]。
基于上述研究现状,本研究探讨了酶催化葛根素酰化反应的可行性,从8种水解酶中筛选出能高效催化葛根素丙酰化反应的生物酶制剂;探讨了有机溶剂的种类、反应时间、水分含量和底物摩尔比等反应参数对葛根素丙酰化反应的影响规律;并通过高效液相色谱、质谱、傅里叶红外光谱等技术对所制备的黄酮酯类产物进行了结构鉴定,进一步确定了产物主要是葛根素丙单酯。
1 材料与方法
1.1 材料
Novozym 435,来源于Candida Antarctica,type B;LipozymeIMTL,来源于Thermomyces lanuginosus;LipozymeIMRM,来源于Rhizomucor miehei;Novozym 435、LipozymeIMTL、LipozymeIMRM、猪胰脂肪酶、CRL酶均购自诺维信公司;胰脂肪酶、肽酶、胃蛋白酶来自华南理工大学蛋白中心赠送。
葛根素购自上海Aladdin公司;丙酸乙烯酯(VP),购自美国Sigma公司;甲醇,购自德国Merck公司,色谱纯;四氢呋喃、N,N-二甲基甲酰胺、二甲基亚砜、叔丁醇、乙腈、异丙醇、2-甲基四氢呋喃、石油醚、异辛烷、甲醇均购自天津市科密欧化学试剂公司,均为市售分析纯。
1.2 主要仪器设备
Waters高效液相色谱仪,配备600控制器、2996光电二极管矩阵PDA紫外检测器、717 Plus自动进样器。色谱柱:4.6×250 mm(5 μm) Zorbax SB-C18 分析型色谱柱(Agilent Technologies Co, Ltd, USA);液相色谱-质谱联用仪,型号:7890A/5975C,美国安捷伦公司;Bruker AV600型核磁共振仪,瑞士布鲁克公司;移液枪(20 μL、100 μL、200 μL、1 mL 和 5 mL):德国Eppendorf公司;FA2204B电子天秤:上海精密科学仪器有限公司;TW-3021HR冷冻离心机,安徽嘉文仪器装备有限公司;高速离心机,美国Thermo公司;HZQ-F100全温气浴振荡培养箱。
1.3 实验方法
1.3.1 不同种类酶催化葛根素酯合成反应
在5 mL带塞三角瓶中加入1 mL四氢呋喃、20 mmol/L葛根素、600 mmol/L丙酸乙烯酯(VP),分别相应地加40 mg/mL酶,在恒温气浴培养箱中振荡反应(40 ℃、200 r/min)。定时取样 100 µL,12000 r/min离心5 min后,取20 µL上清液,用63%甲醇-水溶液稀释50倍,液相色谱自动进样器进样20 µL,供分析。
1.3.2 反应初速度、底物转化率、区域选择性的计算[8]
1.3.2.1 反应初速度 V0值(Initial rate,mmol/(L·h))
根据反应开始阶段,单位时间内葛根素的减少量来计算初始反应速度:反应初速度V0(mmol/(L·h))=(A0-Ai)/t。
其中:A0、Ai分别表示反应前后葛根素的浓度(mmol/L),t为反应时间(h)。
1.3.2.2 底物转化率(Conversion,%)
根据底物反应前后葛根素的峰面积的差值与反应前葛根素峰面积之比值来计算转化率:
转化率C(%)=(S0-Si)/S0×100%。
其中:S0、Si分别表示反应前后葛根素的峰面积。
1.3.2.3 区域选择性(Regioselectivity,%)
根据目的酰化产物的峰面积与所有酰化产物的峰面积之比值来计算反应的区域选择性:
区域选择性Regioselectivity(%)=Wi/Wtotal
其中:Wi表示目的酰化产物的峰面积,Wtotal表示所有酰化产物的峰面积之和。
1.3.3 高效液相色谱(HPLC)分析
仪器:Waters高效液相色谱仪:配备PDA紫外检测器;检测波长为254 nm;色谱柱:4.6×250 mm,5 μm Zorbax SB-C18 分析型色谱柱。
流动相:63%甲醇-水溶液(含0.1%冰醋酸);流速:0.5 mL/min;柱温:30 ℃;进样量:20 µL。
1.3.4 产物的分离纯化与结构鉴定
利用薄层色谱(TLC)对产物进行分离纯化。首先,将含有机溶剂的反应混合物在 10000 r/min下离心,除去脂肪酶催化剂,取上层反应溶液,用旋转蒸发仪进行真空减压蒸馏,悬蒸2~3次,得到粗产物,溶解于一定量的甲醇中,完全溶解后,经15000 r/min离心后,取上清液。利用薄层色谱对产物进行分离纯化,首先在GF254 25×75 mm硅胶板上确定展开剂比例,再在GF254 100×200 mm的制备板上点样,每次点样1 µL,重复点样3~5次。薄层层析结束后,用紫外灯(254 nm)观察底物和产物条带,收集含有产物的硅胶颗粒,用甲醇溶解,溶液离心后,取上清液。最后,真空干燥24 h得到葛根素酯。
葛根素和丙酸乙烯酯的反应产物,用氯仿/甲醇/水=8/2/0.3(V/V/V)作为层析液。产物经过分离纯化,并通过HPLC进行纯度鉴定后,用超高分辨飞行时间质谱(TOF-MS)、傅里叶红外光谱(FT-IR)进行结构分析。
FT-IR检测:称取1~2 mg经过TLC纯化的葛根素酯产物,与200 mg左右的溴化钾研磨均匀,置于模具中,用压片机将样品压成透明薄片,将产物样品放到样品架上,置于红外光谱仪上分析,以葛根素为对照组。
1.3.5 反应介质对酶催化葛根素酯合成反应的影响
在多个5 mL带塞三角瓶中分别加入1 mL二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、乙腈(acetonitrile)、甲醇(methanol)、2-甲基四氢呋喃(2-Me THF)、四氢呋喃(THF)、叔丁醇(tert-Butanol)、异丙醇(isopropanol)、石油醚(petroleum)和异辛烷(isooctane),再依次加入 20 mmol/L 葛根素、600 mmol/L丙酸乙烯酯(VP),混合均匀。加入40 mg/mL Novozym 435催化剂后,在恒温气浴培养箱中振荡反应(40 ℃,200 r/min)。定时取样 100 μL,12,000 r/min离心5 min后,取20 μL上清液,用63%甲醇-水溶液稀释50倍,HPLC进样20 μL,进行检测与分析。
1.3.6 反应时间对酶催化葛根素酰化反应的影响
在5 mL带塞三角瓶中加入1 mL四氢呋喃、20 mmol/L葛根素、600 mmol/L丙酸乙烯酯(VP)和2 mg/mL Novozym 435催化剂混合均匀,在恒温气浴培养箱中振荡反应(40 ℃、200 r/min)。定时取样 100 µL,12000 r/min 离心 5 min 后,取 20 µL 上清液,用 63%甲醇-水溶液稀释50倍,液相色谱自动进样器进样20 µL,供分析。
1.3.7 水分含量对酶催化葛根素酯合成反应的影响
在5 mL带塞三角瓶中加入1 mL四氢呋喃、20
mmol/L葛根素、600 mmol/L丙酸乙烯酯,混合均匀;再分别添加 0 μL/mL、10 μL/mL、20 μL/mL、30 μL/mL、50 μL/mL;加入 2 mg/mL Novozym 435 催化剂开始反应,置于气浴恒温摇床上振荡(40 ℃,180 r/min)。定时取样,12000 r/min 离心 5 min 后取 20 μL 上清液,用63%甲醇-水溶液稀释50倍,HPLC进样20 μL,进行检测与分析。
1.3.8 底物摩尔比对酶催化葛根素酯合成反应的影响
在5 mL带塞三角瓶中加入1 mL四氢呋喃、20 mmol/L葛根素,分别加入100 mmol/L、200 mmol/L、300 mmol/L、400 mmol/L、500 mmol/L、600 mmol/L、700 mmol/L、800 mmol/L 丙酸乙烯酯(VP),混合均匀。加入 2 mg/mL Novozym 435 催化剂后,开始反应,在恒温气浴培养箱中振荡反应(40 ℃,200 r/min)。定时取样 100 μL,12000 r/min 离心 5 min 后,取 20 μL上清液,用63%甲醇-水溶液稀释50倍,HPLC进样20 μL,进行检测与分析。
1.3.9 数据分析
用Excel软件对数据进行统计、分析,所有数据取三次重复的平均值;用Origin 8.0软件对数据进行拟合以及图形化处理。
2 结果与讨论
2.1 不同脂肪酶催化葛根素酯合成反应
为了筛选到能高效催化葛根素酰化反应的酶生物催化剂,以有机溶剂为反应介质,研究了3种固定化脂肪酶、3种游离脂肪酶、1种肽酶和1种胃蛋白酶在该酰化反应中的催化效果。值得一提的是,从表1看,并非所有酶制剂都能高效催化葛根素的酰化反应。这主要是因为它们是不同来源具有底物[9,10]不同的识别特征的生物催化剂。

表1 不同酶催化葛根素丙酰化的反应aTable 1 Acylation of puerarin with VP catalyzed by different lipasea
酶制剂是酶经过提纯、加工后的具有催化功能的生物制品,一般具有较高的底物选择性,该特性与酶结构、种类及其来源密切相关。表2表明,不同来源的酶对葛根素丙酰化反应呈现出不同的催化活力。对葛根素丙酰化反应来说,不同来源的脂肪酶均具有良好的催化活性。其中,采用固定化脂肪酶 LipozymeIMTL、LipozymeIMRM时,反应转化率达到98%以上,初始速度分别为 19.64 mmol/L 和 24.56 mmol/L;Novozym 435也可以高效催化葛根素丙酰化反应,转化率和初始速度分别为99.8%和25.0 mmol/L。采用2种游离脂肪酶的做催化剂时反应转化率不高;其中采用猪胰脂肪酶时转化率为67%,与固定化脂肪酶相比,催化效果不理想;肽酶和胃蛋白酶在非水相酶催化葛根素丙酰化反应中没有表现出催化活性。
2.2 酶催化葛根素酯合成反应的高校液相色谱分析

图1 Novozym 435催化葛根素酰化反应前(a)后(b)色谱图Fig.1 Chromatograms of samples before (a) and after (b)acylation of puerarin catalyzed by Novozym 435
在本研究中,我们用 4.6×250 mm(5 μm)Zorbax SB-C18 分析型色谱柱(Agilent Technolgies Co, Ltd, USA),63%甲醇-水(水中含 0.1%乙酸),流速 0.5 min/mL,获得了良好的底物和产物分离效果。在254 nm下可检测葛根素及酯。如图1所示,为葛根素反应前后液相色谱图,其中峰1为葛根素保留时间分别是11.6 min,反应后在15.9 min位置出现了明显的产物峰2,反应后在20.9 min位置出现了明显的产物峰3,从图中很明显可以看出葛根素单酯的色谱峰比较高,选择性为98%。经过薄层层析等分离纯化过程,该产物被纯化出来进行了进一步的结构鉴定。
2.3 酶催化葛根素酯合成反应的质谱和红外光谱分析

图2 葛根素单酯(a)和葛根素双酯(b)的高分辨率质谱图Fig.2 The mass spectrogram of PME (a) and PDE (b)
质谱法是利用电场和磁场将运动的离子按它们的质荷比分离后进行检测的方法,测出离子准确质量即可确定离子的化合物组成。图2是葛根素单酯(a)和葛根素双酯(b)的高分辨率质谱图。从图中分析结构显示,能检测到与葛根素单酯(C24H24NaO10,495.13m/z[M+Na]+)和葛根素双酯(C27H28NaO11,551.15m/z[M+Na]+)的相对分子量。根据物质对不同波长的红外辐射的吸收特性,进行分子结构和化学组分分析,所以利用FT-IR能有效鉴定出官能团或化学键的存在或变化。图3是葛根素(a)和葛根素酯(b)的傅里叶红外光谱图。相较于图3 a,在图3 b中1718 cm-1和2900 cm-1处出现了新的羰基伸缩振动吸收峰,分别为C=O特征峰(酯的典型吸收峰)和C-H特征峰,由此确定在葛根素结构中加入丙酸酯基。
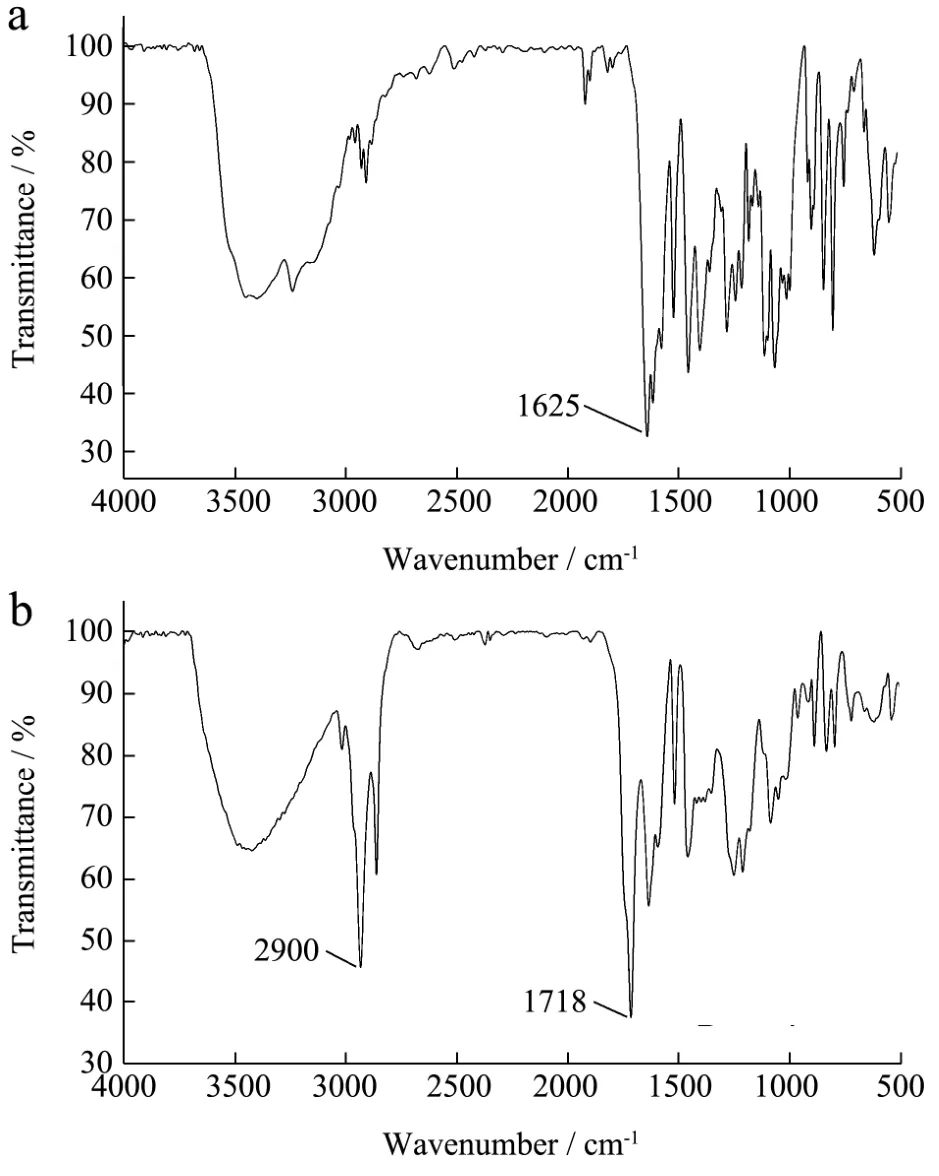
图3 葛根素(a)及其酯(b)的傅里叶红外光谱图Fig.3 The FT-IR graph of Puerarin (a) and its esters (b)
2.4 反应介质对酶催化葛根素酯合成反应的影响
有机溶剂体系是影响黄酮类化合物合成的一个重要因素,它通过改变酶的活性和稳定性,影响反应的初始速率和转化率[11]。同样,脂肪酶催化剂也显示溶剂依赖性和细胞活性在不同有机溶剂体系变化较大[12,13]。因此,我们对不同有机溶剂系统对Novozym 435催化剂葛根素酰化催化活性的影响进行了研究。
在前期实验中,我们发现强极性有机溶剂能较好地溶解葛根素,但据报道,强极性有机溶剂会夺取酶活性中心的必需水,使之失去活力[14,15]。正如我们所预期的那样(如表2所示),在强极性有机试剂DMSO和DMF中,葛根素有很高的溶解度,但Novozym 435在催化葛根素丙酰化反应中,并没有表现出催化活性;在一般极性的异丙醇、叔戊醇有机溶剂体系中,Novozym 435催化剂表现出很低的催化活性,在反应24 h时,转化率分别仅为10.3%和8.7%。除了强极性有机溶剂对酶活性的影响,也可能与溶剂溶解底物的能力有关,也就是说底物分子葛根素很难离开反应介质进入酶的活性部位,从而导致转化率低[16]。因此,在DMSO和DMF反应介质完全失去了Novozym 435催化剂的活性,而在异丙醇、叔丁醇反应介质中保持一点催化活力。
Novozym 435在催化葛根素丙酰化反应中,在有机溶剂THF和2-Me THF表现出很高的催化活性,转化率分别为98.7%和97.5%,又因为葛根素在THF溶剂中比2-Me THF溶剂有较好的溶解度,Novozym 435催化葛根素酰化反应中,选择有机试剂THF为最优的试剂。
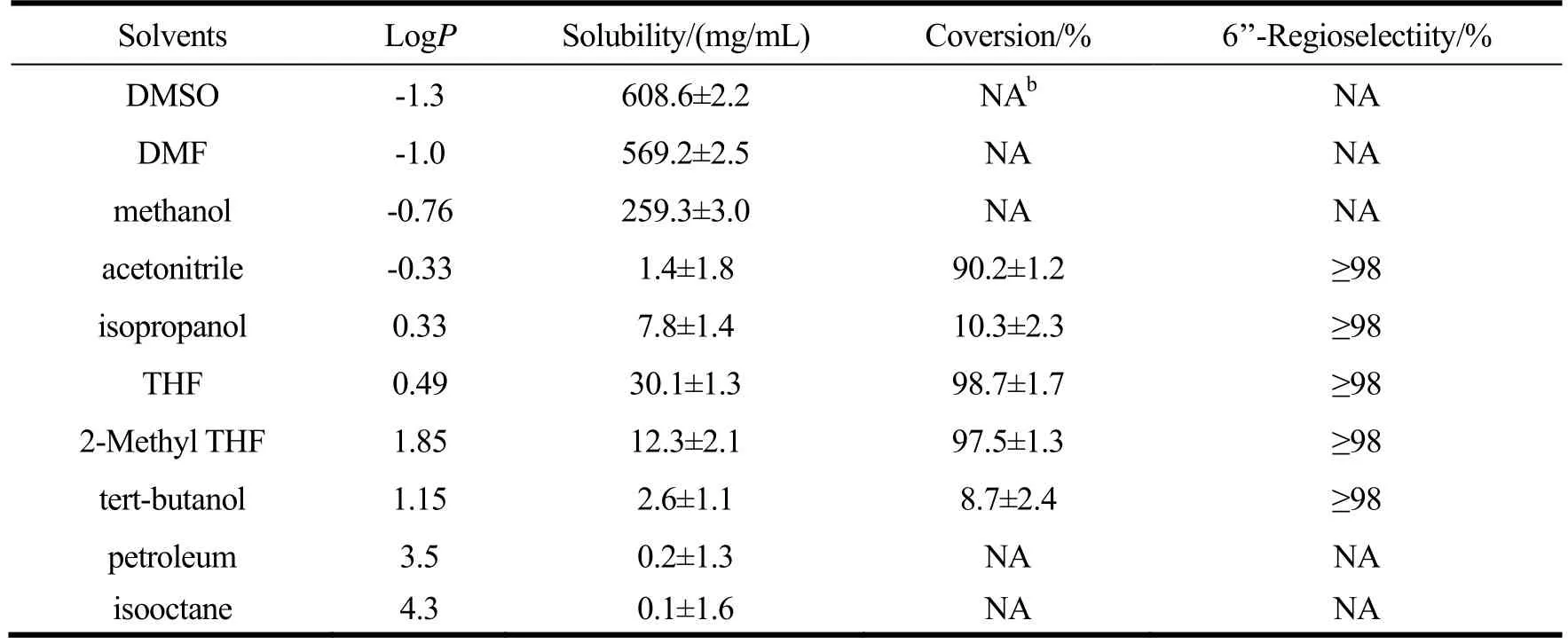
表2 不同有机溶剂对Novozyme 435催化葛根素酰化反应影响aTable 2 Effect of pure organic solvents on acylation of puerarin catalyzed by Novozyme. 435 lipasea
2.5 反应时间对酶催化葛根素酰化反应的影响
从图4可以看出,转化率随反应时间的增加而增加。在反应0~3 h时间内,酶促反应转化率急剧上升,这是由于反应初始阶段葛根素与丙酸乙烯酯浓度较高且产物浓度较低,反应向正向进行;反应3~6 h时间内,酶促反应速度不断下降底物转化率逐渐趋缓;在反应6 h左右,转化率达到98%,然后通过进一步延长反应时间,反应转化率几乎没有改变,反应基本达到平衡状态。因此,通过Novozym 435催化葛根素酰化反应达到热力学平衡状态时,反应时间为6 h,值得一提的是,在这项研究中,Novozym 435催化葛根素丙酰化反应中获得的转化率高于以往的研究报道。我们可以得出结论,Novozym 435催化剂能高效催化葛根素丙酰化反应。

图4 反应时间对Novozym 435催化葛根素酰化反应的影响Fig.4 Effect of time on acylation of puerarin by Novozyme. 435
2.6 水分含量对酶催化葛根素酯合成反应的影响

图5 水分含量对Novozym 435催化葛根素酯合成反应的影响Fig.5 Effect of water content on acylation of puerarin by Novozyme. 435
很多研究认为酶分子需要一定的水分来保持酶的活性与反应的进行,但是高水分会使酶分子结合导致反应速率的大幅度下降[17],所以说,酶分子水分含量需要保持在一个很窄的范围内。一般研究水分对反应的影响有两种方法,一是研究水分活度aw来确定最佳水分用量[18,19],二是溶剂中添加的水分的含量,这种方法操作方便,特别是适用于工业应用,便于操作[19,20];本研究中也采用水分体积含量考察水对脂肪酶催化葛根素丙酰化反应的影响。从图5中可以看出反应初速度与转化率都是随着水分含量的增加呈现递减的;但是区域选择性没有发生较大变化。对于该催化反应体系来说,水分的存在反而会降低酶的活性,水分含量为0,Novozym 435催化葛根素酰化反应的催化效率最高。
2.7 底物摩尔比对酶催化葛根素酯合成反应的影响
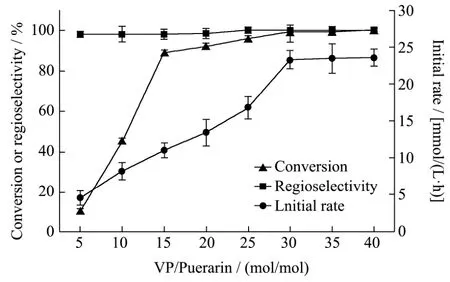
图6 底物摩尔比对Novozym 435催化葛根素酯合成反应的影响Fig.6 Effect of molar ration of substrate on acylation of puerarin by Novozyme. 435
转酯反应是一个可逆反应,即葛根素的转酯合成与酯的水解会同时发生。当一种反应底物过量时,有利于热力学平衡向酯合成方向进行。本研究考察了丙酸乙烯酯与葛根素的摩尔比对Novozym 435催化葛根素丙酰化反应的影响(图 6)。VP/葛根素的摩尔比从5增加到30(mol/mol),反应速率和反应转化率显著提高,区域选择性变化不大。VP/葛根素的摩尔比从30增加到40(mol/mol),反应速率和反应转化率几乎没有变化,区域选择性变化不大。因此,综合考虑转化率和底物摩尔比之间的关系,我们选择 30:1(VP:葛根素(mol/mol))作为该反应的最佳底物摩尔比,此时葛根素的酰化反应的转化率为99.5%,初始速度22.1 mmol/(L·h)。
3 结论
本研究从8种不同种类的水解酶中筛选可以高效催化葛根素丙酰化反应的酶,成功筛选到3种脂肪酶能高效催化非水相葛根素丙酰化反应,并以脂肪酶Novozym 435催化葛根素丙酰化反应为模型,研究了反应时间、有机溶剂种类、水分含量、底物摩尔比等对该模型的影响规律。研究结果表明:选择以四氢呋喃为反应溶剂,2 mg/mL Novozym 435脂肪酶,底物:酰基供体之比为1:30,转速200 r/min,水分含量为0的反应条件下,反应6 h,底物转化率达到99.5%。反应产物经分离纯化后进行了结构鉴定,高效液相色谱、质谱、傅里叶红外光谱结果表明,非水相酶催化葛根素酰化反应,所得产物酯为葛根素丙单酯,区域选择性达98%。Novozym 435可以快速、高效催化葛根素丙酰化反应,本研究工作将为脂肪酶Novozym 435为代表的生物催化剂在黄酮类化合物中的酰化修饰反应提供理论依据。
