离子强度和pH值对胶原纤维膜性能的影响
2018-09-08马云昊程珊滕安国张凯王稳航
马云昊,程珊,滕安国,张凯,王稳航,2
(1.天津科技大学新农村发展研究院,天津 300457)(2.天津科技大学食品工程与生物技术学院,天津 300457)
胶原是细胞外基质中含量最多、分布最广且既有公共特点又有差异的一组结构蛋白质,在结缔组织中起到支撑和保护机体的作用[1]。胶原分子为细棒状,在显微镜下观察胶原由原胶原按照规则平行排列成束,形成胶原微纤维,并进一步聚集成束组成粗细不等的胶原纤维[2]。
胶原蛋白分子由于天然紧密的分子排列以及高的 长径比(约 200)而具有高弹性模量和强柔韧度,从而使胶原蛋白成为制备既有优良的机械强度又有足够延展性的生物材料的重要原料[3]。凭借着其优良的成膜特性,胶原纤维既能用作人工皮肤等医用膜,也能够作为可食食品包装膜,如可广泛应用于肉制品、油炸食品、烟熏食品、酸奶及食品配料等食品包装上[4]。其中,邵东旭等利用鱼鳞提取的胶原蛋白制备了复合抗菌膜并研究了其保鲜性能[5];加拿大的Barbut[6,7]研究团队对胶原蛋白肠衣的性能进行了全面评价;巴西研究人员以胶原纤维和胶原粉为原料成功制备了胶原蛋白膜并评价了其性能[8];德国的Oechsle[9]等人率先研究了胶原纤维的酸溶胀机制,以及胶原与其它蛋白的相互作用。
就理化性质而言,胶原蛋白为聚两性电解质[10]。在等电点时,胶原蛋白分子间疏水相互作用增大,其黏度、溶解度、电导率及膨胀作用都达到最低值;当溶液pH偏离等电点时,蛋白质分子上的正电荷或者负电荷基团将增多,这使胶原蛋白间发生相互排斥从而增大胶原蛋白的溶解度[11]。对于不溶性的胶原纤维,其表现为酸碱膨胀现象,实质为胶原肽链间的氢键、离子键以及共价键在酸碱的作用下发生破坏,使胶原结构疏松。pH和离子强度不同带来的溶解度以及膨胀性能的变化可能会引起膜性能改变,从而给胶原纤维膜的实际应用带来影响。这些因素具体的影响效果与相关机制,以及如何利用或避免这些外界条件的影响,需要进行深入研究。
本文以牛二层皮来源的胶原纤维为成膜基料,通过配制不同pH和离子强度的胶原纤维成膜液,探讨pH值和离子强度对胶原纤维膜性能的影响,同时本文也对干膜湿膜的机械性能进行比较,以期为胶原蛋白膜的性能改善以及其应用(如生产胶原蛋白肠衣)提供参考。
1 材料与方法
1.1 材料与试剂
牛二层皮(置于浓度为 10 wt%的碱石灰中浸泡30 d)购于山东省淄博龙宝生物有限公司;氯化钠、盐酸(均为分析纯),天津市江天化工技术有限公司;NaH2PO4·2H2O(分析纯),天津市化学试剂三厂。
1.2 仪器与设备
测厚仪(CH-1-ST),上海六菱仪器厂;紫外可见分光光度计(SP-2102),上海光谱仪器有限公司;质构仪(TA.XT. Plus),Stable Micro System,UK;扫描电子显微镜(SU 1510),Hitachi,Japan;酸度计(PH-3CW),上海理达仪器厂。
1.3 实验方法
1.3.1 牛皮胶原纤维的提取及其悬浮液的制备
牛皮为经碱石灰处理后的二层皮,pH值为12。将买回来的整张牛皮剪成10 cm×10 cm小块,在蒸馏水中浸泡,每隔2 h换一次水,浸泡至pH为中性,然后取出沥干浸没在 0.01 mol/L的盐酸中,牛皮:盐酸=1:3(m/V),于 20 ℃下进行充分酸溶胀 24 h。溶胀后的牛皮用镊子轻轻刮取其胶原纤维,然后测定胶原纤维的水分含量为94%,即刮取的胶原纤维干物质含量为 6%。将刮取的胶原纤维用研钵磨碎,均匀的分散在蒸馏水中,配置成1 wt%的胶原纤维悬浮液,再用打浆机将悬浮液剪切混匀,形成均匀的1 wt%悬浮液,然后利用盐酸调节悬浮液的pH为2,并于4 ℃冰箱中储存,以备后期使用。
1.3.2 不同pH的胶原纤维膜的制备
将配制好的1 wt%的胶原纤维成膜液倒入聚四氯乙烯(PFTE)平板(15 cm×15 cm)进行铺膜,随后将平板置于盛有浓度为0.1 M 的NH3·H2O的密封箱中,利用 NH3·H2O 的挥发性调节胶原纤维成膜液的pH值,分别得到pH为2、3、5、7、11的成膜液。随后将不同pH值的成膜液置于35 ℃鼓风干燥箱中干燥8 h,后将烘干后的膜从PFTE板中慢慢揭下,在相对湿度为50±1%的干燥箱中放置7 d后再进行膜的性能检测。
1.3.3 不同离子强度的胶原纤维膜的制备
将1 wt%胶原纤维悬浮液搅拌5 min后,倒入平板中进行铺膜,置于35 ℃鼓风干燥箱中烘干8 h,将样品膜从平板上慢慢揭下,随后将干膜完全浸泡到浓度分别为0.1,0.2,0.3 mol/L的NaCl溶液中,10 min后将膜轻轻取出,烘干后检测干膜的性能。用 NaCl处理后的干膜于室温下在蒸馏水中浸泡20 min后,再进行湿膜性能的检测。
1.3.4 膜性能的测定
1.3.4.1 膜厚度
选取膜上的4个边缘处和中心点处,利用测厚仪测量膜厚,测厚仪的灵敏度为0.003 mm,测量范围为0~1 mm。测量三次,选取平均值作为膜的厚度值。
1.3.4.2 机械性能
使用质构仪检测复合膜的拉伸强度(TS)和断裂延伸率(E%)。实验步骤参照了ASTM D-882[12]的方法,将膜裁剪成6.0 cm×2.5 cm的矩形条状,测试参数为:探头:A/TG;测试速度:1 mm/s;初始夹距为30 mm。每组重复三次。计算公式如下:

式中:F-膜断裂时承受的最大拉力,N;S-膜的横截面积,mm2;TS-拉伸强度,MPa。
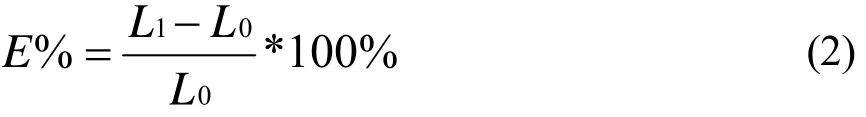
式中:E-膜的断裂延伸率,%;L1-膜断裂时受力部分的长度,mm;L0-膜的原长,mm。
1.3.4.3 微观结构
利用电子扫描电镜(SEM)观察复合膜的表面和断面结构,实验方法参照Chen Ye[13]并稍作修改。加速电压为15 kV。观察膜的横截面时,样品膜置于液氮中进行脆断,裁剪成0.5 cm×0.5 cm小块,粘贴在导电胶带上。所有样品膜进行喷金后在电镜下观察其微观结构。
1.3.4.4 膨胀动力学性能
根据 Wang等人[3]的方法检测膜的膨胀性能,计算样品膜在室温下于蒸馏水中浸泡1/12、1/2、1、2、3、6 h 前后膜的质量。样品膜裁剪为 5 cm×2 cm,并称其重量为 Mw,随后浸于蒸馏水中,然后利用滤纸将膜表面擦干,立即称其重量为M0。每组样品重复三次。样品膜的平衡溶胀率(ESR)计算公式如下:

式中:ESR-平衡溶胀率,%;Mw-浸泡前膜重量,g;Mo-浸泡后膜重量,g。
1.3.5 统计分析
2 结果与分析
2.1 厚度的测定
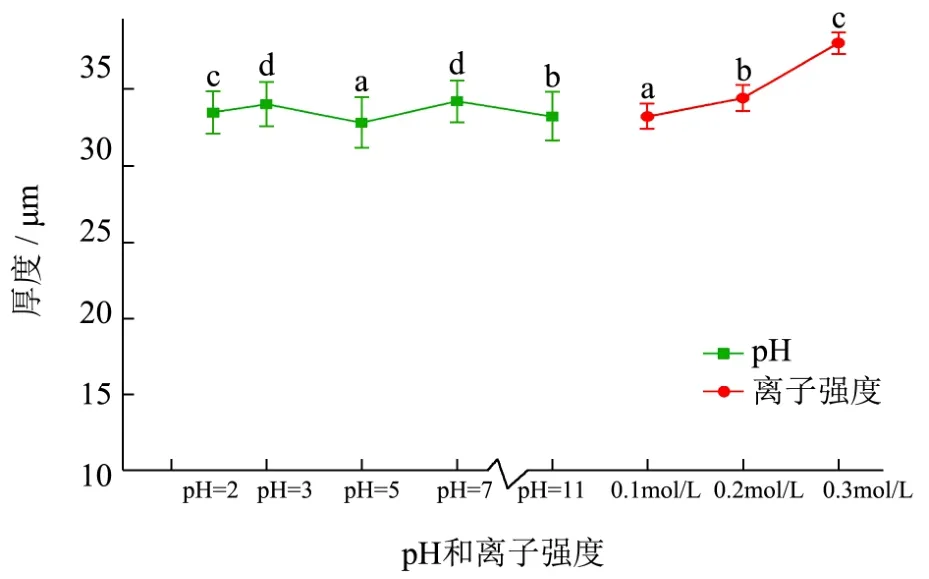
图1 不同pH和离子强度下胶原纤维膜的厚度Fig.1 Thickness of collagen fiber film under various pH and ionic strength
从图1中可以看出,经不同pH处理后的胶原纤维膜的厚度没有明显变化(p>0.05),厚度值在32.8±1.69~34.2±1.39 μm之间。当pH=2 时,胶原纤维膜的厚度达到最大值33.4±1.37 μm。同时,随着离子强度的增加(0.1~0.3 mol/L),膜的厚度显著增加,最高值为38.0±0.71 μm,这主要是因为盐浓度过高会引起盐效应作用,部分盐离子在膜表面,致使电解质对胶原纤维-胶原纤维间产生了电荷屏蔽作用,从而扰乱了胶原纤维之间的有序性[14],从而使膜表面的粗糙度增加,影响膜厚度。
2.2 机械性能
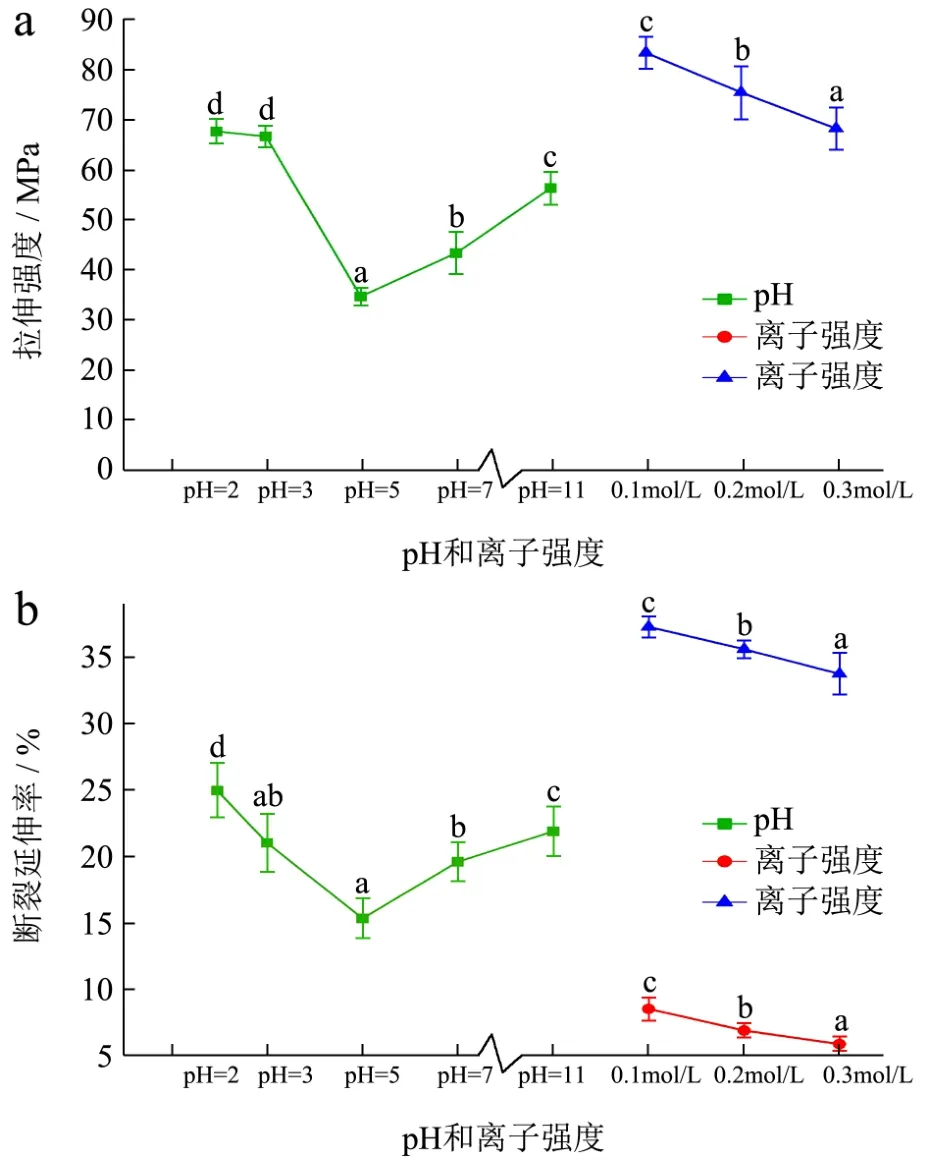
图2 不同pH和离子强度胶原纤维膜的拉伸强度和断裂延伸率Fig.2 Tensile strength and elongation at break of collagen fiber film under various pH and ionic strength
从图2中(a)可以看出,当pH值为2~3时,胶原纤维膜的拉伸强度没有显著变化,当pH为3~5时膜的拉伸强度显著降低(p<0.05),最低达到15.43±1.47 MPa;此后随着pH值的增加,拉伸强度显著性增加。值得注意的是,当pH=2时,胶原纤维的拉伸强度达到最大,但是我们并没有选取更低pH成膜液进行测定,这是因为当pH小于2时,胶原纤维极易降解,所成膜的稳定性得不到保障,这对于实际应用与科学研究的意义不大。此外,随着离子强度增加,胶原纤维干膜和湿膜的拉伸强度均显著降低(p<0.05):当盐浓度为 0.1 mol/L时,膜的拉伸强度达到最大为83.40±3.11 MPa,随着离子强度的增加二者均显著性下降。同时,由图(b)可知,pH对胶原纤维膜断裂延伸率的影响和其对拉伸强度的影响趋势相似,而随着离子强度的增加干膜和湿膜断裂延伸率均显著性降低。此外,从图2可以看出,胶原纤维干膜经蒸馏水浸泡20 min后,得到湿膜的拉伸强度与断裂延伸率显著性增加(p<0.05)。
这种现象可以解释为:(1)pH影响蛋白质的结构及分子间相互作用。从牛皮中提取的胶原纤维的等电点约为5.0~7.5[15],当胶原纤维处于等电点时,整个分子为电中性,其分子结构呈现卷曲状态,纤维之间作用力减少,此时胶原纤维膜的拉伸强度和断裂延伸率较低;当pH高于或低于等电点时,因胶原纤维之间的静电斥力,使分子伸展,内部基团暴露,增加分子之间交联度,促进胶原纤维膜网络结构的形成,致使拉伸强度和断裂延伸率增加。
(2)电解质的加入增强了胶原之间的静电斥力,分子链中的基团暴露,增强了胶原纤维之间的交联作用。此外,胶原基团还会与中性盐离子结合形成离子键,增强了分子间的作用力[16];而盐离子浓度过高,盐效应起主要作用,电解质对胶原纤维产生屏蔽作用,使纤维间的作用力降低。(3)经蒸馏水浸泡后,胶原纤维自身含有亲水性基团(如-COOH)与水分子的作用增强,破坏了纤维与纤维之间的氢键,导致胶原纤维分子间的作用力减弱,相互之间的交联作用降低,致使湿膜与干膜相比,断裂延伸率与拉伸强度均降低。
2.3 微观结构

图3 胶原纤维膜表面和横断面的SEM图Fig.3 SEM images of surface and cross section of collagen fibers film under different pH and ionic strength
如图3所示,纯胶原纤维膜和pH=2时的胶原纤维膜表面相对光滑,质地均一,这主要是由于胶原纤维处于等电点时,纤维呈现出卷曲状态,而偏离等电点时,由于静电斥力的作用使纤维之间交联作用增强,分子之间交织排列整齐有序。a~c和d~f显示了不同钠离子强度对胶原纤维膜的表面和相应横断面微观结构的影响。从图a~c中可以看出,随着钠离子强度增加,膜表面的粗糙度显著增加。当离子强度为 0.1 mol/L时,膜的表面(a)光滑,对应的横截面(d)比较致密,胶原纤维之间相互交织排列有序;而后随着盐离子浓度的增加,膜表面出现凸起的纤维丝,导致表面粗糙度增加;当离子强度为0.3 mol/L时,膜表面出现了盐析现象,这主要是因为盐离子浓度过高(≥0.2 mol/L)时,电解质对胶原纤维产生了电荷屏蔽作用,导致纤维与纤维之间的静电斥力减弱,纤维之间的相互作用力降低,从而影响了纤维的稳定性,纤维之间形成杂乱无序的结构(如图f)。这也充分说明了当离子强度过高时纤维间内部结构的稳定性被破坏,此结果也与机械强度的测定结果一致。
2.4 膨胀动力学性能

图4 离子强度对胶原纤维膜的膨胀动力学性能的影响Fig.4 Influence of ionic strength on the swelling kinetics properties of collagen films
为了进一步研究盐浓度和成膜液的pH对胶原纤维膜的性能的影响,分析了不同离子强度与不同 pH下生成的胶原纤维膜在蒸馏水中浸泡不同时间(5、30、60、120、180和360 min)前后的质量比,计算出胶原纤维膜的平衡溶胀率(ESR)。如图4、图5所示,所有的膜在蒸馏水中浸泡30 min内快速吸水,膜的平衡溶胀率显著性增加,此后吸水能力增加缓慢,直到360 min后溶胀率达到平衡。
从图4可以看出,随离子强度的升高,膜的膨胀性能逐渐升高;由图5可以看出,当成膜液的pH在胶原纤维等电点附近时,胶原纤维的膨胀性较小,而随着偏离等电点,胶原纤维的膨胀性逐渐升高。实际上,膜在水溶液中的膨胀性能主要依靠其分子内部的亲水基团和膜的有效交联度[3]。当处于等电点时,胶原纤维之间分子间作用力较大,有相互聚集的趋势,所以此时膜的膨胀率相对较低;此外,在盐溶液中胶原肽链间的离子键被打开,从而吸水膨胀,致使胶原纤维与水分子间的作用力增大,导致胶原纤维间的分子作用力减少,膜的机械性能也会因此降低。这些结果与机械性能测定的结果一致。

图5 成膜液pH对胶原纤维膜的膨胀动力学性能的影响Fig.5 Influence of the pH of the film forming solution on the swelling kinetics properties of collagen films
3 结论
本文研究了pH和离子强度对胶原纤维膜性能影响。研究表明,在酸性及低离子强度条件下胶原纤维膜展现出较好机械性能。pH对胶原纤维膜厚度没有显著影响,当pH值偏离等电点越远,膜的机械性能越高,微观结构显示等电点时膜表面光滑,高于或低于等电点时膜比较粗糙。随着离子强度增加,膜的厚度显著性增加,且无论干膜还是湿膜,膜机械性能均随着离子强度增加而显著降低,与干膜相比,所有湿膜的拉伸强度均发生巨大降低,而断裂延伸率却大幅度增加;此外,膨胀性能随离子强度及成膜液偏离等电点程度增加而增加。综上所述,适当低成膜液离子强度以及低pH有利胶原纤维膜性能增强,这于胶原纤维膜在食品可食性包装等方面的应用具有指导作用。
