宣威火腿加工过程中的蛋白质降解规律
2018-09-08周洋刘姝韵谷大海徐志强王桂瑛王雪峰范江平普岳红朱仁俊廖国周
周洋,刘姝韵,谷大海,徐志强,王桂瑛,王雪峰,范江平,普岳红,朱仁俊,廖国周
(1.云南农业大学食品科学技术学院,云南昆明 650201)(2.云南农业大学云南省畜产品加工工程技术研究中心,云南昆明 650201)
宣威火腿是云南省传统名特优产品,2001年获得国家原产地域保护,与浙江金华火腿、江苏如皋火腿并称“华夏三大名腿”,名扬海内外,它是由在原产地域内饲养的含有乌金猪血统的鲜猪后腿在原产地域经过修割定形、腌制、堆码翻压、洗晒整形、上挂风干、发酵制作而成[1]。火腿在漫长的加工与腌制期间其肌肉蛋白和脂肪会发生一系列复杂的变化与反应,而蛋 白质降解是火腿加工过程中重要的生化反应,蛋白质的降解程度会影响火腿的质构,产生的分解产物如肽类、氨基酸、有机酸和胺等物质对火腿风味物质的形成有重要贡献,而蛋白质的降解程度会受工艺过程中温湿度条件和产品中盐分、水分的影响[2]。
蛋白质组学始于20世纪70年代由意大利科学家O’Farrell建立起的双向凝胶电泳技术(two-dimensional gel electrophoresis,2-DE)的发展[3~6]。双向凝胶电泳是蛋白质组学研究的一个经典技术手段,它是一种将等电聚焦电泳与十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)相结合,将蛋白质按照等电点和分子量大小有效分离且分辨率更高的蛋白质电泳检测技术,该技术在研究蛋白的理化性质如等电点和分子量、蛋白的分离纯化、蛋白表达差异的查找、与质谱相结合的手段进行特定蛋白的鉴定等方面具有良好的效果[7]。近年来,蛋白质组学技术不断发展,应用该技术研究干腌火腿蛋白降解情况可以更加灵敏与准确地分析火腿中较为复杂的蛋白质混合物[8,9]。目前对宣威火腿蛋白质组学的研究鲜有报道,廖国周等[10]已成功建立双向电泳分析宣威火腿蛋白质组的方法,本研究在此基础上继续针对宣威火腿加工过程肌肉蛋白质的降解进行深入研究,旨在进一步阐明宣威火腿加工过程肌肉蛋白质降解机理,指导生产实践,促进云南火腿产业的发展。
1 材料与方法
1.1 主要材料与试剂
宣威火腿按传统工艺于宣威市宣泰火腿有限公司进行生产加工,经过选料、修整腿坯、腌制、洗腿、上挂风干、发酵等工序。从腌制前(24 h)、腌制结束(18 d)、风干结束(125 d)、成熟中期(250 d)、成熟结束(360 d)5个阶段取样,取样部位为股二头肌,每次选取5块样品真空包装于-20 ℃冷冻待分析。
胎牛血清标准品(BSA)、碳酸氢铵、N,N-亚甲基双丙烯酰胺、Triton X-100、Brij、DTT,美国 Sigma公司;苯甲基磺酰氟(PMSF)、三氯乙酸(TCA)、二硫苏糖醇(DTT)、丙烯酰胺、甘氨酸、低熔点琼脂糖、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(CHAPS)和三羟甲基氨基甲烷(Tris-base),美国Amresco公司;过硫酸铵(AP)、N,N,N’,N’-四甲基乙二胺(TEMED)、尿素、甘油与碘乙酰胺,美国Amersham公司;胰酶、三氟乙酸与十二烷基磺酸钠(SDS),美国 Promega公司;固相pH 梯度缓冲液(IPG Buffer,pH 3.0~10.0、pH 4.0~7.0)及矿物油,美国 GE公司;考马斯亮蓝(G250)与溴酚蓝,美国Bio Basic;固相pH梯度干胶条(24 cm,pH 3.0~10.0、pH 4.0~7.0),美国Bio-Rad公司;甲醇与乙腈,美国Fisher公司;Z-Arg-Arg-AMc、Z-Phe-Arg-AMC和AMC,美国Bachem公司;其他试剂为分析纯。
1.2 仪器与设备
TGL-18R冷冻离心机、JY96-Ⅱn超声仪,珠海黑马医学仪器有限公司;765Pc紫外分光光度计,上海光谱仪器有限公司;Ettan IPGphor Ⅲ等电聚焦电泳仪、Ettan DALTsix二向SDS聚丙烯酰胺凝胶电泳仪,美国GE Heahhcare公司;超纯水系统,美国Millipore公司;Powerlook1100凝胶扫描仪,美国Umax公司;DZF-6020真空干燥机,上海一恒科学仪器有限公司;Autoflex speed™ MALDI-TOF/TOF 质谱仪,德国Bruker Dalton公司;F95S荧光分光光度计,杭州科晓化工仪器设备有限公司;IKA T18 basic Ultra Turrax,德国IKA公司。
1.3 方法
1.3.1~1.3.5均参照廖国周等[10]的方法进行。
1.3.1 蛋白质的提取及纯化
取1 g剪碎的宣威火腿肉样放入经预冷过的研钵中,用液氮研磨成粉,放入15 mL离心管,加入10倍体积-20 ℃预冷的10%TCA/丙酮溶液,涡旋30 s,-20 ℃沉降过夜,随后在4 ℃、12000 r/min离心20 min,弃上清液,沉淀物加预冷丙酮洗涤,在 4 ℃、12000 r/min离心15 min,重复2次,沉淀经真空干燥后,置于-20 ℃备用。
1.3.2 蛋白质含量测定
称取蛋白质干粉20 mg,加0.5 mL裂解液(含1 mmol/L PMSF,7 mol/L 尿素,2 mol/L 硫脲,4%CHAPs,0.02 mol/L Tris-bases),在 20 ℃~37 ℃的条件下超声裂解 30 min,将超声后的蛋白混合物于4 ℃,12000 r/min,离心 20 min,收集上清液。以蛋白质裂解液为空白,BAS标准蛋白为标准,通过Brafford法[9]测定蛋白质含量。
1.3.3 双向电泳
1.3.3.1 等电聚焦
等电聚焦电泳参照 IPGphor Ⅲ等电聚焦系统使用指南进行。根据标准曲线计算出1200 μg宣威火腿蛋白上样量体积为218.58 μL,与水化液(含7 mol/L尿素、2 mol/L硫脲、4%CHAPS、1%DTT、0.7%IPG缓冲液、0.002%溴酚蓝)充分混合后至上样总体积为460 μL。非线性 IPG 预制胶条 pH 值范围分别为3.0~10.0和4.0~7.0,IPG干胶条胶面朝下放入水化液,覆盖一层矿物油防止等电聚焦时尿素析出、蛋白氧化及产生冷凝水,置于Ettan IPGphor等电聚焦仪中,重泡胀和等电聚焦均在20 ℃进行,每根胶条限流50 μA。
1.3.3.2 胶条平衡
等电聚焦完毕后,胶条先在8 mL平衡缓冲液Ⅰ(含 0.05 mol/L Tris-HCl pH 8.8,6 mol/L 尿素,30%甘油,2%SDS,0.002%溴酚蓝,0.1 mol/L DTT)中平衡15 min,再在8 mL平衡缓冲液Ⅱ(以0.25 mol/L碘乙酰胺替换0.1 mol/L DTT,其余组分同平衡缓冲液Ⅰ)中平衡15 min。
1.3.3.3 SDS-聚丙烯酰胺凝胶电泳
将平衡后的IPG胶条转移至浓度12.5%的凝胶上端,使IPG胶条与凝胶上端紧密贴合,排尽气泡后,用0.8%低熔点琼脂糖封顶,待琼脂糖凝固后即可进行第二向SDS凝胶电泳。电泳参数设置:2 W/gel,运行45 min,然后17 W/gel,直至溴酚蓝指示线跑至胶底缘时电泳结束,约4.5 h。IPG胶条的最大电流为50 μA/gel,凝胶厚度为 1 mm。
1.3.4 染色与图像分析
电泳结束后剥离凝胶,置于考马斯亮蓝溶液中固定染色 pi。图像分析采用 imageMaster 2D platinum 5.0软件进行。
1.3.5 质谱样品制备与质谱分析
切下目的蛋白点,将胶块切成约1 mm3大小,用50%甲醇洗胶块脱掉考马斯亮蓝,并以100%乙腈覆盖胶块至白色,接着用0.1 mol/L NH4HCO3泡胀,然后反复用50%乙腈洗至无色,干燥后加入胰酶冰水孵育30 min,吸掉多余胰酶后加入覆盖液(含10%乙腈,0.05 mol/L NH4HCO3),37 ℃下酶切 12~16 h。酶切完的胶粒超声处理15 min,以60 μL抽提液(含90%乙腈,2.5%三氟乙酸)对胶粒进行脱水,吸出上清液并真空干燥,点样前加入1.5 μL重溶液(30%乙腈含0.1%三氟乙酸)溶解样品,点样后当液滴挥发到原体积的1/3左右时,加入0.5 μL基质在样品上,待完全干燥后即可分析。
制备的样品使用 Autoflex speed™ MALDI-TOF/ TOF质谱仪进行分析,激光波长355 nm,重复速率为200 Hz,加速电压为20 kV,最优质量分辨率为1500 u。扫描质量范围为700~3200 u,收集信号。胰酶自切峰为内标校正质谱仪。试验样品以默认模式获得肽质量指纹图谱。利用软件flex Analysis过滤基线峰、识别信号峰,以BioTools软件搜索NCBI数据库,寻找匹配的相关蛋白质,同时查询其功能,来明确鉴定的蛋白质为何种蛋白质。
1.3.6 肌肉组织蛋白酶活力测定
参考文献[11,12]的方法,肌肉组织蛋白酶B和L的提取:将肌肉样品于4 ℃下解冻,剔除可见脂肪和结缔组织,用绞肉机绞碎,称5 g(精确到0.001 g),加入35 mL提取缓冲液(50 mmol/L乙酸-乙酸钠缓冲液,pH 5.0,含 100 mmol/L 氯化钠,1 mmol/L EDTA 和 2 mL/L Triton X-100),在冰浴条件下用 Ultra Turrax 高速匀浆 3 次(2000~24000 r/min,每次 10 s,间隔 20 s),然后于 4 ℃条件下磁力搅拌 60 min,22000 g 离心 20 min,上清液经白色丝绸过滤,用提取缓冲液定容至50 mL,摇匀后即组织蛋白酶B和L提取液,用于组织蛋白酶B和L活力测定。
肌肉组织蛋白酶B和L潜在活力测定:取2.5 mL反应液(组织蛋白酶B活力测定反应液为:50 mmol/L磷酸二氢钠-磷酸氢二钠,pH 6.0,含 312.5 μmol/L Z-Arg-Arg-AMc,4 mmol/L EDTA,2 mmol/L DTT 和3.4 mL/L Brij;组织蛋白酶B+L活力测定反应液为:50 mmol/L 磷酸二氢钠-磷酸氢二钠,pH 6.0,含312.5 μmol/L Z-phe-Aig-AMC,4 mmol/L EDTA,2 mmol/L DTT 和 3.4 mL/L Brij),分别加入 0.5 mL 组织蛋白酶B和L提取液,于37 ℃培养20 min,反应结束时加入6 mL无水乙醇终止反应。产生的荧光强度用荧光分光光度计于激发波长380 nm和发射波长440 nm测定。同时,用 AMC取代 Z-Arg-Arg-AMC或Z-Phe-Arg-AMC配制的标准反应液代替酶活力测定反应液,按照上述反应过程和测定方法制备AMC浓度标准曲线,并根据标准曲线计算出各样品的酶活力。一个酶活力单位(U)定义为37 ℃条件下每分钟产生1 nmol AMC所需要的组织蛋白酶B或B+L的数量,测定结果表示为每克无盐无脂肪股二头肌干物质所含的组织蛋白酶B或B+L活力单位,即U/g。组织蛋白酶L活力由组织蛋白酶B+L活力减去组织蛋白酶B活力计算而得。
1.4 数据处理
试验数据采用SPSS 12.0软件进行统计分析,所有样品均做3次平行,采用方差分析,结果以Mean±SD表示。
2 结果与分析
2.1 宣威火腿加工过程肌肉蛋白质降解分析
2.1.1 宣威火腿蛋白质组的双向电泳图谱
本试验初始采用pH值3.0~10.0、24 cm非线性干胶条进行初步判断宣威火腿蛋白的分布情况,并利用考马斯亮蓝进行染色,得到宣威火腿蛋白双向电泳图谱。经图谱分析后确定宣威火腿蛋白大部分分布在pH值4.0~7.0之间,之后则以pH值4.0~7.0、24 cm的非线性干胶条对宣威火腿蛋白进行分离。图1~5分别为腌制前、腌制结束、风干结束、成熟中期与成熟结束阶段宣威火腿股二头肌的蛋白质双向电泳图谱,由图可见,电泳分离较充分,图像清晰可辨,拖带、条纹不明显,能满足进一步分析的需要。腌制前、腌制结束、风干结束、成熟中期与成熟结束这5个阶段的蛋白质斑点数分别为 1533±26,1523±18,1402±15,1196±21与1018±29个。图6表明了在加工过程中宣威火腿肌肉蛋白质存在明显的降解情况,其中成熟中期到成熟结束阶段肌肉蛋白质降解较为突出。

图1 腌制前(24 h左右)宣威火腿双向电泳图谱(pH值4.0~7.0非线性固相pH梯度胶条)Fig.1 The two dimensional electrophoresis map of Xuanwei ham in the pickling before (pH value of 4.0~7.0, non-line IPG strip)

图2 腌制结束(28 d)宣威火腿双向电泳图谱(pH值4.0~7.0非线性固相pH梯度胶条)Fig.2 The two dimensional electrophoresis map of the end of Xuanwei ham pickle (pH value of 4.0~7.0, non-line IPG strip)
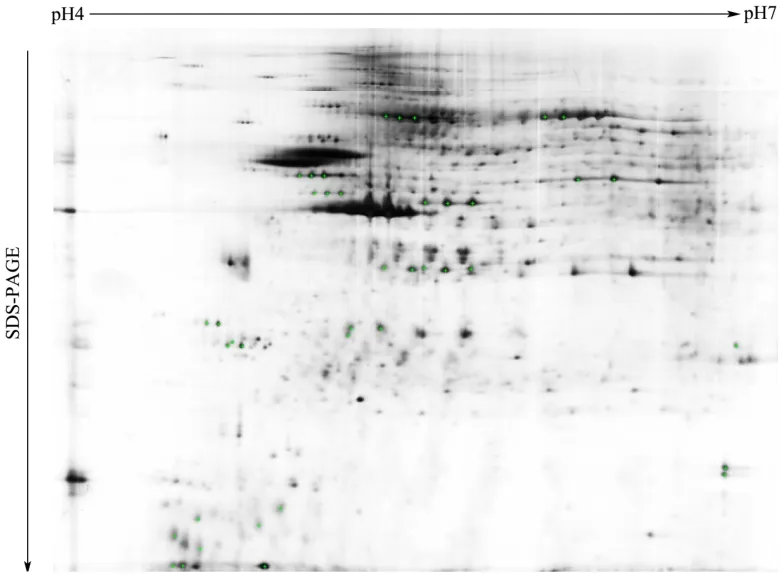
图3 风干结束(126 d)宣威火腿双向电泳图谱(pH值4.0~7.0非线性固相pH梯度胶条)Fig.3 The two dimensional electrophoresis map of the end of the ham air-dried (pH value of 4.0~7.0, non-line IPG strip)
2.1.2 宣威火腿加工过程差异蛋白质点鉴定
与腌制前对比,将成熟中期表达量降低的点编号为A组,升高的点编号为B组;将成熟结束表达量降低的点编号为C组,升高的点编号为D组。
经MALDI-TOF/TOF质谱分析及Mascot引擎检索,得到蛋白检索结果。由表1可知成熟中期阶段肌表达量下降主要肌钙蛋白T亚基、肌球蛋白轻链等22种蛋白质;相反地,12种肌动蛋白及肌球蛋白调节轻链以及肌球蛋白轻链在该阶段表达量升高。而宣威火腿在成熟结束阶段,除β-烯醇有降低情况并未检测其他蛋白质表达下降,血清白蛋白、ATP合成酶β亚基、肌球蛋白、α-晶状体蛋白B链则表达升高蛋白质。

图4 成熟中期(248 d)宣威火腿双向电泳图谱(pH值4.0~7.0非线性固相pH梯度胶条)Fig.4 The two dimensional electrophoresis map of the middle of the ham mature (pH value of 4.0~7.0, non-line IPG strip)

图5 成熟结束(365 d)宣威火腿双向电泳图谱(pH值4.0~7.0非线性固相pH梯度胶条)Fig.5 The two dimensional electrophoresis map of the end of the ham mature (pH value of 4.0~7.0, non-line IPG strip)

图6 宣威火腿加工过程蛋白质降解情况Fig.6 The degradation of muscle proteins during the processing of Xuanwei ham

表1 蛋白点检索结果Table 1 The retrieve results of protein spots
2.2 宣威火腿加工过程组织蛋白酶活性分析
宣威火腿不同加工阶段肌肉组织蛋白酶B和L的残余潜在活力测定结果见图7。组织蛋白酶B和L肌肉组织中重要的内肽酶,在加工结束时仍然存在一定的活性,对蛋白质降解和风味物质的产生有重要作用。其中由于组织蛋白酶B的影响,成熟中期肌球蛋白、原肌球蛋白、肌动蛋白均有下降,而肌钙蛋白T亚基收组织蛋白酶L的影响表达量有所下降。由图7可知,组织蛋白酶B的潜在活力在加工过程中逐渐下降,由腌制前的 12472.48 U/g下降到成熟结束的 2436.75 U/g,成熟中期下降速度较快,加工结束时残余活力为腌制前的10.25%。组织蛋白酶L的潜在活力也在加工过程中逐渐下降,但在风干结束时期有明显升高的趋势,之后则连续快速下降,加工结束时残余活力为腌制前的8.56%。在火腿腌制结束前,组织蛋白酶L的活力比组织蛋白酶B低,而在风干结束与成熟结束时两个工艺点的其残余活力也均高于组织蛋白酶B。

图7 宣威火腿加工过程组织蛋白酶B和L的潜在活力变化Fig.7 Change of potential activity of cathepsin B and L during the processing of Xuanwei ham
3 讨论
3.1 传统干腌火腿中的蛋白质变化会直接影响成品的品质,而蛋白质降解能够产生肽类、氨基酸等小分子呈味物质,还能作为火腿的风味前体物产生特殊的腌腊肉制品风味[13]。蛋白质降解程度主要受到工艺过程中温湿度条件和过程产品中盐分、水分的影响。本研究腌制前、腌制结束、风干结束、成熟中期与成熟结束这 5个阶段的蛋白质斑点数分别为 1533±26、1523±18、1402±15、1196±21 与 1018±29 个,说明宣威火腿在加工过程中存在明显的蛋白质降解情况。国外学者[14,15]通过SDS-PAGE电泳方法对serrano火腿和Bayonne火腿进行了相关研究,发现火腿的水溶性蛋白和肌原纤维蛋白的水解程度随加工过程在加剧;Larrea等[16]同样利用SDS-PAGE研究西班牙Teruel干腌火腿在加工过程中肌肉蛋白降解情况,结果表明Teruel干腌火腿在加工过程中水溶性蛋白质在腌制和风干阶段降解明显,肌原纤维蛋白在成熟阶段降解更明显,本研究结果均与之相似。
3.2 然而传统的 SDS-PAGE电泳无法分析鉴定出分子量或等电点相同的蛋白质,穆雪[17]成功建立了火腿
肌肉蛋白质双向电泳方法,同时对4个不同品牌的金华火腿样品进行了差异蛋白质组学分析,分别得出了4种样品双向电泳凝胶技术的平均蛋白点数;Aldo Di Luccia等[18]通过采用双向电泳研究干腌火腿成熟过程中肌浆蛋白与肌原纤维蛋白的降解情况,证明了双向电泳是研究肌肉蛋白酶敏感性及蛋白图谱的有效方法,结果表明肌动蛋白、原肌球蛋白与肌球蛋白轻链在火腿加工成熟过程中逐渐递减消失,同时鉴定发现出一种新型肌动蛋白;Théron等[19]通过双向电泳分离Bayonne火腿股二头肌与半膜肌中水不溶性蛋白,并以MALDI-TOF/TOF MS对分离的蛋白进行鉴定,发现这两个部位之间存在73个蛋白或肽段有差异表达;本研究同样利用MALDI- TOF/TOF MS鉴定出ATP合成酶β亚基,检索分值为129分,且结果可信度较高。
3.3 在干腌火腿加工过程中,组织蛋白酶B和L是肉中重要的内肽酶,对肌肉蛋白质有广泛的降解作用,组织蛋白酶在火腿从腌制到成熟整个加工过程都是有活性的,其活性会受到原料品种、原料肉品质、加工工艺、腌制剂的组成等多种因素的影响,这些因素的任何变化都可能会导致火腿最终品质的改变[20,21]。本研究中组织蛋白酶B和L在宣威火腿加工过程中均有一定活性,组织蛋白酶B的活性随着加工过程的进行而逐渐下降,而组织蛋白酶L的活性从腌制前到腌制结束时呈下降趋势,到风干结束时上升到最大随后又开始下降。
3.4 分析原因可能是由于在火腿加工初期,微生物开始生长,导致pH值下降,因此组织蛋白酶L活性升高,而随后的风干到成熟过程外界温度逐渐升高,火腿的水分蒸发加剧,含盐量也有所增加,因此组织蛋白酶的活性受到抑制,下降较为明显。Parreno等[22]研究发现,与其他蛋白酶相比,组织蛋白酶B的活性最为稳定,本研究中的组织蛋白酶活力始终呈下降趋势;还有学者[14,23]报道称组织蛋白酶B和B+L在加工初始阶段活性最强,而加工结束时的组织蛋白酶B、B+L等酶残留活性是初始时的5%~10%,而本研究宣威火腿到加工结束时组织蛋白酶B、L残余活力分别为腌制前的10.25%和8.56%。组织蛋白酶B+L的残留活性是判断西班牙干腌火腿质构缺陷的重要指标,因此测定内源蛋白酶活性对于预防和调控干腌火腿的品质具有积极意义[24]。
4 结论
本研究利用双向电泳技术对宣威火腿加工过程中蛋白质降解情况进行了系统研究,所得宣威火腿加工过程中肌肉蛋白质存在明显的降解情况,其中成熟中期到成熟结束阶段蛋白降解较为突出,并利用MALDI-TOF/TOF MS鉴定这两个加工阶段分离出的差异蛋白共 39种,与此同时宣威火腿组织蛋白酶 B和L的潜在活力在加工过程中均逐渐下降。
