miR-34a对人脂肪间充质干细胞成骨向分化的调控
2018-09-07陈睦虎
王 亮,钟 武,陈睦虎
(西南医科大学附属医院急诊科,四川泸州 646000)
组织工程技术已成为骨缺损修复最有前途的治疗方法之一[1-2]。人脂肪间充质干细胞(human adipose-derived stem cells, hASCs)作为间充质干细胞(mesenchymal stem cells, MSCs)的一个重要来源,在骨组织工程中受到广泛关注[3-4]。但是,由于缺乏调控hASCs成骨分化途径的相关技术,而限制了基于hASCs细胞治疗的进一步发展。
microRNA(miRNA, miR)是一类单链RNA分子,通过结合靶基因3′UTR,抑制靶基因翻译或使其降解[5]。miRNA在多种生物学过程中发挥重要作用,包括胚胎干细胞的增殖、凋亡、分化、形态发生以及癌变和血管生成[6-7]。最近的研究报道了几种miRNA,例如miR-22、miR-100、miR-106a、miR-146a和miR-148b参与了干细胞的成骨分化[8-11]。而miRNA在骨髓MSCs成骨分化中的调控机制尚待进一步研究。
RUNX2基因作为一种成骨相关的关键转录因子,研究发现miR-34a通过调控RUNX2基因的表达而影响MSCs的增殖和成骨分化[12-13]。因此,本研究观察miR-34a在体外和体内对hASCs成骨分化的作用,并探讨视网膜母细胞瘤结合蛋白2(retinoblastoma binding protein 2, RBP2)/RUNX2通路的作用,旨在揭示miR-34a在hASCs成骨分化中的作用机制,探讨其能否作为未来骨再生治疗的一个治疗靶点。
1 材料与方法
1.1主要试剂Opti-MEM培养基购自上海赛默飞世尔科技公司,骨诱导培养基购自苏州赛业生物科技公司,cDNA第一链合成试剂盒、SuperReal PreMix Plus(SYBR Green)试剂盒购自北京天根生化科技公司,Trizol试剂北京索莱宝科技有限公司,Lipofectamine 2000转染试剂购自美国Invitrogen公司,碱性磷酸酶(ALP)染色试剂盒购自北京雷根生物技术公司,茜素红购自南京南试化学试剂有限公司,RIPA裂解缓冲液购自碧云天生物技术公司,兔抗人RBP2单克隆抗体、羊抗人P27单克隆抗体、羊抗人RNUX2单克隆抗体、兔抗人β-actin多克隆抗体为美国Sigma产品。
1.2hASCs分离和培养实验根据西南医科大学附属医院伦理委员会的制度指导进行。脂肪组织是通过接受选择性抽脂手术或其他腹部手术的捐赠者获得的,手术均经过书面同意和批准。捐赠者年龄在19~45岁之间,并排除了恶性肿瘤和代谢性疾病者,研究包括来自不同捐献者(2名男性和2名女性)的4份脂肪组织样本,均在无菌条件下,小心移除纤维组织和血管后,共切取10 g脂肪组织,采用无菌PBS清洗以清除污染的碎片和红细胞。从获得的脂肪组织中分离hASCs,然后将hASCs以密度为2×106/L重新悬浮在12 mL正常生长培养基中,置于75 cm2培养瓶中培养至第3代,并用于以下实验。
1.3miRNA转染由广州锐博生物科技公司合成miR-34a模拟物(miR-34a)、抑制剂(miR-34al)和阴性对照(miR-NC)。根据说明书要求,在终浓度为200 nmol/L的Lipofectamine 2000转染试剂中将合成物转染到hASCs中。整个转染过程在opti-mem培养基中进行,并置于50 mL/L CO2的37 ℃湿润培养箱中转染6 h。转染后观察并计算:转染效率=绿色荧光细胞数/总细胞数×100%。转染成功后,去除转染工作液,更换成骨诱导培养基进行分化。
1.4体外成骨分化将hASCs细胞按2×105个/cm2接种在6孔板中,加入含有高糖的Dulbecco改良的Eagle’s培养基(H-DMEM),当细胞生长至80%融合时,用骨诱导培养基进一步诱导分化,3 d更换1次骨诱导培养基。于骨诱导后的第6天取样,后续进行相关实时定量PCR(qRT-PCR)和Western blot检测;分别于骨诱导后的第6天和15天时,用ALP染色和茜素红染色检测钙化情况和矿化基质的产生。
1.5ALP染色和茜素红染色测定ALP活性以评估成骨细胞表型。ALP染色根据试剂盒说明书进行测定。采用茜素红染色检测诱导后期的钙化,用PBS洗涤24孔板中的细胞,在950 mL/L乙醇中固定10 min,用蒸馏水洗涤后加入茜素红溶液(1 mL/L,pH 8.3)染色30 min。用水洗涤2次后进行显微镜观察。
1.6qRT-PCR分析使用Trizol试剂说明书,分别提取各组hASCs转染细胞的总RNA,然后将RNA通过逆转录-聚合酶链反应反转录合成cDNA,以miRNA-R为内对照进行实时荧光定量。PCR扩增反应参数为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃ 退火20 s,72 ℃延伸32 s,进行40个循环。miRNA-R引物序列:5′-CTCAACTGGTGTCGTGGA,miR-34a引物序列:5′-ACACTCCAGCTGGGTAAAGTGCTTATAGTGCA。根据各组的平均Ct值,计算出每个目的基因相对于起始反应的拷贝数。
1.7双荧光素酶报告基因的构建及双荧光报告系统检测94 bp RBP2 3′UTR片段包含hsa-miR-34a及其突变片段的预期结合位点40 bp侧翼序列和末端含有切割位点XbaⅠ(5′末端)和NotⅠ(3′末端),并由生工生物工程(上海)股份有限公司合成(表1),短延伸含有切割位点XbaⅠ(5′末端)和NotⅠ(3′末端)。构建的质粒分别被称为P-RBP2-WT(RBP2-野生型)和P-RBP2-MUT(RBP2-突变型)。扩增子用XbaⅠ和NotⅠ切割,并克隆到pRL-TK载体的海肾荧光素酶基因的XhoⅠ和NotⅠ切割位点之间。
使用Lipofectamine 2000试剂将每个载体以及100 ng pGL3和200 nmol/L miR-34a模拟物或miR-NC转染到293T细胞中。转染后24 h收集细胞,并使用双荧光素酶报告基因测定系统测定海肾和萤火虫萤光素酶活性。
表1RBP2的启动子引物设计序列
Tab.1 RBP2 promoter primer design sequence

基因Forward (5'-3')Reverse (5'-3')P-RBP2-WTctagaAGAAAATACTCGCACTTCCT-CAGAACCCTCTTTCTTGTTAACGGGTATCTTTTGTT-GGTGTGTTTTGCTCTTACATTACAGATAGACgcggccgcGTCTATCTGTAATGTAAGAG-CAAAACACACCAACAAAAGATACCCGTTAACAA-GAAAGAGGGTTCTGAGGAAGTGCGAGTATTTTCTtP-RBP2-MUTctagaAGAAAATACTCGCACTTCCT-CAGAACCCTCTTTCTTGTTACTTAAGCTCTTTTGTT-GGTGTGTTTTGCTCTTACATTACAATAGACgcggccgcGTCTATCTGTAATGTAAGAG-CAAAACACACCAACAAAAGAGCTTAAGTAACAA-GAAAGAGGGTTCTGAGGAAGTGCGAGTATTTTCTt
斜体下划线:miR-34a结合位点和突变位点的序列。
1.8Westernblot检测RBP2/RUNX2通路蛋白表达在冰上使用RIPA裂解缓冲液提取细胞蛋白质,并通过电泳将蛋白质转移至聚偏二氟乙烯膜上。然后将膜在溶于TBS的50 g/L脱脂奶粉液中封闭1 h,加入1∶1 000稀释的RBP2单抗、1∶200稀释的RNUX2单抗、1∶100稀释的P27单抗和1∶2 000稀释的β-actin单抗,4 ℃温育过夜。洗膜3次,加入1∶1 000稀释的抗兔或抗羊辣根过氧化物酶标记的二抗,室温孵育2 h,使用化学发光ECL试剂检测抗体和抗原复合物。
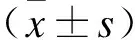
2 结 果
2.1hASCs成骨分化hASCs(图1A)可被诱导成为成骨细胞(图1B),并且通过ALP染色证实为成骨细胞(图1C),茜素红染色显示存在基质矿化(图1D)。
图1hASCs的形态及其成骨分化
Fig.1 The morphology of hASCs and their osteogenic differentiation (×40)
A:hASCs细胞形态;B:hASCs诱导的成骨细胞的形态;C:hASCs诱导的成骨细胞第6天的ALP染色;D:hASCs诱导的成骨细胞第15天的茜素红染色。
2.2miR-34a对hASCs成骨分化的促进作用转染72 h后,通过倒置荧光显微镜观察,结果显示hASCs转染效率为80%~90%(图2)。qRT-PCR结果显示,与阴性对照组比较,在转染第0、4、8和12天,miR-34a模拟物组细胞miR-34a表达显著升高(P<0.05),而miR-34a抑制剂组表达显著下降(P<0.05,图3)。

图2倒置荧光显微镜观察miR-34a转染hASCs情况
Fig.2 miR-34a lentiviral transduction efficiency and effect (×200)

图3miR-34a在hASCs成骨诱导不同时间点的表达变化
Fig.3 Expression of endogenous miR-34a during hASCs’ osteogenic induction
与miR-NC组比较,*P<0.05。
2.3通过miR-34a直接靶向RBP2miR-34a对RBP2表达影响的结果显示,miR-34a模拟物组RBP2蛋白表达较miR-34a抑制剂组显著降低(P<0.05,图4)。通过RNA22预测软件预测miR-34a在RBP2 3′UTR中的结合位点(图5A)。进一步通过荧光素酶报告以确定miR-34a是否可以直接靶向这些位点,分析结果显示,与miR-NC组相比,miR-34a显著抑制含有野生型RBP2(P-RBP2-WT)的荧光素酶表达(P<0.05),但对突变型RBP2(P-RBP2-MUT)组没有影响(图5B)。这表明miR-34a直接靶向RBP2。

图4Westernblot检测miR-34a对hASCs细胞中RBP2表达的影响
Fig.4 The effect of miR-34a on the expression of RBP2 in hASCs cells detected by Western blot
与miR-NC组相比,*P<0.05;与miR-34al组相比,#P<0.05。
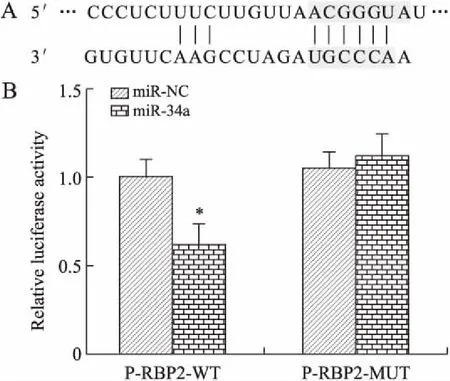
图5RBP2作为miR-34a的直接靶基因验证
Fig.5 Validation of RBP2 as a direct target gene of miR-34a
A:miR-34a部分结合到RBP2的3'UTR区域;B:在P-RBP2-WT或P-RBP2-MUT组中miR-34a模拟物转染细胞的荧光素酶活性。与miR-NC组相比,*P<0.05。
2.4miR-34a对RUNX2的表达影响miR-34a模拟物RUNX2和P27蛋白表达高于miR-34a抑制剂组(P<0.05,图6)。

图6Westernblot检测miR-34a对hASCs细胞RUNX2和P27表达的影响
Fig.6 Western blot analysis of miR-34a’s effect on RUNX2 and P27 expressions in hASCs cells
与miR-NC组相比,*P<0.05;与miR-34al组相比,#P<0.05。
3 讨 论
miRNA治疗已经成为目前组织工程最具吸引力的研究领域之一[14-15]。最近,许多研究报道miRNA是干细胞治疗或分化的重要调节因子,数十种miRNAs已被证实为转录基因表达的重要负调控因子或正调控因子,在成骨过程中发挥关键作用[16-18]。本研究结果显示,hASCs成骨分化中miR-34a的表达显著增加,miR-34a模拟物对成骨分化具有明显促进作用,而miR-34a抑制剂则阻碍了成骨分化。这提示miR-34a可能对hASCs的成骨分化有正调控作用。
miR-34a在一些肿瘤组织中异常表达,并通过靶向不同的基因作为促进肿瘤生长的调节剂[19-20]。本研究为探索miR-34a调控hASCs成骨分化的分子机制,采用RNA22预测软件预测72个miRNAs与RBP2 mRNA的3′UTR结合折叠能,进而筛选得到miR-34a具有与RBP2 mRNA的3′UTR结合的最大可能性(△G=-17.2 kcal/mol)。RBP2作为直接结合于细胞周期蛋白依赖性激酶抑制剂成员P27的启动子,通过结合Cyclin-CDKs调控系统,抑制细胞周期从G1向S期的转变[21]。研究发现,抑制RBP2表达可促进hASCs体内外成骨。本研究结果显示,miR-34a模拟物能促进RBP2蛋白水平下调,而miR-34a抑制剂组的RBP2表达增高。同时,双荧光素酶报告基因测定显示RBP2为miR-34a的直接靶标。这有力表明在成骨分化期间RBP2受miR-34a调节。
了解干细胞成骨分化的调节机制是治疗各种骨病的基础。干细胞的成骨分化是涉及多个基因表达的级联机制[22-24]。目前,关于成骨分化的调控研究主要基于转录因子。RUNX2是一种重要的成骨细胞谱系决定性转录因子,其诱导终末成骨分化所需的骨唾液蛋白(BSP)、OC、OSX和骨桥蛋白(OPN)的表达[25-27]。RUNX2对于成骨细胞分化和骨骼形态发生至关重要,研究表明成骨细胞分化主要与骨髓基质细胞中RUNX2活性增加有关[28]。已证实,RUNX2是hADSCs成骨分化过程中miRNA过表达的靶基因,可能通过miRNA参与调节分化。本研究结果显示,miR-34a模拟物组RUNX2和P27蛋白表达上调,提示miR-34a可以上调RUNX2的表达。
总之,miR-34a通过与靶基因RBP2结合在hASCs成骨分化中发挥重要作用。RBP2和miR-34a可以作为未来治疗骨骼疾病的潜在治疗靶点。
